浅析芒果属植物叶绿体DNA提取方法
2019-09-01何飞宇
何飞宇
[摘要]芒果是重要的经济果树之一,富含多糖、单宁、多酚等次生代谢的干扰物质,不易获取DNA。基于此,为提升提取DNA的质量,以芒果属植物为研究对象,通过对比芒果与扁桃成熟叶片中的DNA质量情况,分析芒果属植物叶绿体的DNA提取方法。
[关键词]芒果属;植物叶绿体;DNA;提取方法
[中图分类号]S667.7[文献标识码]B
我国多个芒果属中芒果的经济效益最高,栽培范围最广。我国是栽培芒果的重要国家,并且芒果资源较为丰富,种类已达到1000多种。已有学者采用植物学、生物化学、分子生物学等方式鉴定芒果属的果类种质与亲缘关系,但从总体来看采用植物叶绿体提取芒果属的DNA较为方便。
1 实验试剂与过程
实验地点为广西壮族自治区亚热带作物研究所。实验的材料为芒果、扁桃。实验药品有Buffer I:50 mmol·L-1 Tris C(pH值为8.0),30 mmol·L-1 EDTA,1.2 mol·L-1 NaCl,0.2 mol·L-1 Vc(抗坏血酸),10 g·L-1 PVP即聚乙烯毗咯琳酮C(pH值为3.6)。Buffer II:50 mmol·L-1 Tris(pH值为8.0),30 mol·L-1 EDTA,1.2 mol·L-1 NaCl,5 mmol·L-1 p-琉基乙醇,p=0.1%(W/V)BSA(牛血蛋清白)。Buffer III:120 mmol·L-1 NaCl,80 mmol·L-1 EDTA,10 g·L-1 PVP C(pH值为8.0)。Buffer IV:50 mmol·L-1 Tris(pH值为8.0),30 mmol·L-1 EDTA。TE:0.4 mol·L-1 NaCl,10 mmol·L-1 Tris-HCl,1.0 mmol·L-1 EDTA。
采用绿色、健康、无病虫害的叶片数张,采集后将其放置在预冷的水壶中,然后将其快速带入实验室,然后再用干净的纱布擦拭干净,应保证叶片干净后才能开展相关的实验工作。同时,再用锡箔纸来包裹叶片做好遮光工作,将其放置在4 ℃的环境内48 h,之后再经过液痰后快速进行冷冻处理,然后将其放置在-70 ℃的保存箱内进行备用。
2 实验具体方法
2.1芒果DNA检测
提取芒果的基因组质量,与提取材料和材料保存有关。砖红色的幼嫩芒果叶片材料,含有丰富且高浓度的DNA基因组;由于保存时间或是老化现象,提取DNA基因组时芒果叶片中的单宁、多糖、多酚等一些次生代谢的物质含量较高。提取芒果DNA基因组时,应将材料保存好,并做好前期的材料准备工作,此外也应注重提取芒果基因组DNA的操作技术,确保芒果属DNA基因组的提取质量,例如采用液氮方法研磨材料。
2.2实验方法cPDNA的电泳检测和OD值的测定
实验时取出2 μL的cpDNA溶液,然后在0.8%的琼脂糖凝胶上进行电泳,并将电泳的缓冲设置为0.5×TBE、电泳设置为45 min、恒压设置为110 V,并在紫外凝胶成像系统内观察测试结果,然后在对成像拍照。针对来自8个扩增不同液体的植物叶绿体DNA的SSR引物,其反应体系为2 μL(5 U·μL-1) Taq DNA Polymerae、1μL(10μmol·L-1)Forword Primer、0.5μL×dNTP、1μL20ng/μL葉绿体DNA,加ddH2O到20μL。其反应程序如下:95 ℃ 5 min、95 ℃ 1 min,退火1 min,退火的温度因物而异;72 ℃ 2 min,32次循环,最后72 ℃ 10 min时,电泳检测检测PCR产物。
2.3叶绿体的显微观察
将1 mL BufferⅡ的溶液与叶绿体融合,并将其放在载玻片上,然后用盖玻片将其盖住,将其制成临时装片,采用100×油镜观察叶绿体。
2.4CTAB的提取法
将CTAB作为提取芒果基因组的DNA,有关研究学者采用这种方法在提取液当中加入PVP粉末和β-的巯基乙醇等一些抗氧化的试剂保护机体组的DNA,避免其与多酚类物质结合。还有的研究学者采用了24∶1的酚氯仿异戊醇混合液抽,经过将CTAB提取液进行恒温水浴后得到了清液,然后将其重复抽提2次,抽提的溶液和上清溶液两者的体积比例是1∶1,在一般情况下采用饱和酚∶异戊醇∶氯仿=25∶1∶24混合的溶液对其进行抽取,而如果采用这种方法时将饱和酚去除,也能将芒果属中的高质量基因组的DNA提取出来。
2.5试剂盒提取
采用康为世纪公司的Mango Gen DNA Kit的芒果基因组DNA提取试剂盒,将DNA提取出来,但通过紫外分光光度计检测发现采用这种方法提出芒果基因组DNA的浓度相对较低,并且采用这种方式的投入较大、花费较高。对比试剂盒法、高盐-低pH法、CTAB提取法提取植物叶绿体DNA的效果,采用DNAout试剂盒法能够清除物质植被中的蛋白质、多糖、酚类等代谢物质,得出OD230/OD260>2.000,OD280/OD260约1.800,采用高盐-低pH方法所提取的叶绿DNA的产率较高,高于75.8 ng·μg-1。
2.6 检测叶绿体DNA中的SSR
采用叶绿体DNAout试剂盒、高盐低PH的cpDNA等提取方法,并使用SSR引物,选出8对,扩增cpSSR数量,由此能够得出采用cpDNA提取方法具有一定的可靠性。
使用扁桃与芒果的cpDNA作为基本模板,使用引物来扩增PCR,通过验证得出采用以上两种方法能够扩增出层次清晰、亮度更好、完整性较好的谱带。由此能够得出,采用这两种方法在提取物质中cpDNA的浓度时较为理想,质量相对较高,能够将其用于开展后期工作。
2.7 显微观察芒果属的植物叶绿体
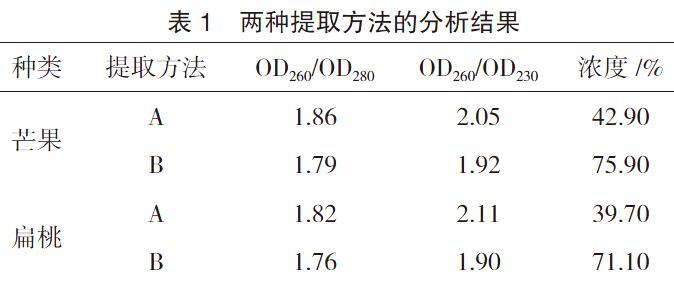
采用植物叶绿体的DNAout与高盐-低pH检测方法,能够得出高纯度、杂质少、背景清晰的叶绿体显微成像,因此可以将这两种方法应用于提取扁桃和芒果DNA叶绿体,但是采用高盐-PH提出的叶绿体细胞的浓度较高。两种提取方法的分析结果如表1所示。
2.8 SDS提取
使用高盐的TE溶液,将0.8 mol·L-1 NaCl加入TE的溶液中,在溶液中加入NaCl能够检测样品中的多糖含量,有效减少溶液中的其他物质造成干扰。通过提升SDS缓冲溶液的浓度,能够有效减少提取基因组DNA的时间,并且也保障提取基因组DNA的质量。使用这种提取方法能够不断增加PCR的含量,但是产物的质量和效率可能会出现不同的结果。此外,也应该合理控制提取的时间与所研磨颗粒的粗细度。
3 结果分析
在研究叶绿体基因组的过程中,提取优质的cpDNA是提取芒果属的前提,采用叶绿体基因组提取方法与全基因组DNA的提取方法相比,cpDNA难度大。cpDNA存在于叶绿体的细胞中,分离难度大;线粒体DNA与核DNA提取cpDNA时,会受到干扰,从而制约了获取cpDNA效率。在提取cpDNA时,获得较为完整的叶绿体能保障cpDNA的获取质量。也可在冰上操作,但要做好研钵经液氮预冷工作,由此能减少组织的褐化程度,并保障叶片组织能够充分冻结,保障叶绿体的完整性。高盐-低pH的提取率较高,叶绿体DNAout的试剂盒方法操作較为简单,提取出的cpDNA质量较好。采用这两种方法都能获得实验所要求的cpDNA,从提取的产率角度来看,采用高盐-低pH的实验方法相对较好,但从操作简单和提取质量的角度来看,采用叶绿体DNAout的试验盒方法较好。
[参考文献]
[1] 张宇,黄国弟,李日旺,等.芒果属植物叶绿体DNA提取方法的研究[J].经济林研究,2017,35(3):50-54.
[2] 谢海坤,焦健,樊秀彩,等.中国野生葡萄叶绿体分离及叶绿体DNA提取的研究[J].西北植物学报,2016,36(7):1464-1469.
[3] 谢海坤,焦健,樊秀彩,等.基于高通量测序组装‘赤霞珠叶绿体基因组及其特征分析[J].中国农业科学,2017,50(9):1655.
[4] 黎金燕,王春晖,陈天带,等.高盐低pH法提取尾叶桉叶绿体DNA方法建立及质量分析[J].分子植物育种,2017(3):890-894.
