有氧运动增强骨骼肌α2-肾上腺素受体介导的交感缩血管反应
2019-08-30韩书娜杨焱程蕾于乐
韩书娜 杨焱 程蕾 于乐
摘 要:目的:观察有氧运动对骨骼肌安静以及收缩时交感缩血管反应的影响并探讨α2-肾上腺素受体(α2-AR)在其中的可能作用机制。方法:45只SD大鼠随机分为对照组(C)、中等强度有氧运动组(M)、高强度有氧运动组(H),M组和H组进行8周跑台运动。实验结束后,麻醉大鼠,行腰部交感神经干和坐骨神经电刺激分别诱导交感缩血管反应和小腿三头肌收缩并测定股动脉电导(FVC)。分别于灌注生理盐水、α2-AR阻断剂(育亨宾)、育亨宾+一氧化氮合酶阻断剂(左旋-硝基精氨酸甲酯,L-NAME)时记录骨骼肌安静时以及收缩时FVC对交感电刺激的变化率(%FVC,即交感缩血管反应)。功能性抗交感用安静时%FVC与肌肉收缩时的差值表示(△%FVC=%FVC安静-%FVC肌肉收缩)。结果:1)交感缩血管反应(%FVC)。灌注生理盐水时:肌肉安静和收缩时,M组和H组%FVC高于C组(P<0.05);灌注育亨宾时:肌肉安静以及收缩时,M组和H组%FVC均显著性下降(P<0.05),C组%FVC无显著性变化(P>0.05);灌注育亨宾+L-NAME时:肌肉安静和收缩时,各组%FVC均显著性升高(P<0.05),M组和H组%FVC高于C组(P<0.05)。2)功能性抗交感(△%FVC)。灌注生理盐水时:M组和H组△%FVC均高于C组(P<0.05);灌注育亨宾时:H组△%FVC显著性下降(P<0.05);灌注育亨宾+L-NAME时:M组和H组△%FVC下降(P<0.05),C组无显著性变化(P>0.05)。结论:长期有氧运动能够增强骨骼肌安静和收缩时α2-AR介导的交感缩血管反应。
关键词:有氧运动;骨骼肌;交感缩血管反应;功能性抗交感;一氧化氮;α2-肾上腺素受体
中图分类号:G804.2 文献标识码:A文章编号:1006-2076(2019)03-0064-07
交感神经系统兴奋性增加时,神经纤维末梢以胞吐方式釋放神经递质,包括去甲肾上腺素(noradrenaline,NE)及其共存递质三磷酸腺苷(adenosine triphosphate,ATP)、神经肽Y(neuropeptide Y,NPY),分别与骨骼肌血管床突触后α-肾上腺素能受体(α-adrenoreceptors,α-ARs)、嘌呤型受体以及NPY受体结合,进而引起血管收缩[1]。研究证实[2],上述α-ARs(包括α1-和α2-AR)以及非AR(即嘌呤型受体和NPY受体)在骨骼肌安静状态下和收缩时均可产生交感缩血管反应。急性运动时,内脏以及非运动肌交感神经活性增加、血管收缩,然而运动肌(参与收缩的骨骼肌)交感缩血管反应则明显减弱以保证血流灌注和代谢所需并调节体循环动脉压[2]。学者将肌肉收缩抑制交感缩血管反应的生理现象称为“功能性抗交感(functional sympatholysis)”[3]。功能性抗交感的具体机制尚未完全明确,运动时突触后受体反应性下降可能是原因之一。研究发现[4],一氧化氮(nitric oxide,NO)能够激活ATP敏感的钾离子通道并通过关闭电压门控性钙离子通道减少α2-AR介导的胞外钙内流,进而抑制交感缩血管反应并改善功能性抗交感。
关于运动训练对骨骼肌交感缩血管反应和功能性抗交感的影响,不同研究的结论并不一致。既往报道,运动训练后α-ARs介导的交感缩血管反应增强[5]、减弱[6]或不变[7]。然而上述研究均针对离体血管并利用非选择性和选择性阻断剂探讨α-ARs以及α1-AR介导的交感缩血管反应。孙一等[8]最近的一项研究显示,有氧运动能够增强交感缩血管反应并改善功能性抗交感,且上述效应呈现运动强度依赖性,其机制与NO含量和/或生物利用度增加及其诱导的舒血管作用有关。然而运动增强骨骼肌交感缩血管反应是否经由突触后特异性α-ARs介导尚不得而知。由于α2-AR在交感神经支配的血管调控中起重要作用[4],故此推测α2-AR可能参与了骨骼肌交感缩血管反应以及功能性抗交感对运动训练的生理适应。本研究的目的旨在观察8周不同强度(中等强度和高强度)有氧运动对骨骼肌安静以及收缩时交感缩血管反应的影响并利用选择性α2-AR阻断剂和一氧化氮合酶(nitric oxide synthase,NOS)阻断剂探讨α2-AR在其中的可能作用机制。我们假设:1)运动训练后利用α2-AR阻断剂可减轻交感刺激诱导的血管收缩,说明运动能够增强α2-AR依赖性交感缩血管反应;2)运动改善功能性抗交感的效应可被α2-AR阻断剂所抵消;3)NOS联合α2-AR阻断剂并不能进一步改变功能性抗交感,提示NO抑制交感缩血管反应是经由α2-AR途径介导的。
1 研究对象和方法
1.1 实验动物
45只健康雄性Sprague-Dawley(SD)大鼠,8周龄,分笼饲养(每笼5只)于12 h-12 h光暗交替,环境可控(温度21℃~23℃、湿度40%~70%)的动物房内,自由进食饮水。所有动物实验由本单位伦理委员会批准后实施。
1.2 分组运动训练
所有大鼠预先熟悉环境1周并利用电动跑台(Panlab LE8710,西班牙)进行5 d适应性训练(速度为10 m/min,坡度为0°,10 min/d)后,将其随机分为3组,每组15只。1)对照组(control group,C),于鼠笼内安静饲养8周;2)中等强度有氧运动组(mild intensity aerobic exercise group,M),进行8周中等强度跑台运动,方案为:速度为20 m/min,坡度为0°,30 min/d,600 m/d,5 d/周;3)高强度有氧运动组(high intensity aerobic exercise group,H),进行8周高强度跑台运动,方案为:速度为40 m/min,坡度为0°,运动3 min后休息1 min为1组,共完成5组,600 m/d,5 d/周。M组和H组仅运动强度不同,运动负荷(600 m/d)和运动频率(5 d/周)均保持一致。研究证实[8-9],上述运动方案能够增加心脏重量和心指数,上调骨骼肌柠檬酸合酶活性并改善内皮依赖性血管舒张反应以及骨骼肌功能性抗交感。
1.3 外科手术
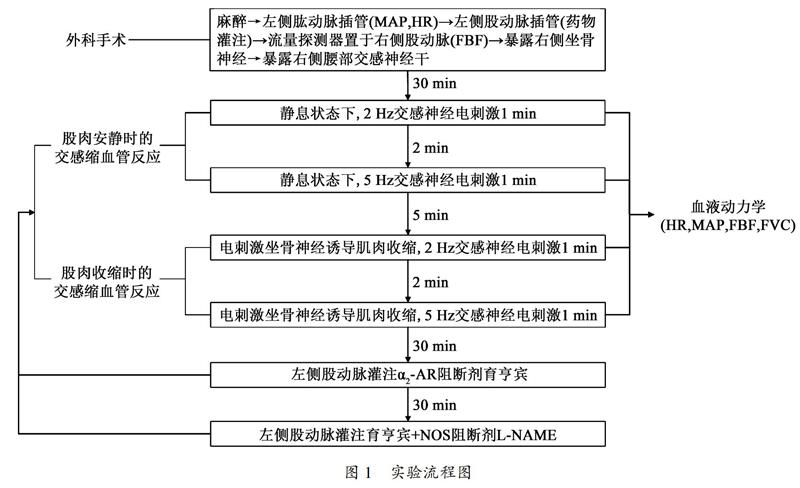
末次训练后24 h,参照Jendzjowsky等[9]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1266和孙一等[8]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1544的研究方法进行外科手术。大鼠麻醉后行气管切开术以维持自主呼吸;左侧肱动脉插管并连接固态压力换能器(Abbott,美国)以连续测定动脉血压,由压力波形获取平均动脉压(mean arterial pressure,MAP)和心率(heart rate,HR);左侧股动脉插管以备药物灌注;利用流量探测器(0.7 V,Transonic Systems,美国)检测右侧股动脉血流量(femoral artery blood flow,FBF)。暴露右侧坐骨神经并连接C型电极,解剖小腿三头肌并通过跟腱连接压力传感器(Model MLT1030/D,美国),通过电刺激坐骨神经诱导肌肉收缩。打开腹腔暴露右侧交感神经干,于腰4/腰5水平连接双极刺激电极(Digitimer DS3,英国),通过电刺激右侧交感神经干诱导交感缩血管反应。手术后稳定30 min再进行以下实验。
1.4 骨骼肌安静时以及收缩时的交感缩血管反应
分别在左侧股动脉灌注生理盐水、灌注α2-AR阻断剂(育亨宾,0.5 mg/kg)、同时灌注育亨宾+一氧化氮合酶阻断剂(左旋-硝基精氨酸甲酯,Nω-nitro-L-arginine methyl ester hydrochloride,L-NAME,5 mg/kg)3种药物灌注状态下,于骨骼肌安静时以及收缩时,以2 Hz和5 Hz频率电刺激右侧交感神经干,检测交感缩血管反应的变化。参照Jendzjowsky等[9]和孙一等[8]的研究方法,电刺激坐骨神经(40 Hz,60 trains/min、0.1ms脉冲)诱导肌肉节律性收缩持续8 min,第3 min和第6 min时给予交感电刺激(1 ms、1mA脉冲)持续1 min。药物灌注实验之间间歇30 min,不同频率(2 Hz和5 Hz)交感电刺激之间间歇2 min,不同肌肉状态下(安静、收缩)实验间歇5 min,以恢复血液动力学。实验流程见图1所示。实验结束后处死动物,取心脏称量重量并计算心指数(心脏重量/体重)。
1.5 数据采集与统计学分析
利用Chart软件(AD Instruments,澳大利亚)采集并记录数据。FBF采样频率为100 Hz,计算股动脉电导(femoral vascular conductance,FVC)=FBF/MAP。基础血液动力学(未经交感刺激且肌肉处于安静状态下)参数(HR、MAP、FBF和FVC)用原始值表示;交感缩血管反应用FVC对交感电刺激的变化率表示[9]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1266,即%FVC=(FVC电刺激-FVC基础值)/ FVC基础值×100%;功能性抗交感用安静时%FVC与肌肉收缩时的差值表示[9]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1266,即△%FVC=%FVC安静-%FVC肌肉收缩。
所有数据以“均数±标准差”表示,使用SPSS 20.0进行统计学分析处理。交感缩血管反应采用三因素(分组×肌肉状态×药物灌注)方差分析,基础血液动力学和功能性抗交感采用双因素(分组×药物灌注)方差分析,体重、心脏重量以及心指数采用单因素方差分析,若F检验具有统计学意义,则使用S-N-K检验进行多重比较。P<0.05定为差异具有统计学意义。
2 结果
2.1 最终样本量
实验过程中,由于手术失败、拒跑、意外死亡、数据偏倚等原因,共剔除大鼠11只,最终样本量n=34,其中C组(n=13)、M组(n=11)、H组(n=10)。
2.2 体重和心脏重量的变化
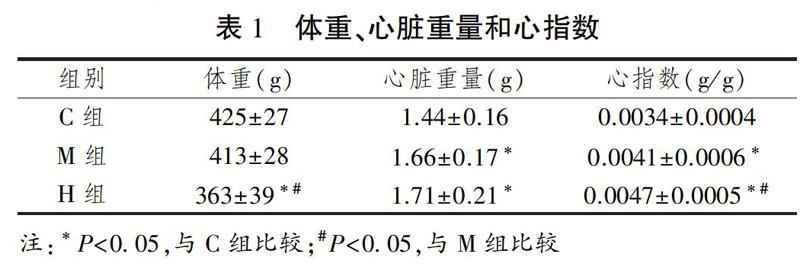
体重、心脏重量和心指数见表1所示。与C组比较,H组体重降低(P<0.05),M组和H组心脏重量和心指数升高(P<0.05);与M组比较,H组心指数增加(P<0.05)。
2.3 基础血液动力学的变化
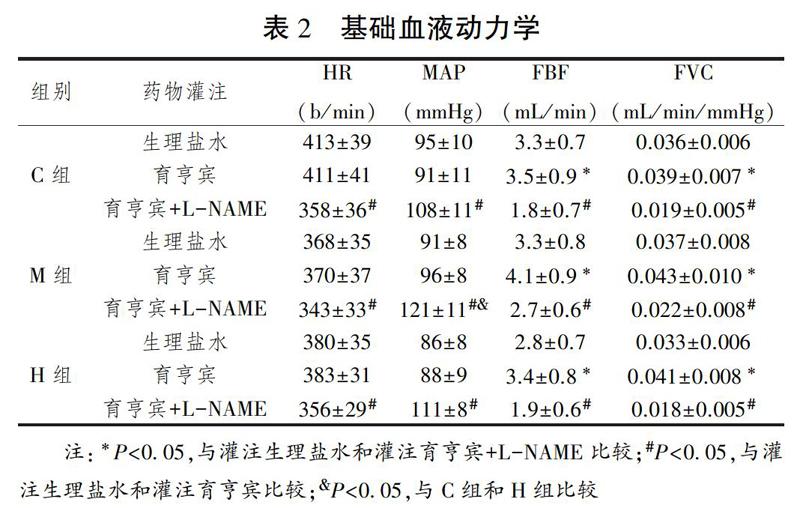
基础血液动力学见表2所示。灌注生理盐水时:各组血液动力学参数均无显著性差异(P>0.05)。灌注育亨賓时:与灌注生理盐水比较,各组FBF和FVC均显著性升高(P<0.05)。灌注育亨宾+L-NAME时:与灌注生理盐水及灌注育亨宾比较,各组HR、FBF和FVC均降低(P<0.05)、MAP升高(P<0.05);组间比较,M组MAP高于C组和H组(P<0.05)。
2.4 交感缩血管反应的变化
交感缩血管反应(%FVC)见图2所示。灌注生理盐水时:肌肉安静时,2 Hz交感刺激时M组和H组%FVC高于C组(P<0.05),且H组高于M组(P<0.05),5 Hz交感刺激时M组和H组%FVC高于C组(P<0.05);肌肉收缩时,2 Hz交感刺激时M组和H组%FVC高于C组(P<0.05),5 Hz交感刺激时%FVC在各组间无显著性差异(P>0.05)。灌注育亨宾时:肌肉安静时,与灌注生理盐水时比较,2 Hz和5 Hz交感刺激时C组%FVC均无显著性变化(P>0.05),M组和H组%FVC均显著性下降(P<0.05),组间比较,2 Hz和5 Hz交感刺激时H组%FVC高于C组(P<0.05),但M组与C组以及M组与H组之间无显著性差异(P>0.05);肌肉收缩时,与灌注生理盐水时比较,2 Hz和5 Hz交感刺激时C组%FVC均无显著性变化(P>0.05),M组和H组%FVC均显著性下降(P<0.05),组间比较则无显著性差异(P>0.05)。灌注育亨宾+L-NAME时:肌肉安静时,与灌注育亨宾时比较,2 Hz和5 Hz交感刺激时各组%FVC均显著性升高(P<0.05),组间比较,2 Hz交感刺激时M组和H组%FVC高于C组(P<0.05),且H组高于M组(P<0.05),5 Hz交感刺激时M组和H组%FVC高于C组(P<0.05);肌肉收缩时,与灌注育亨宾时比较,2 Hz和5 Hz交感刺激时各组%FVC均显著性升高(P<0.05),组间比较,2 Hz和5 Hz交感刺激时M组和H组%FVC高于C组(P<0.05)。
2.5 功能性抗交感的变化
功能性抗交感(△%FVC)如图3所示。灌注生理盐水时:2 Hz和5 Hz交感刺激时M组和H组△%FVC均高于C组(P<0.05),且H组高于M组(P<0.05)。灌注育亨宾时:组间比较,2 Hz和5 Hz交感刺激时M组和H组△%FVC仍高于C组(P<0.05);与灌注生理盐水时比较,C组和M组△%FVC无显著性变化(P>0.05),H组则显著性下降(P<0.05)。灌注育亨宾+L-NAME时:组间比较,2 Hz交感刺激时M组和H组△%FVC高于C组(P<0.05),且H组高于M组(P<0.05),5 Hz交感刺激时H组△%FVC高于C组(P<0.05);与灌注育亨宾时比较,2 Hz交感刺激时各组△%FVC均无显著性变化(P>0.05),5 Hz交感刺激时M组和H组△%FVC下降(P<0.05)。
3 讨论
本研究的目的在于探讨长期有氧运动对骨骼肌α2-AR介导的交感缩血管反应的影响,结果发现:1)有氧运动增强骨骼肌安静时以及收缩状态下α2-AR介导的交感缩血管反应;2)有氧运动改善功能性抗交感,其机制可能与NO对α1-AR和/或非AR依赖性缩血管反应的抑制作用加强有关,而与α2-AR无关。因此,经过规律运动后,肌肉收缩对α2-AR依赖性交感缩血管反应的抑制效应减弱(即α2-AR对于肌肉收缩时的代谢抑制产生了抵抗效应)。
3.1 骨骼肌安静时α2-AR介导的交感缩血管反应
在本研究中,C组安静时使用α2-AR阻断剂后%FVC与灌注生理盐水比较并无显著性差异,提示未经训练大鼠交感缩血管反应并非经由α2-AR介导。然而选择性α2-AR激动剂(可乐定)能够产生强烈的缩血管反应[2]。此外在本研究中,育亨宾灌注后各组基础FVC均显著性增加(见表2),说明α2-AR对于维持骨骼肌安静状态下血管紧张性收缩具有重要作用。与本研究结果一致,Coney等[10]同样证实,未经训练的雄性Wistar-Kyoto大鼠灌注α2-AR阻断剂后骨骼肌安静时交感刺激诱导的缩血管反应并无显著性改变。相反,Thomas等[11]针对雌性SD大鼠的研究则发现,安静对照组骨骼肌安静时交感刺激诱导的缩血管反应是经由α2-AR介导的。可见α2-AR对于交感缩血管反应的作用具有性别特异性。
与孙一等[8]的研究相似,本研究同样发现,8周有氧运动增强骨骼肌安静时的交感缩血管反应,且这一效应呈现运动强度依赖性。育亨宾灌注后M组和H组不同频率(2 Hz和5 Hz)交感刺激诱导的缩血管反应均显著性降低。从育亨宾引起%FVC降低的幅度(图2)可以推测,α2-AR在训练组(M组和H组)大鼠骨骼肌安静时的交感缩血管反应中起约20%~30%的作用。本研究还发现,M组灌注育亨宾时的%FVC与C组无显著性差异,提示中等强度有氧运动对于交感缩血管反应的上调效应完全经由α2-AR介导。对于H组大鼠而言,育亨宾并未完全抵消增强的交感缩血管反应,且2 Hz和5 Hz交感刺激诱导的血管收缩反应仍高于C组,因此推测,除α2-AR外,高强度有氧运动尚能够增强α1-AR和/或非AR依赖性缩血管反应。
同时给予NOS阻断剂和α2-AR阻断剂后,各组大鼠不同频率交感刺激诱导的缩血管反应均显著性增加,说明骨骼肌安静状态下NO对α1-AR和/或非AR介导的缩血管反应起抑制作用。此外,M组和H组%FVC高于C组,提示经过规律训练后骨骼肌中NO对于α1-AR和/或非AR依赖性缩血管反应的抑制效应较未经训练大鼠明显增强。
3.2 骨骼肌收缩时α2-AR介导的交感缩血管反应
本研究中,C组使用育亨宾并未改变肌肉收缩时的%FVC,提示未经训练大鼠(C组)骨骼肌安静以及收缩时的交感缩血管反应可能是经由α1-AR介导的。M组和H组大鼠肌肉收缩时2 Hz交感刺激诱导的缩血管反应高于C组,5 Hz刺激时则无显著性差异;给予育亨宾灌注后,M组和H组2 Hz和5 Hz刺激诱导的血管收缩反应均显著性降低;进一步分析%FVC数据发现,运动训练后α2-AR在2 Hz和5 Hz电刺激诱导缩血管反应中分别起70%和40%的作用;使用α2-AR阻断剂时M组和H组%FVC与C组无显著性差异,提示训练组大鼠骨骼肌收缩时交感缩血管反应增强是经由α2-AR介导的。
运动增强α2-AR依赖性交感缩血管反应的机制可能与α2-AR对NE的亲和力增加、受体表达量/密度上调以及α2-AR介导的信号转导途径造成胞内钙离子浓度改变等因素有关。运动是否能够调节骨骼肌血管AR对NE的亲和力尚无研究涉及。大鼠以80%VO2max進行10周跑台运动后心肌α1-AR密度上调[12]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1553,然而运动对骨骼肌AR表达量/密度的影响未见报道。交感神经末梢释放的神经递质对于神经刺激频率高度敏感,研究发现[13]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1554,低频刺激(1~2 Hz)诱导释放ATP和NE。可以推测,规律运动改变了交感刺激时神经递质的总量和/或成分。然而,Sporkova等的实验显示[14]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1555,动脉注射选择性α1-和α2-AR激动剂后,训练组交感缩血管反应仍高于对照组,提示规律运动增强交感缩血管反应的原因可能主要与突触后受体反应性增强有关,而非神经递质释放量增加所致。
本研究还发现,运动能够改善功能性抗交感且呈现运动强度依赖性,与Jendzjowsky等[9]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1266和孙一等[8]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1544的研究结果基本一致。使用选择性α2-AR阻断剂后,M组大鼠功能性抗交感无显著性变化而H组明显下降,说明中等强度运动后骨骼肌收缩通过特异性抑制α1-AR和非AR、高强度运动则抑制α1-AR、α2-AR和非AR途径介导功能性抗交感。总之,本研究结果提示,肌肉收缩对α1-AR和非AR依赖性缩血管反应的抑制作用增强是运动改善功能性抗交感的主要机制,而运动后α2-AR对肌肉收缩介导的交感抑制产生耐受(抵抗)。α2-AR的变化与本研究假设相悖,同时前期多项研究结果显示[15-16],急性运动对α2-AR的抑制更为明显,而α1-AR则对交感抑制出现耐受。然而Wray等[17]的研究报道,健康男性前臂肌群中等强度收缩时α1-AR和α2-AR介导交感缩血管反应的受抑程度基本一致,高强度收缩时则主要对α1-AR依赖性途径产生抑制。
同时使用L-NAME和育亨宾后,各组动物2 Hz和5 Hz交感刺激诱导的缩血管反应均显著性升高,但M组和H组明显高于C组,提示经过运动训练后骨骼肌NO介导的交感缩血管抑制作用增强。Coney等[10]证实,灌注L-NAME同时补硝普钠充(NO供体)能够恢复骨骼肌安静时的交感缩血管反应,因此NOS阻断剂L-NAME通过抑制NO介导的血管舒张作用而起效。此外,NO在肌肉收缩时还能够抑制α1-AR和非AR介导血管收缩反应[18]ADDINKYMRREF{A1B87CEC-871D-4DCF-ADCA-37F27FFA21B1}1559。结合前人的研究结果以及本研究所得数据可知,高强度有氧运动改善功能性抗交感可能是通过增强NO对α1-AR和非AR依赖性缩血管反应的抑制作用实现的。联合灌注NOS和α2-AR阻断剂后M组和H组功能性抗交感仍高于C组,提示尚存在其他途径参与肌肉收缩抑制交感缩血管反应的生理过程。
4 结论
8周有氧运动能够增强骨骼肌安静和收缩时α2-AR介导的交感缩血管反应。此外,有氧运动还可显著改善骨骼肌功能性抗交感,这一效应可能是通过增强NO对α1-AR和/或非AR依赖性缩血管反应的抑制作用介导的。
参考文献:
[1]Just TP,Cooper IR,DeLorey DS. Sympathetic vasoconstriction in skeletal muscle:adaptations to exercise training[J].Exerc Sport Sci Rev,2016,44(4):137-143.
[2]Fadel PJ. Reflex control of the circulation during exercise[J].Scand J Med Sci Sports,2015,25 Suppl 4:74-82.
[3]Segal SS. Enhanced functional sympatholysis through endothelial signalling in healthy young men and women[J].J Physiol,2016,594(24):7149-7150.
[4]Van Langen JT,Van Hove CE,Schrijvers DM,et al. Contribution of α-adrenoceptor stimulation by phenylephrine to basal nitric oxide production in the isolated mouse aorta[J].J Cardiovasc Pharmacol,2013,61(4):318-323.
[5]Laughlin MH,Woodman CR,Schrage WG,et al. Interval sprint training enhances endothelial function and eNOS content in some arteries that perfuse white gastrocnemius muscle[J].J Appl Physiol,2004,96(1):233-244.
[6]Donato AJ,Lesniewski LA,Delp MD. Ageing and exercise training alter adrenergic vasomotor responses of rat skeletal muscle arterioles[J].J Physiol,2007,579(Pt 1):115-125.
[7]Jasperse JL,Laughlin MH. Vasomotor responses of soleus feed arteries from sedentary and exercise-trained rats[J].J Appl Physiol (1985),1999,86(2):441-449.
[8]孫一,朱荣,李学恒,等.不同强度运动对骨骼肌功能性抗交感活性的影响[J].北京体育大学学报,2017,40(10):50-55.
[9]Jendzjowsky NG,Delorey DS. Short-term exercise training enhances functional sympatholysis through a nitric oxide-dependent mechanism[J].J Physiol,2013,591(6):1535-1549.
[10]Coney AM,Bishay M,Marshall JM. Influence of endogenous nitric oxide on sympathetic vasoconstriction in normoxia,acute and chronic systemic hypoxia in the rat[J].J Physiol,2004,555(Pt 3):793-804.
[11]Thomas GD,Hansen J,Victor RG. Inhibition of alpha 2-adrenergic vasoconstriction during contraction of glycolytic,not oxidative,rat hindlimb muscle[J].Am J Physiol,1994,266(3 Pt 2):H920-929.
[12]Barbier J,Reland S,Ville N,et al. The effects of exercise training on myocardial adrenergic and muscarinic receptors[J].Clin Auton Res,2006,16(1):61-65.
[13]Williams DJ,Sidaway P,Cunnane TC,et al. Mechanisms involved in nicotinic acetylcholine receptor-induced neurotransmitter release from sympathetic nerve terminals in the mouse vas deferens[J].PLoS One,2011,6(12):e29209.
[14]Sporkova A,Perez-Rivera A,Galligan JJ. Interaction between alpha(1)- and alpha(2)-adrenoreceptors contributes to enhanced constrictor effects of norepinephrine in mesenteric veins compared to arteries[J].Eur J Pharmacol,2010,643(2-3):239-246.
[15]Da SRJ,Krause M,Fernandes AJ,et al. Role of alpha- and beta-adrenoreceptors in rat monocyte/macrophage function at rest and acute exercise[J].J Physiol Biochem,2014,70(2):363-374.
[16]Buckwalter JB,Taylor JC,Hamann JJ,et al. Role of nitric oxide in exercise sympatholysis[J].J Appl Physiol,2004,97(1):417-423.
[17]Wray DW,Fadel PJ,Smith ML,et al. Inhibition of alpha-adrenergic vasoconstriction in exercising human thigh muscles[J].J Physiol,2004,555(Pt 2):545-563.
[18]Hearon CM,Kirby BS,Luckasen GJ,et al. Endothelium-dependent vasodilatory signalling modulates α1 -adrenergic vasoconstriction in contracting skeletal muscle of humans[J].J Physiol,2016,594(24):7435-7453.
