PKD1/HDAC5轴在心肌梗死大鼠损伤心肌组织修复中的作用
2019-08-24杨雷刘萍刘暖陶玲玲毛秉豫
杨雷,刘萍,刘暖,陶玲玲,毛秉豫
国家心血管病中心公布的2017 中国心血管病报告指出,心血管病死亡率无论在城市还是农村,均高于所有其他疾病,其中,心肌梗死是引发死亡的重要原因之一,2015 年,急性心肌梗死患者的住院费用高达153.4 亿元[1]。蛋白激酶D1(protein kinase D1,PKD1)广泛参与多种细胞生理学进程,如信号转导、蛋白输送、增殖或凋亡等[2-3],Ⅱa 类组蛋白去乙酰化酶5(Class Ⅱa histone deacetylase 5,HDAC5)是PKD1直接的下游靶标蛋白之一[2]。CID755673是经典的PKD1的特异性阻断剂,广泛应用于PKD1调控的信号通路的研究[4]。肌细胞增强因子2(myocyte enhancer 2,MEF2)是一种特定的促进肌细胞分化的转录因子,参与心肌的病理性重构,与心肌梗死和心力衰竭存在着紧密联系[5]。心肌肌钙蛋白I(cTn I)对于心肌的收缩和舒张进程起着重要的作用,也是心肌梗死病理检测中判定心肌坏死的金指标之一[6]。
本课题组近年来致力于以“PKD1”为靶点的心肌梗死等缺血性心肌病的治疗研究,结果显示PKD1具有诱导大鼠骨髓源性内皮祖细胞分化形成新生血管管腔的作用[7],还同时有促心肌梗死大鼠心肌组织内血管新生的作用[8]。本研究拟进一步探讨PKD1/HDAC5轴在心肌梗死大鼠损伤心肌组织修复中的作用,为基于“PKD1”靶点的调控网络绘制和新药开发提供实验支持。
1 材料与方法
1.1 材料
1.1.1 实验动物 40 只雄性Wistar 大鼠,SPF 级,8 周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0011,动物质量合格证号:11400700315978。
1.1.2 药物与试剂 PKD1(美国Pierce公司);CID755673(北京孚博生物科技有限公司);一抗兔抗HDAC5 多克隆抗体、兔抗MEF2多克隆抗体、兔抗cTn I多克隆抗体、兔抗β-actin多克隆抗体(美国Santa Cruz生物技术公司);山羊抗兔IgG二抗(武汉三鹰生物技术公司);TUNEL 染色试剂盒(上海信裕生物科技有限公司)。
1.1.3 主要仪器 病理切片机(CUT6062 型,德国SLEE 公司);匀浆机(T10 型,德国IKA 公司);垂直型电泳仪(PowerPac HC 型,美国BD 公司);荧光显微镜(Nikon Tis 型,日本尼康公司),配套分析软件NIS-Elements Software BR。
1.2 方法
1.2.1 模型构建及动物分组 根据随机数字表法将大鼠划分为4 组:假手术组、模型组、PKD1(2 mg·kg-1·d-1PKD1)组和阻断剂CID755673(2 mg·kg-1·d-1PKD1+10 ng·kg-1·d-1CID755673)组,每组10 只。模型组采用经典的左冠状动脉结扎术复制心肌梗死模型,假手术组开胸手术但没有进行结扎处理。模型组和假手术组均给予同剂量的生理盐水。尾静脉注射,隔日1次,持续28 d。
1.2.2 HE染色 28 d后处死大鼠,取心尖部心肌组织,置入4%多聚甲醛浸泡固定12 h后,制作厚度为3~4 μm的组织切片,石蜡包埋作常规HE 染色,400 倍放大后取5 个不同视野观察分析。
1.2.3 Masson染色 心肌组织应用碱性品红和苯胺蓝染色,光学显微镜下心肌组织染色为红色,胶原纤维为蓝绿色。采用NIS-Elements Software BR 软件计算胶原容积分数(CVF),CVF=同一图像视野下的胶原面积/该视野的总面积。
1.2.4 TUNEL 染色 取和HE 染色一致的石蜡切片,参照TUNEL 试剂盒说明书染色,细胞核DAPI 复染。荧光显微镜下正常细胞示蓝色,阳性凋亡心肌细胞示红色。每张切片选5个非重复视野,统计阳性细胞个数。
1.2.5 免疫组织化学染色 组织取材同HE 染色。脱蜡、水化、H2O2祛除组织玻片上的过氧化物酶活性后,抗原修复,山羊血清封闭后加入一抗HDAC5(1∶50)、MEF2(1∶200)、cTn I(1∶200)或β-actin(1∶100),4 ℃下孵育过夜,PBS 冲洗3 次;加入IgG二抗(1∶2 000),室温下作用15 min。DAB显色后镜下观察,阳性的细胞呈现棕褐色或棕黄色。400倍视野下取5个不重复视野/切片,计数阳性细胞数量。
1.2.6 免疫印迹检测 取心尖部心肌组织,IKA-T10匀浆机制成组织匀浆后,BCA 法测定蛋白浓度,SDS-PAGE 电泳后将蛋白转移到PVDF膜,添加一抗HDAC5(1∶500)、MEF2(1∶200)、cTn I(1∶1 000)或β-actin(1∶200),4 ℃下孵育12 h,PBS液清洗3次,与IgG二抗(1∶2 000)孵育1 h后TBST洗膜,暗室曝光显影。计算并记录各样本蛋白与β-actin灰度值之比。
1.3 统计学方法 使用SPSS 19.0 统计软件进行数据处理,计量资料以±s表示,多组均数间比较采用单因素方差分析,组间多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PKD1对心肌梗死大鼠心肌组织病理变化的影响 HE染色结果显示,假手术组大鼠心肌组织细胞形态清晰,核占据细胞中央,心肌纤维中可见粉红色闰盘横贯和不同数量的毛细血管散布。模型组大鼠心肌组织呈现坏死组织典型特征:心肌纤维断裂,细胞核模糊或消散,闰盘和横纹消失,伴炎症细胞浸润和瘢痕组织增生。PKD1 组大鼠心肌坏死区域明显减少,闰盘和横纹可见,细胞核清晰,但略显肥大,心肌纤维内毛细血管和红细胞数量增多。CID755673组大鼠心肌组织梗死范围和模型组相似,细胞核溶解消失明显,可见明显的瘢痕组织和炎症细胞。见图1A。Masson染色结果表明,假手术组大鼠心肌呈现规整的大片红色心肌,间杂少量蓝色的胶原纤维;与假手术组相比,模型组大鼠心肌蓝色胶原纤维占比过半,CVF 值显著升高(P<0.05),少量红色心肌散在分布;与模型组相比,PKD1 组大鼠以红色心肌为主,蓝色胶原纤维占比较低,CVF值显著下降(P<0.05);与PKD1 组相比,CID755673 组大鼠心肌蓝色胶原纤维占比较高,CVF 值显著升高(P<0.05),见图1B、表1。
Tab.1 Effects of PKD1 on collagen volume fraction and apoptosis of myocardial cells in rats with myocardial infarction表1 PKD1对心肌梗死大鼠心肌组织的胶原容积分数和心肌细胞凋亡数量的影响 (n=10,±s)

Tab.1 Effects of PKD1 on collagen volume fraction and apoptosis of myocardial cells in rats with myocardial infarction表1 PKD1对心肌梗死大鼠心肌组织的胶原容积分数和心肌细胞凋亡数量的影响 (n=10,±s)
**P<0.01;a与假手术组比较,b与模型组比较,c与PKD1 组比较,P<0.01
组别假手术组模型组PKD1组CID755673组F CVF(%)12.26±2.86 65.54±12.98a 13.52±2.82b 63.37±13.12ac 99.496**TUNEL阳性细胞(个/视野)4.05±2.45 35.82±12.52a 4.36±2.48b 34.48±13.36ac 36.789**
2.2 PKD1对心肌梗死大鼠心肌细胞凋亡变化的影响 TUNEL 染色结果显示,假手术组大鼠镜下视野表现以蓝色荧光为主的正常心肌细胞,偶见发出红色荧光的凋亡细胞;与假手术组相比,模型组大鼠视野中呈现红色荧光的凋亡细胞数量显著增多(P<0.05);与模型组相比,PKD1组大鼠呈现以蓝色荧光为主的心肌细胞居多,凋亡细胞数量显著减少(P<0.05);与PKD1 组相比,CID755673 组大鼠呈红色荧光的凋亡细胞数量显著增多(P<0.05),见表1、图2。
2.3 PKD1 对心肌梗死大鼠心肌组织中HDAC5、MEF2和cTn I蛋白表达的影响 免疫组化染色结果显示,假手术组大鼠心肌组织内HDAC5 和MEF2 阳性细胞的数量均较少,而cTn I 阳性细胞的数量较多;与假手术组相比,模型组大鼠残存心肌组织内MEF2 阳性细胞的数量显著增多(P<0.05),而cTn I阳性细胞的数量显著减少(P<0.05);与模型组相比,PKD1组大鼠心肌组织内MEF2阳性细胞的数量显著减少(P<0.05),而HDAC5 和cTn I 阳性细胞的数量均显著升高(P<0.05);与PKD1 组相比,CID755673 组大鼠MEF2 阳性细胞的数量显著升高(P<0.05),而HDAC5 和cTn I 阳性细胞的数量均显著减少(P<0.05)。蛋白免疫印迹结果显示,HDAC5、MEF2 和cTn I 蛋白表达的变化趋势和免疫组化结果相一致。见表2,图3、4。
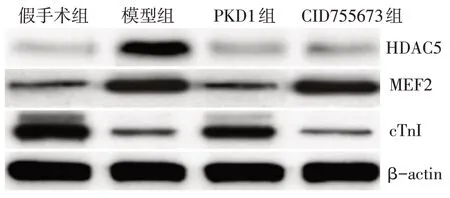
Fig.3 Effects of PKD1 on expressions of HDAC5,MEF2 and cTn I in myocardium of rats with myocardial infarction图3 PKD1对心梗大鼠心肌组织中HDAC5、MEF2和cTn I表达的影响(免疫印迹)
3 讨论
研究表明,心肌梗死后心肌细胞出现大量坏死和凋亡,肉芽组织机化取代坏死的心肌组织,心梗后3~4 周,肉芽组织转变成瘢痕组织[9],这与本研究模型组大鼠心肌组织病理变化相一致。心肌组织发生坏死、凋亡及瘢痕组织出现等病理变化严重影响着心肌细胞的能量代谢,破坏心肌组织的微血管,进而导致残存的心肌细胞负荷加重,心肌细胞肥厚,肥厚的心肌细胞缺氧变性坏死、纤维化,进而引发心室重构,严重者进展为心力衰竭。基于此,减少心肌细胞凋亡,逆转肥厚心肌以及减轻心肌纤维化进而逆转重构的心室是治疗心肌梗死的重要策略之一[10-11]。
Tab.2 Effects of PKD1 on expressions of HDAC5,MEF2 and cTn I in myocardium of rats with myocardial infarction表2 PKD1对心肌梗死大鼠心肌组织中HDAC5、MEF2和cTn I表达的影响(n=10,±s)
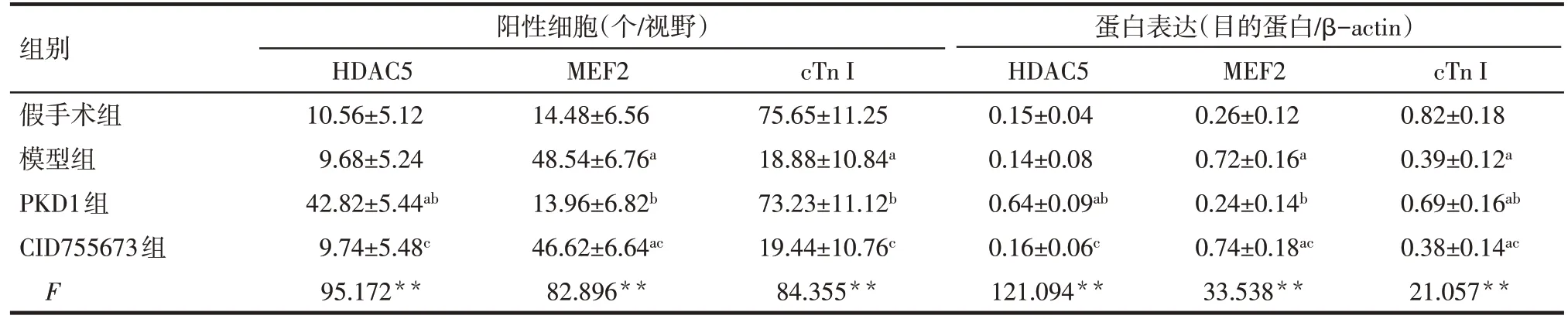
Tab.2 Effects of PKD1 on expressions of HDAC5,MEF2 and cTn I in myocardium of rats with myocardial infarction表2 PKD1对心肌梗死大鼠心肌组织中HDAC5、MEF2和cTn I表达的影响(n=10,±s)
**P<0.01;a与假手术组比较,b与模型组比较,c与PKD1组比较,P<0.01
组别假手术组模型组PKD1组CID755673组F阳性细胞(个/视野)HDAC5 10.56±5.12 9.68±5.24 42.82±5.44ab 9.74±5.48c 95.172**MEF2 14.48±6.56 48.54±6.76a 13.96±6.82b 46.62±6.64ac 82.896**cTn I 75.65±11.25 18.88±10.84a 73.23±11.12b 19.44±10.76c 84.355**蛋白表达(目的蛋白/β-actin)HDAC5 0.15±0.04 0.14±0.08 0.64±0.09ab 0.16±0.06c 121.094**MEF2 0.26±0.12 0.72±0.16a 0.24±0.14b 0.74±0.18ac 33.538**cTn I 0.82±0.18 0.39±0.12a 0.69±0.16ab 0.38±0.14ac 21.057**
笔者前期研究显示,PKD1具有上调血管内皮生长因子的表达和促进缺血心肌组织血管新生的作用[7-8,12]。本实验的HE 染色结果证实,PKD1 组大鼠心肌组织内微血管和红细胞数量均显著增多,这与前期的研究结果相一致。Masson 染色结果证实,PKD1 组大鼠红色心肌所占比例显著升高;TUNEL染色结果证实,PKD1治疗后心肌组织内凋亡的心肌细胞数量显著减少。这表明,PKD1可能通过促进心肌梗死后心肌组织内新生血管的生成,增加心肌的微循环血供,从而使心肌细胞的凋亡数量下降,并减轻心肌的坏死和纤维化程度,修复缺血受损的心肌。PKD1的特异性阻断剂CID755673可阻断PKD1的上述有益作用,进一步表明PKD1 可能是促心肌梗死后缺血受损心肌修复的关键调控蛋白。
心肌细胞内的HDAC5 在正常情况下位于细胞核内,主要处于脱磷酸化失活状态[2],本实验的免疫组化染色结果也证实了假手术组大鼠HDAC5 位于心肌细胞核内,但几乎不表达。PKD1必须和其靶标蛋白HDAC5结合才能参与正常的生理活动,因此形成了一种特异的PKD1/HDAC5 轴[2-3]。PKD1/HDAC5 轴在心肌梗死后心肌组织修复中的作用之前少有报道。本研究中,模型组大鼠HDAC5的表达与假手术组差异无统计学意义,但在PKD1 的诱导干预下,HDAC5 的表达显著上调,而CID755673 能够阻断PKD1诱导的HDAC5上调。这表明,HDAC5是在PKD1的调控作用下发挥生物学作用的。
HDAC5 激活后结合MEF2 并抑制MEF2 的表达进而抑制心肌细胞发生病理性肥大,参与逆转病理性心肌肥厚的进程[13]。MEF2 能够调控影响心肌细胞核转位、细胞骨架重塑和线粒体网状结构完整性的特异性相关基因表达,MEF2的表达上调会引发心肌的收缩和舒张功能障碍,心室腔扩张,心室重构,最终发生心力衰竭[14]。MEF2 还参与心肌的纤维化重塑进程,压力负荷引发心室重构的动物模型实验表明,敲除MEF2 基因的小鼠较未敲除的小鼠纤维化程度明显减轻[15]。MEF2 还具有调控脂肪酸的氧化而影响线粒体的功能,进而影响心肌的能量代谢[16]。这表明,MEF2在心肌梗死、心功能衰竭等疾病进程中均发挥着重要的作用。本实验中假手术组大鼠没有受到病理性或者药物干预性刺激时,MEF2表达很低;模型组大鼠残存的心肌细胞明显肥大,心肌纤维化程度明显,且伴随着MEF2 表达的显著升高,这与Tóth 等[13]报道的研究结果相一致。PKD1干预后MEF2表达显著下调,而CID755673能够阻断这一作用。这表明,PKD1 可能通过结合HDAC5 而抑制MEF2的表达进而逆转心肌梗死后心室重构等不良反应,促进心肌梗死后受损心肌的修复。
cTn I是判定心肌损伤的金指标之一[6]。本研究显示,假手术组大鼠心肌组织结构正常,cTn I 的表达也最高;模型组大鼠心肌组织损伤明显,因而cTn I 表达显著降低。PKD1 干预后cTn I 表达再次显著升高,而CID755673可以阻断cTn I 表达的升高。这表明,PKD1 与HDAC5 结合激活后可以促进损伤心肌的修复。这为基于“PKD1”靶点的蛋白调控网络的构建和基于“PKD1”靶点开发治疗心肌梗死的新药提供了部分实验数据支持。下一步的研究中,需要设计siPKD1,并以CID755673做对照,从细胞实验水平进一步探讨PKD1/HDAC5轴的生物学作用。
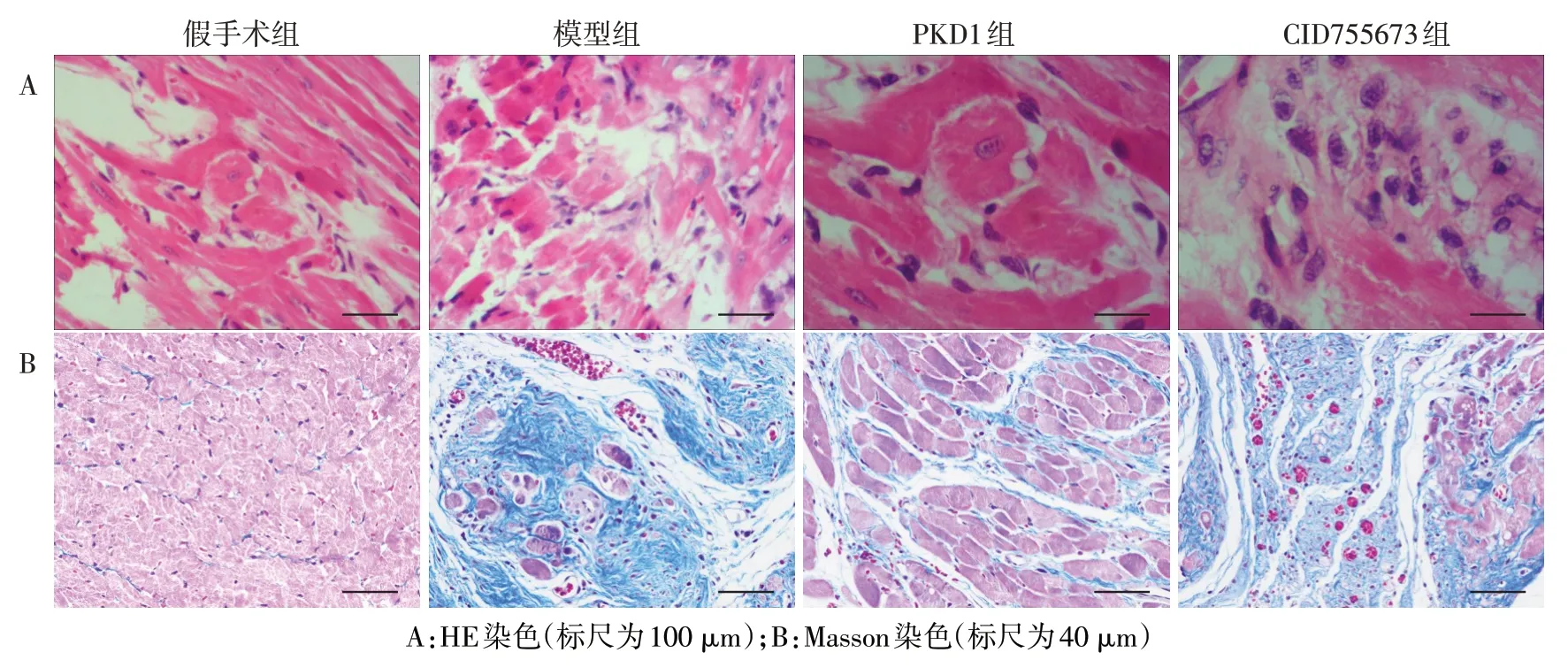
Fig.1 Effects of PKD1 on histopathological changes in rats with myocardial infarction图1 PKD1对心肌梗死大鼠组织病理变化的影响
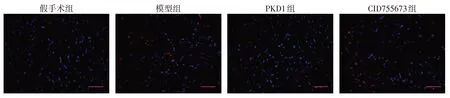
Fig.2 Effects of PKD1 on apoptosis of myocardial cells in rats with myocardial infarction图2 PKD1对心肌梗死大鼠心肌细胞凋亡变化的影响(标尺为40 μm)
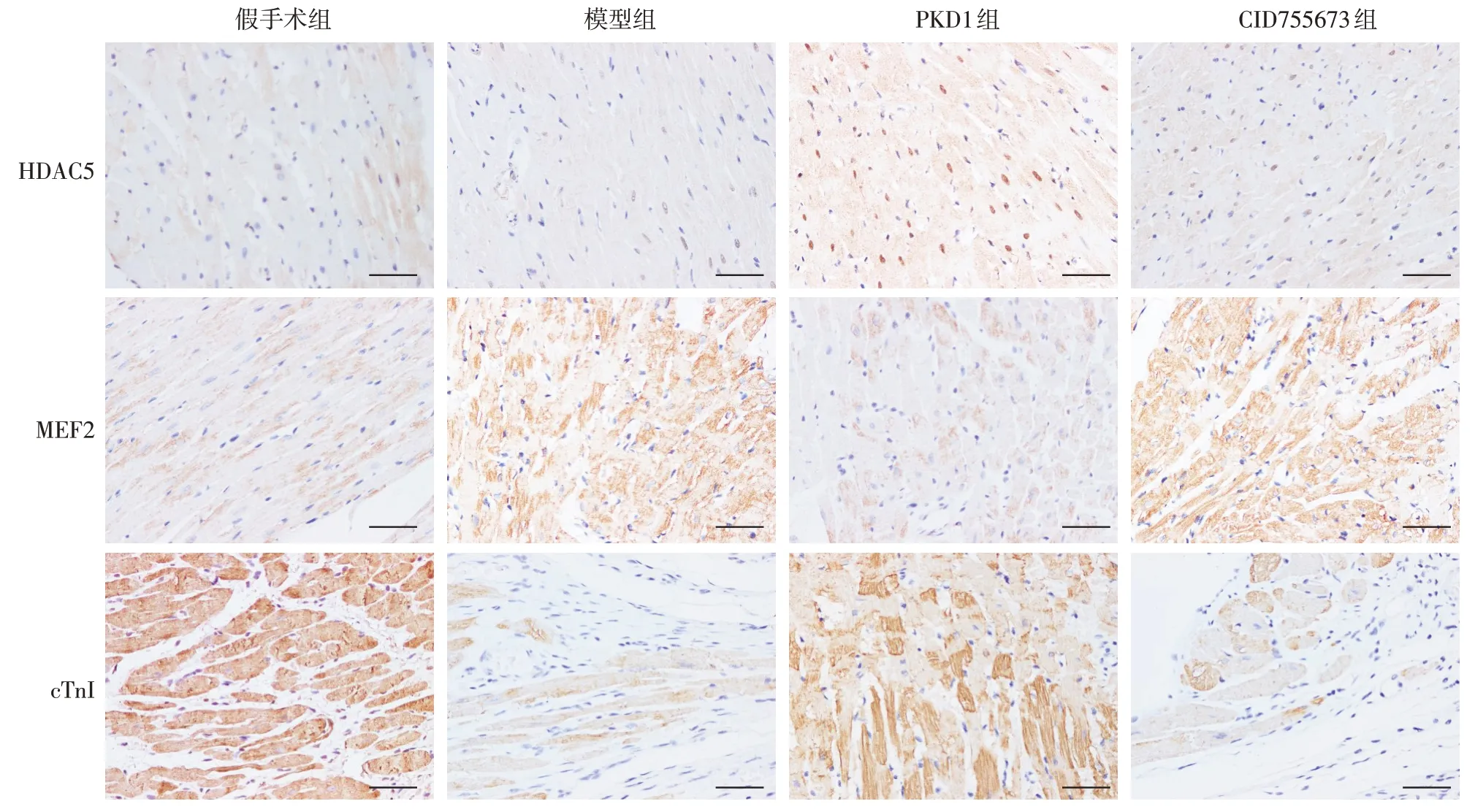
Fig.4 Effects of PKD1 on expressions of HDAC5,MEF2 and cTn I of myocardium in rats with myocardial infarction(Scale bar=40 μm)图4 PKD1对心肌梗死大鼠心肌组织中HDAC5、MEF2和cTn I表达的影响(免疫组化,标尺为40 μm)
