microRNA-125b在脓毒症急性肺损伤中的表达及其与炎症因子水平相关性
2019-08-24吴松林田小利徐陶雷贤英伍长学甘辞海
吴松林,田小利,徐陶,雷贤英,伍长学,甘辞海
脓毒症是指因感染引起宿主反应失调而导致危及生命的器官功能障碍[1]。当前临床普遍认为,脓毒症是一种由感染引起的全身炎症反应综合征[2];感染可能引起免疫抑制及机体过度炎症反应,从而导致脓毒症发生[3-4]。急性肺损伤是一种以弥漫性肺实质损伤为基础,肺水肿和肺不张为病理特征,并迅速影响气体交换功能的临床综合征[5-6]。而急性肺损伤作为机体过度炎症反应的结果,调控炎症反应的发生与发展可以防止急性肺损伤的发生[7],对降低病死率具有重要的临床意义[8]。因此,急性肺损伤生物学标志物的探索,对脓毒症早期的诊断、疗效判断以及预后评估都有重要意义[9]。微小RNA(MicroRNAs,miRNAs)是一类内源性小分子非编码RNA,在转录后调控基因的表达[10-11]。研究表明,多种miRNAs 在脓毒症的炎症反应中起着重要的作用[12-13],miR-125b 已被发现在肺癌、乳腺癌、鼻咽癌、胰腺癌、子宫内膜癌等癌症中表达异常,但是关于miR-125b在脓毒症诱发的急性肺损伤中的研究尚少见相关报道[14-16]。本研究通过体外构建脓毒症急性肺损伤大鼠模型,探索miR-125b的表达水平与炎症因子的相互关系,以及其在急性肺损伤中对炎症的调控机制。
1 材料与方法
1.1 主要试剂与仪器 DMEM培养液(NO.C10782730BT,美国Gbico 公司),胎牛血清(NO.10099,美国Gbico 公司),0.25%胰酶(Lot:20170321,美国Invitrogen 公司),CO2细胞培养箱(Heraeus,德国),倒置显微系统(TH4-200,日本OLYMPUS),TaqMan®RNA Reverse Transcription kit 试剂盒(Lot:20170634,美国ABI 公司),Lipofectamine 3000 Reagent(No.M0124,美国赛默飞生物公司),PCR 仪(iCycler Thermal Cycler,美国BIO-RAD 公司),凝胶图像分析系统(Biosens SC710,美国BIOTOP 公司),荧光定量PCR 仪(Light Cycler480,美国罗氏生物),低速离心机(TDL5,上海安亭科学仪器厂),脂多糖(LPS,美国Sigma 公司),固型标准普通饲料(北京科澳饲料公司)。
1.2 实验动物与分组 清洁级SD大鼠100 只,雄性,5周龄,体质量195~230 g,购自上海南方模式动物中心,于我院动物科学研究室进行喂养,4 只/每笼,以固型标准普通饲料饲养于24 ℃室温,12 h 光照,湿度44%~50%环境下。将100只SD 大鼠随机均分为5组:对照组注射等量的生理盐水;脂多糖(lipopolysaccharides,LPS)4 h、8 h、12 h 及24 h 组,腹腔注射10 mg/kg的LPS相应时长后处死大鼠。
1.3 肺组织形态学观察 各组大鼠处死后取肺组织,10%福尔马林固定,脱水后石蜡包埋。4 μm组织切片后经苏木精-伊红(hematoxylin-eosin staining,HE)染色,光镜(×100)下观察肺组织切片病理学变化。
1.4 肺组织miR-125b、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)与白细胞介素-6(interleukin-6,IL-6)检测 提取肺组织总RNA,逆转录后得到cDNA,反应条件:16 ℃30 min,42 ℃30 min,85 ℃5 min,4 ℃保存。采用TaqMan®Universal PCR Master Mix 进行荧光定量PCR。反应条件:95 ℃预变性10 min;95 ℃变性15 s,55~60 ℃退火及延伸30 s,共40 个循环。以U6 为miR-125b内参,以β-actin为TNF-α 和IL-6 的内参,采用2-ΔΔCt法计算相对表达量。引物信息见表1。
1.5 NR8383 细胞的培养与分组 (1)细胞培养。大鼠肺泡巨噬细胞NR8383 细胞株由中科院上海细胞库提供,由液氮罐中迅速取出冻存的细胞,37 ℃水浴解冻并接种,添加DMEM 培养液5 mL,于37 ℃、5%CO2培养箱培养,每2 d换液1 次。贴壁细胞进行传代前达到80%左右融合度,采用0.25%的胰酶消化后收集细胞悬液;4 ℃3 000 r/min 离心2 min,弃去上清,加入1×PBS重悬细胞1 mL,按1×105/mL密度接种。(2)LPS 诱导NR8383 细胞系。将NR8383 细胞系根据不同的处理方式分为2组,空白对照组不进行LPS刺激,实验组加入LPS 刺激4 、8 、12、24 h 时收集细胞。(3)细胞转染。取培养3~5 代细胞,严格按照Lipofectamine®3000 Transfection Reagent 说明书进行操作;阴性对照组只转染空表达质粒;miR-125b mimic 组转染miR-125b mimic 表达质粒,以提高细胞内源miR-125b 的表达水平;miR-125b inhibitor 组转染miR-125b inhibitor 表达质粒,以抑制细胞内源miR-125b的表达水平。

Tab.1 Primer sequence information表1 各引物序列信息
1.6 Western blot检测Notch1蛋白表达 分别取各转染组等量细胞,经12.5%SDS-PAGE 凝胶电泳(90 V 恒压)分离,恒流转移后,3%BSA室温封闭1 h,按1∶500浓度加入Notch1单克隆抗体(1∶500稀释),4 ℃孵育过夜,漂洗辣根过氧化物酶标记的二抗(1∶1 000 稀释),室温孵育30 min 后PBS 缓冲液洗涤,加入ECL 化学发光剂曝光成像。对成像之后的胶片,采用密度扫描仪对各个条带的吸光度值进行定量,以β-actin作为内参照,使用其灰度值差值来表示Notch1 的相对表达量。
1.7 统计学方法 采用SPSS 21.0统计软件。符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较采用2独立样本t检验;多组间比较采用单因素的方差分析,组间多重比较用采用LSD-t检验;实验组相关性分析采用Pearson相关系数。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理变化 LPS 腹腔注射4 h后对照组肺组织结构清晰可见,肺泡壁完整清晰、间质无渗出、无炎症细胞浸润、肺泡腔内无水肿液、出血,见图1A;LPS 腹腔注射8、12、24 h 后各组大鼠肺泡隔毛细血管及肺微血管扩张充血,双肺体积增大,明显肺水肿,肺泡壁破损,肺泡隔及肺泡腔内大量液体及红细胞渗出,可见炎症细胞浸润,偶有透明膜形成,肺泡大小不一,肺泡间隔明显增厚,见图1B~E。
2.2 各组肺组织中miR-125b、TNF-α 以及IL-6 的表达水平比较 与对照组比较,LPS 各组TNF-α、IL-6的相对表达量均升高,miR-125b相对表达量均降低(P<0.05);与LPS 4 h 组相比,LPS 8 h 组、LPS 12 h 组及LPS 24 h 组TNF-α、IL-6 的相对表达量均降低,miR-125b相对表达量差异无统计学意义(P>0.05),见表2。
Tab.2 Comparison of expression levels of miR-125b,TNF-α and IL-6 in lung tissues of rats between five groups表2 各组大鼠肺组织中miR-125b、TNF-α以及IL-6 mRNA的表达水平比较(n=20,±s)
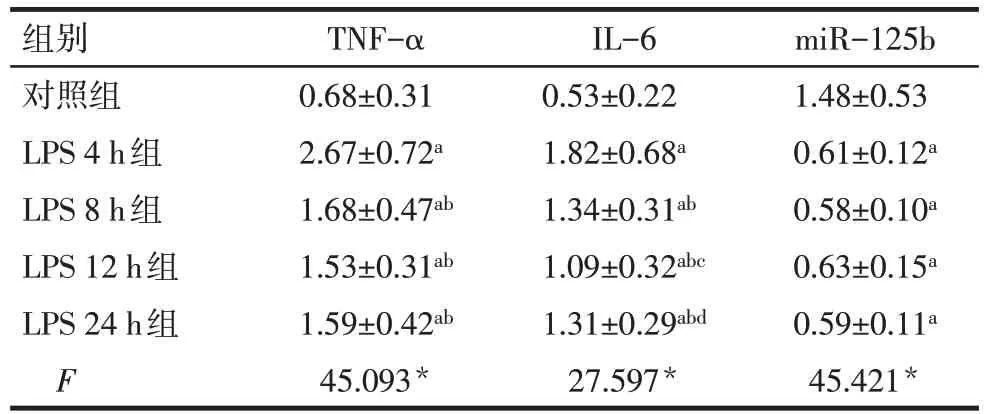
Tab.2 Comparison of expression levels of miR-125b,TNF-α and IL-6 in lung tissues of rats between five groups表2 各组大鼠肺组织中miR-125b、TNF-α以及IL-6 mRNA的表达水平比较(n=20,±s)
*P<0.05;a 与对照组比较,b 与LPS 4 h 组比较,c 与LPS 8 h 组比较,d与LPS 12 h组比较,P<0.05
组别对照组LPS 4 h组LPS 8 h组LPS 12 h组LPS 24 h组F TNF-α 0.68±0.31 2.67±0.72a 1.68±0.47ab 1.53±0.31ab 1.59±0.42ab 45.093*IL-6 0.53±0.22 1.82±0.68a 1.34±0.31ab 1.09±0.32abc 1.31±0.29abd 27.597*miR-125b 1.48±0.53 0.61±0.12a 0.58±0.10a 0.63±0.15a 0.59±0.11a 45.421*
2.3 肺组织中miR-125b表达与TNF-α、IL-6 的表达相关性分析 实验组肺组织中miR-125b与TNF-α、IL-6 呈负相关(r分别为-0.599、-0.580,P<0.05)。
2.4 NR8383 细胞系中miR-125b、TNF-α 以及IL-6的表达检测 在LPS诱导的第4、8、12、24 h,实验组NR8383 细胞系miR-125b表达水平均低于对照组,而TNF-α、IL-6 的表达水平均高于对照组(P<0.05),见表3。
2.5 Notch1在NR8383细胞系中的表达检测 与阴性对照组比较,miR-125bmimic组miR-125b相对表达量升高、Notch1 蛋白相对表达量则降低(P<0.05),miR-125binhibitor组miR-125b相对表达量降低、Notch1 蛋白相对表达量升高(P<0.05);与miR-125bmimic 组比较,miR-125binhibitor 组miR-125b相对表达量降低、Notch1 蛋白相对表达量升高(P<0.05),见表4、图3。
Tab.3 Comparison of expression levels of miR-125b,TNF-α and IL-6 in NR8383 cells between different time points表3 不同时间点各组NR8383细胞中miR-125b、TNF-α以及IL-6的表达比较(n=20,±s)
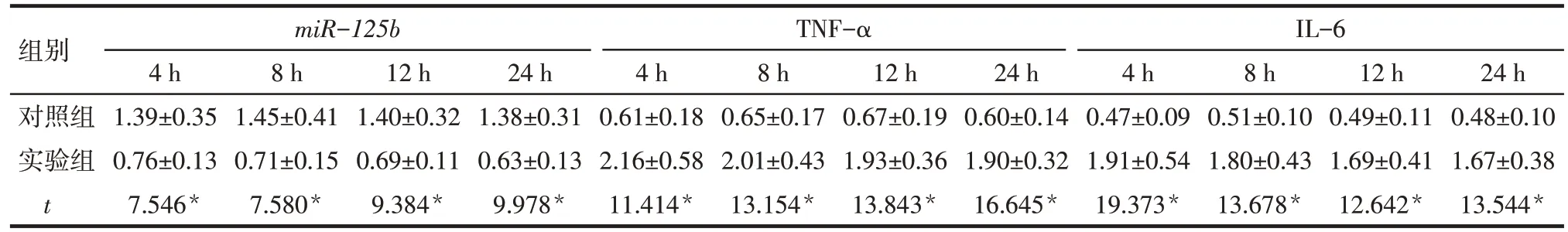
Tab.3 Comparison of expression levels of miR-125b,TNF-α and IL-6 in NR8383 cells between different time points表3 不同时间点各组NR8383细胞中miR-125b、TNF-α以及IL-6的表达比较(n=20,±s)
*P<0.05
组别对照组实验组t miR-125b TNF-αIL-6 4 h 1.39±0.35 0.76±0.13 7.546*8 h 1.45±0.41 0.71±0.15 7.580*12 h 1.40±0.32 0.69±0.11 9.384*24 h 1.38±0.31 0.63±0.13 9.978*4 h 0.61±0.18 2.16±0.58 11.414*8 h 0.65±0.17 2.01±0.43 13.154*12 h 0.67±0.19 1.93±0.36 13.843*24 h 0.60±0.14 1.90±0.32 16.645*4 h 0.47±0.09 1.91±0.54 19.373*8 h 0.51±0.10 1.80±0.43 13.678*12 h 0.49±0.11 1.69±0.41 12.642*24 h 0.48±0.10 1.67±0.38 13.544*
Tab.4 Comparison of expression levels of miR-125b and Notch1 between three groups of cells表4 各组细胞中miR-125b与Notch1的表达比较(n=6,±s)

Tab.4 Comparison of expression levels of miR-125b and Notch1 between three groups of cells表4 各组细胞中miR-125b与Notch1的表达比较(n=6,±s)
*P<0.05,**P<0.01;a与阴性对照组比较,b与miR-125b mimic组比较,P<0.05
组别阴性对照组miR-125b mimic组miR-125b inhibitor组F miR-125b相对表达量1.42±0.23 2.14±0.56a 0.76±0.12ab 22.514*Notch1相对表达量1.12±0.18 0.43±0.07a 1.83±0.42ab 41.286*
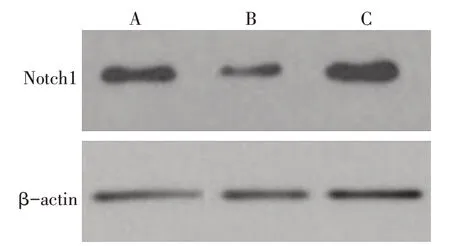
Fig.3 Western blot analysis of Notch1 protein expression in three groups of cells图3 Western blot检测各组细胞中Notch1蛋白表达
3 讨论
感染与创伤是急性肺损伤发病的最常见原因,可直接或间接引起不同程度的肺损伤[17]。促炎反应被启动的同时,抗炎反应也被启动,两者之间的平衡与倾斜决定着整个炎症过程的归宿,因此如何控制急性肺损伤过程中免疫炎症反应,对于急性肺损伤的治疗至关重要[18]。
miRNAs作为一种新的基因表达调节物,它与目的mRNA结合后,可抑制目的mRNA翻译或降解,参与多种生物过程的信号通路调控[19]。孟建斌等[20]研究发现,脓毒症引发急性肺损伤患者外周血中miR-146a 的表达显著升高。Shi 等[21]研究发现,小鼠肺组织在进行LPS 刺激后,有46 种miRNAs 的表达明显上调,多种炎症相关因子表达下调,表明miRNAs参与肺部的急性炎症反应。miR-125b主要参与细胞的增殖分化、凋亡等生理过程,在肿瘤的形成与发展过程中发挥重要功能[22]。Priyanka 等[23]研究发现,miR-125b通过靶向调控Line28A,参与造血干细胞和神经干细胞中的分化过程。Hu 等[24]发现miR-125b能抑制巨噬细胞内源干扰素调节因子的表达,从而参与机体的免疫炎症反应;但是关于miR-125b在脓毒症急性肺损伤中的研究鲜有报道。
本研究通过建立脓毒症急性肺损伤大鼠模型发现,相比于对照组大鼠,miR-125b的相对表达水平在LPS腹腔注射的第4、8、12、24 h后均明显降低,提示miR-125b在急性肺损伤大鼠肺组织中的表达显著降低;而TNF-α 与IL-6 的表达则显著升高;实验组miR-125b的表达水平与TNF-α、IL-6表达水平呈显著负相关,表明随着miR-125b表达的降低,细胞内源TNF-α 与IL-6 的表达显著升高。在巨噬细胞NR8383细胞株中加入LPS诱导后的不同时间段,细胞内源miR-125b的表达水平较对照组均下调,TNF-α、IL-6的表达水平上升;这与Hu等[24]研究相似,提示脓毒血症导致的急性肺损伤中,miR-125b低表达可上调炎症相关调节因子,参与肺部炎症反应。细胞转染实验显示,降低NR8383细胞内源miR-125b的表达时,Notch1 表达水平升高,而当提高NR8383 细胞内源miR-125b的表达时,细胞内源Notch1蛋白表达水平下降,表明miR-125b可能通过靶向调控Notch1蛋白的表达,抑制TNF-α与IL-6的表达。
综上所述,在脓毒症急性肺损伤大鼠肺组织中,miR-125b的表达水平显著降低,而相关炎症因子,如TNF-α与IL-6的表达则显著升高,提示三者均参与了体内的炎症反应;在脓毒症急性肺损伤大鼠肺组织中,miR-125b可能通过调控细胞内源靶基因Notch1 蛋白的表达,从而抑制TNF-α 与IL-6 的表达,负向调控机体的免疫炎症反应,有利于抑制脓毒症急性肺损伤的进一步发生,这为临床治疗脓毒症急性肺损伤提供了一定的实验依据。
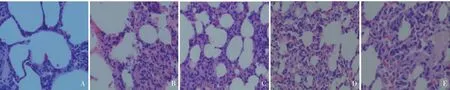
Fig.1 HE staining results of lung tissues in five groups of rats(×400)图1 各组大鼠模型肺组织HE染色结果(×400)
