大豆凝集素纯化及凝集活性测定的研究
2019-08-21张柏林刘宁王双双
张柏林 刘宁 王双双


摘要:通过建立快速大豆凝集素(SBA)粗提液制备方法,利用N-乙酰-D-半乳糖胺-epoxy-Sepharose 6B亲和层析制备体系制备大豆凝集素样品,采用聚丙烯酰胺(SDS-PAGE)及红细胞凝集试验分别对本试验制备的大豆凝集素进行纯度及凝集活性的检测。结果表明,试验制备的大豆凝集素的产率为135 mg/100 g;所制得的大豆凝集素样品的纯度较高,与大豆凝集素标准品基本一致;其凝集活性为256。研究成果可为大豆凝集素的量化生产提供技术参考。
关键词:大豆凝集素;分离纯化;亲和层析;凝集活性
中图分类号:S816.4 文献标志码: A 文章编号:1002-1302(2019)12-0221-03
大豆凝集素粗提液的制备一般采用硫酸铵逐级沉淀法[5-6],但硫酸铵逐级沉淀步骤繁琐,且硫酸铵会引起小部分蛋白的变性。因此,探索一种高效安全的大豆凝集素粗提液制备方法成为大豆凝集素量化提纯的重要前提。Liner利用离子交换和磷酸钙层析制备大豆凝集素[7]。Liener等在不同pH值条件下采用硫酸铵分步沉淀法进行大豆凝集素的分离纯化试验[8]。Wade等也建立离子交换纤维素及羟基磷灰石层析法,并成功得到纯化的大豆凝集素[9-10]。但上述大豆凝集素纯化方法具有纯化效率低的缺点,探索一种高效制备纯化大豆凝集素方法成为研究者关注的热点。因此,笔者根据大豆凝集素能专一性和可逆性地与相应的配基或配体发生特异性结合,对大豆凝集素的纯化方法进行进一步的完善。目前主要采用亲和层析法进行大豆凝集素的制备,根据所采用凝胶载体和糖配体的不同,主要分为半乳糖胺-CH-Sepherose 4B亲和层析体系[5]、N-乙酰基-D-半乳糖胺-epoxy-Sepharose 6B亲和层析体系[11-12]和瓜尔胶亲和层析体系。研究者发现,无论从大豆凝集素的纯化效率还是所制备的大豆凝集素的纯度上看,N-乙酰基-D-半乳糖胺-Sepharose 6B亲和层析体系都优于半乳糖胺-CH-Sepherose 4B和瓜尔胶亲和层析体系[13]。本研究首先针对大豆凝集素粗提液的制备进行了改良,并选用纯化效率较优的N-乙酰基-D-半乳糖胺-Sepharose 6B大豆凝集素亲和层析体系,以贵州省本地大豆品种为材料进行大豆凝集素的纯化。
1 材料与方法
1.1 主要试剂和仪器
1.1.1 主要材料与试剂 大豆购自贵州省农业科学院油料(香料)研究所;正己烷(沸点68.74 ℃),购自国药集团化学试剂有限公司、氯化钠(分析纯),购自国药集团化学试剂有限公司、N-乙酰基-D-半乳糖胺-Sepharose 6B亲和层析凝胶,购自Sigma公司、聚乙二醇20 000、丙烯酰胺、N,N′-甲叉双丙烯酰胺、β-巯基乙醇、溴酚蓝、过硫酸铵、四甲基乙二胺(TEMED),均购自北京鼎国昌盛生物技术有限责任公司;甲醇、冰乙酸、标准蛋白质Marker,均购自北京索莱宝科技有限公司。
1.1.2 主要仪器 低温高速离心机(Thermo Fisher Scientific公司,ST16R)、FW100高速万能粉碎机(天津泰斯特仪器有限公司)、85-2型数显磁力搅拌器(江苏金坛市大地自动化仪器厂)、分样筛(60目,浙江省绍兴市上虞华丰五金仪器有限公司)、透析袋(YA1072,北京索莱宝科技有限公司)、层析柱(1.5 cm×15 cm,上海精科实业有限公司)、UV2102紫外可见光分光光度计(上海龙尼柯仪器有限公司)、PHS-3C型酸度计(上海仪电科学仪器有限公司)、红细胞凝集反应板(Costar3590,美国)、DYY-2C型电泳仪(北京六一仪器厂)、“迷你型”凝胶电泳装置(Boi-Rad中国公司);微量移液器(200~1 000 mL、50~500 μL、5~50 μL,Thermo Fisher Scientific)微量加样器(20 μL,上海安亭微量进样器厂)。
1.2 大豆凝集素的分离纯化
1.2.1 大豆凝集素粗提取液的制备
1.2.1.1 脱脂 称取生大豆500 g,置于粉碎机中粉碎30 s后,过60目筛。按质量体积比1 ∶ 10置于一定体积的正己烷内,利用磁力搅拌器搅拌进行10 h脱脂(每隔3 h换1次正己烷溶液),将脱脂完的豆粉放在通风橱中晾干。
1.2.1.2 提取和离心 称取80 g脱脂大豆粉放入2 L烧杯中,加入0.9% NaCl溶液1 L,使其充分地溶解,然后放入 4 ℃ 下浸提蛋白质,过夜。溶液分为2层,上层为澄清的黃色液体,含有大豆中的可溶性物质。因为大豆凝集素为可溶性蛋白,因而存在于上层溶液中;下层为沉淀层。将上层溶液倾出,下层沉淀在9 000 r/min条件下离心20 min,回收澄清溶液。将所收集到的上清液进行过滤,除去其中的不可溶成分。
1.2.1.3 微滤 将收集到的上清液用滤器进行过滤,含 0.45 μm 的聚砜膜。将过滤后所得产物用于亲和层析柱分析。
1.2.2 大豆凝集素的纯化 将N-乙酰基-D-半乳糖 胺-epoxy-sepharose 6B装入层析柱(1.5 cm×15 cm)[14],胶的结合能力为6~8 mg/mL胶。将柱子放在4 ℃层析柜中,将柱子用0.9%生理盐水进行平衡,以在280 nm下检测到的吸光度等于0作为平衡终点判定的依据。然后将试验制备的大豆凝集素粗提液进行纯化。待大豆凝集素粗提液全部进入胶体(白色)后,用盐溶液冲洗未结合杂蛋白,以在280 nm下检测到的吸光度等于0为冲洗终点。最后换用含 0.15 mol/L D-半乳糖的盐溶液进行洗脱。将收集到的 280 nm 条件下的吸光度大于0.1的洗脱峰管进行合并,记录总体积。将所收集的纯化大豆凝集素溶液置于透析袋中,在4 ℃下于蒸馏水中透析过夜,然后用聚乙二醇20 000进行浓缩,得到纯化的大豆凝集素[15]。利用紫外分光光度计在280 nm和260 nm条件下测定所制备大豆凝集素的吸光度,记录D280 nm和D260 nm值。根据公式:蛋白质浓度(mg/mL)=1.45×D280 nm-0.74×D260 nm计算所收集到的大豆凝集素数量[16]。
1.3 大豆凝集素纯度的鉴定
采用聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定经N-乙酰-D-半乳糖胺-epoxy-sepharose 6B纯化的大豆凝集素的亚基组成及其分子量,并与标准品作比较。SDS-PAGE操作方法参照郭尧君的方法[17]进行,具体如下:首先灌注12%分离胶及5%浓缩胶。然后将所纯化的大豆凝集素与电流样品缓冲液按适当比例混合后,在100 ℃条件下煮沸3~5 min,使蛋白发生变性。在每个样品孔中加入10~15 μL处理过的样品,浓缩胶段采用80 V恒压,分离胶段采用200 V恒压进行电泳。将凝胶剥下,置于盛有考马斯亮蓝染色液的平皿中进行染色过夜,然后将凝胶取出,放入盛有冰乙酸的脱色液中,于恒温水浴振荡器上进行振荡脱色。
1.4 大豆凝集素生物活性的测定
采用兔红细胞凝集法进行大豆凝集素活性鉴定。操作步骤按照Franco-Feaguas等的方法[6]进行,并做了部分修正,具体如下:在96孔“V”型血凝板中每孔加入50 μL 5%红细胞悬液,接着每孔中分别加入50 μL倍比稀释的大豆提取液,混合均匀后置于室温下反应2 h,观察反应结果。判定标准如下:(1)全部凝集(+ + + +):红细胞呈一层薄膜片状,均匀地分布在整个孔中;(2)大部分凝集(+ + +):小部分未凝集的红细胞呈红色小圆点状沉淀于孔底,且数量较少;(3)半凝集(+ +):约有50%的红细胞沉淀于孔底,成红色圆点状;(4)大部分不凝集(+):绝大多数未凝集的红细胞沉淀于孔底成红色圆形状,有可见凝集颗粒;(5)完全不凝集(-):液体与对照组相似,红细胞沉于孔底。本研究以使50%红细胞凝集的最小样品浓度,称为1个凝集单位(HU)。
2 结果与分析
2.1 大豆凝集素纯化曲线及纯化效率
在N-乙酰基-D-半乳糖胺-epoxy-sepharose 6B亲和层析柱中加入大豆凝集素粗提液后进行亲和层析的洗脱曲线,详见图1。第1峰为首先利用0.9%生理盐水洗脱后得到的非特异性吸附的洗脱峰(即杂蛋白洗脱峰),第2峰为利用0.15 mol/L D-半乳糖的盐溶液进行洗脱的特异性吸附的洗脱峰(即大豆凝集素洗脱峰)。
大豆凝集素的纯化效率如表1所示。本试验条件下所制得的大豆凝集素的純化效率为135 mg/100 g大豆粉。
2.2 大豆凝集素纯度鉴定
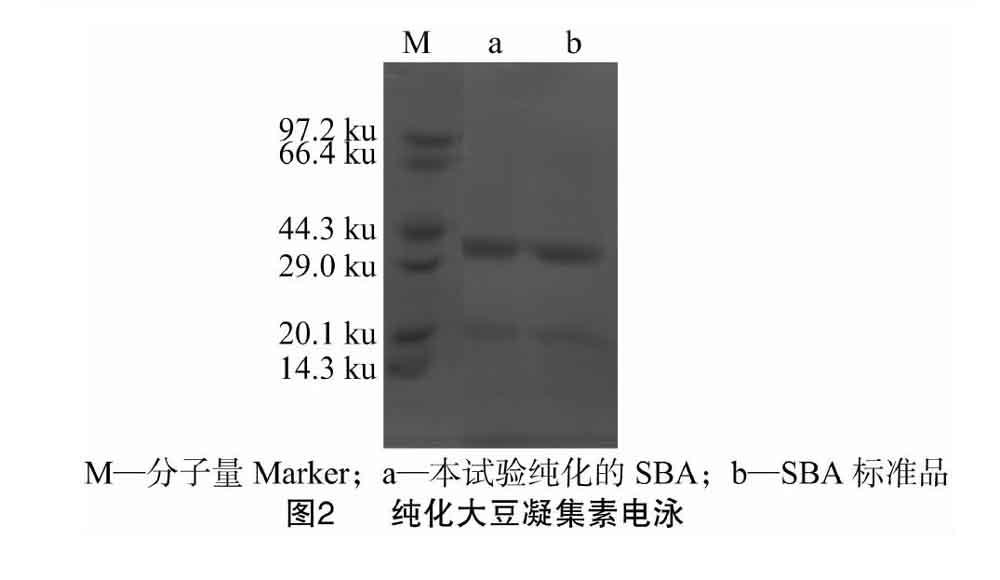
利用聚丙烯酰胺凝胶电泳对提纯的SBA进行纯度鉴定,并与标准SBA相比,结果如图2所示。提纯的大豆凝集素各条带在30 ku左右,与标准SBA基本一致,这与Lotan等的报道[18]一致,这意味着本试验方法制备的SBA纯度较高。
2.3 大豆凝集素凝集活性测定
大豆凝集素能与红细胞发生结合产生凝集。利用这一凝集特性进行大豆凝集素凝集,是检测大豆凝集素的主要方法之一[19]。研究表明,大豆凝集素可特异性地与兔红细胞发生结合[20]。因此本试验采用自制5%新鲜兔红细胞悬液进行大豆凝集素的凝集活性测定。大豆凝集素凝集活性测定结果见表2。本试验所制备的大豆凝集素的凝集活性为256,与标准品相一致。
3 讨论与结论
传统的大豆凝集素的提纯方法只是从获取高纯度的大豆凝集素的角度出发进行改进,但是却忽略了量的因素,并且大豆凝集素的提纯效率较低。因此参照传统的方法难以获取足量的、纯度较高的大豆凝集素,使大豆凝集素的量产受到限制。本试验采用0.9%生理盐水溶液溶解脱脂大豆粉,置于 4 ℃ 条件下进行过夜提取,收集浸泡后的上清液。将脱脂大豆粉放入盐溶液,并放入4 ℃环境中有2个目的:(1)利用蛋白质的溶解特性,使大豆中可溶性的成分溶于盐溶液中,大豆凝集素属于可溶性蛋白,因而溶于盐溶液中。(2)利用某些蛋白具有冷沉的特性而达到去杂质的目的。大豆中的11S球蛋白具有冷沉的特性,放在4 ℃溶液中过夜,约有86%的11S球蛋白沉淀出来。微滤的目的是为了去除粗提液中的颗粒性物质,避免亲和层析时由于堵塞胶孔而降低粗提液的流速,从而造成纯化效率较低。王利民等研究首先采用 0.01 mol/L,pH值7.6 PBS溶液浸提,然后再用硫酸铵逐级沉淀法来制备大豆凝集素粗提液[13]。与王利民等的研究[13]相比,本试验减少了大豆凝集素粗提液的制备时间及费用,有利于提高大豆凝集素的提纯效率。
大豆凝集素是一种大分子蛋白质,分子量约为 120 ku,大豆凝集素是由略有不同的4个亚基组成的四聚体,并有规则的2个二聚体组成,因此大豆凝集素可以看作是“二聚体的二聚体”,每个亚基的分子量约为30 ku[18]。从本试验的结果可以看出,采用本试验改进的大豆凝集素纯化方法所制备的大豆凝集素的纯度较高,与Sigma的大豆凝集素标准品相近,且大豆凝集素亚基分子量与理论值相符,与标准品的SBA蛋白电泳条带位置相同。这与Pusztai等的研究结果[21]相一致。
大豆凝集素的4个亚基均含有1个单独的糖结合位点,因此每个大豆凝集素分子都含有4个N-乙酰基-D-半乳糖胺结合位点。因此,大豆凝集素粗取液加入亲和层析体系后,首先粗提液中的杂蛋白被洗脱下来,而大豆凝集素则与凝胶上的半乳糖胺结合。D280 nm变为零后,改为半乳糖进行洗脱。大豆凝集素与半乳糖结合,从而从凝胶上被洗脱下来。本试验所制备的大豆凝集素的产率为 135 mg/100 g,这与Fasina等的结果[22]相一致。
综上,本试验通过优化大豆凝集素粗提液的制备方法,制得了纯度较高的大豆凝集素。本试验所制备的大豆凝集素纯化效率为135 mg/100 g豆粉,纯度与SBA标准品一致,可为大豆凝集素的量产提供参考。
参考文献:
[1]Friedman M,Brandon D L. Nutritional and health benefits of soy proteins[J]. Journal of Agricultural and Food Chemistry,2001,49(3):1069-1086.
[2]Bajpai S,Sharma A,Gupta M N. Removal and recovery of antinutritional factors from soybean flour[J]. Food Chemistry,2005,89(4):497-501.
[3]Fasina Y O,Classen H L,Garlich J D,et al. Investigating the possibility of monitoring lectin levels in commercial soybean meals intended for poultry feeding using steam-heated soybean meal as a model[J]. Poultry Science,2003,82(4):648-656.
[4]张柏林,秦贵信,刘 宁,等. 大豆凝集素结构及其活性测定方法的研究进展[J]. 大豆科学,2009,28(1):160-163.
[5]王利民. 大豆凝集素在不同种属动物体内的消化动力学及抗营养作用比较研究[D]. 长春:吉林农业大学,2007.
[6]Franco-Fraguas L,Alicia P,Ferreira F,et al. Preparative purification of soybean agglutinin by affinity chromatography and its immobilization for polysaccharide isolation[J]. Journal of Chromatography B,2003,790(1/2):365-372.
[7]Liener E I. Implications of antinutritional components in soybean foods[J]. Critical Reviews in Food Science and Nutrition,1994,34(1):31-67.
[8]Liener E I,Pallansch M J,et al. Purification of a toxic substance from defatted soy bean flour[J]. Journal of Biological Chemistry,1952,197(1):29-36.
[9]Wada S,Pallansch M J,Liener I E,et al. Chemical composition and end groups of the soybean hemagglutinin[J]. Journal of Biological Chemistry,1958,233(2):395-400.
[10]张洪渊,刘克武,杨守忠,等. 大豆凝集素、脲酶和胰蛋白酶抑制剂的分离纯化[J]. 中国油料作物学报,1991(1):41-45.
[11]Vretblad P. Purification of lectins by biospecific affinity chromatography[J]. BBA-Protein structure,1976,434(1):169-176.
[12]Li Z T,Li D,Qiao S Y,et al. Anti-nutritional effects of a moderate dose of soybean agglutinin in the rat[J]. Archiv Fur Tierernahrung,2003,57(4):267-277.
[13]王利民,秦貴信,刘林娜,等. 三种亲和层析体系纯化大豆凝集素的比较研究[J]. 大豆科学,2007,26(1):51-54.
[14]李振田. 大豆凝集素的检测、纯化和对大鼠抗营养机理的研究[D]. 北京:中国农业大学,2003.
[15]胡海霞. 大豆凝集素与不同种属动物肠壁结合规律的比较研究[D]. 长春:吉林农业大学,2008.
[16]何昭阳. 动物免疫学实验技术[M]. 长春:吉林科学技术出版社,2002.
[17]郭尧君. 蛋白质电泳实验技术[M]. 北京:科学出版社,1999.
[18]Lotan R,Siegelman H W,Lis H,et al. Subunit structure of soybean agglutinin[J]. Journal of Biological Chemistry,1974,249(4):1219-1224.
[19]Jaffe G W. In toxic constituents in plant foodstuffs[M]. New York:Academic Press,1980.
[20]刘林娜. 不同种属动物对大豆凝集素敏感性的比较研究[D]. 长春:吉林农业大学,2006.
[21]Pusztai A,Watt W B,Stewart J C,et al. A comprehensive scheme for the isolation of trypsin inhibitors and the agglutinin from soybean seeds[J]. Journal of Agricultural and Food Chemistry,2002,39(5):862-866.
[22]Liener I E. Comment on a semi-pilot-scale procedure for isolating and purifying soybean(Glycine max)lectin[J]. Journal of Agricultural and Food Chemistry,2003,51(16):4532-4538.
