植物耐盐性生理与分子机制研究进展
2019-08-21刘云芬彭华王薇薇
刘云芬 彭华 王薇薇
摘要:随着经济的发展,严重的工业污染以及不良的农业生产活动方式使得土壤盐渍化程度加重,土壤盐渍化以及盐碱地资源如何利用成为一个世界性问题。我国拥有大面积无法正常利用的沿海滩涂盐碱地。研究植物耐盐机制对提高植物耐盐性和作物产量,培育耐盐新品种以及对盐碱地的充分利用有重要的理论意义与实践意义。结合前人研究成果,综述盐胁迫对植物的危害、植物耐盐生理及分子机制、提高植物耐盐性的主要方法。同时笔者还针对现阶段存在的问题进行分析,对今后植物耐盐性方面的研究方向进行展望。
关键词:盐胁迫;植物;耐盐机制;研究进展;生理机制;分子机制
中图分类号: Q945.78;S184 文献标志码: A 文章编号:1002-1302(2019)12-0030-06
收稿日期:2018-02-02
基金项目:江苏省苏北科技专项(编号:SZ-YC2017057)。
作者简介:刘云芬(1989—),女,江西吉安人,博士,助理研究员,研究方向为植物抗逆性研究。E-mail:15105102053@163.com。
通信作者:郭 军,研究员,主要从事蔬菜遗传育种及栽培技术研究。E-mail:guojunyc@163.com。
据调查统计,全世界范围内约10亿hm2的土地受到盐碱化的危害[1],预计到2050年全球耕地面积的50%以上将会被盐渍化[2]。而我国的盐渍土面积达3 600万hm2,占全国可利用土地面积的4.88%,主要分布在我国的北方及沿海地区[3-4]。在江苏沿海地区,滩涂总面积达29.5万hm2,居各省市之首。随着我国经济的持续发展,工业污染加重,农业生产中不合理的灌溉和施肥方式等使得土壤次生盐渍化逐渐加重,这严重制约了我国农业的可持续发展,土壤盐渍化以及盐碱地资源如何有效利用成为一个世界性问题[5-6]。
1 盐分对植物生长发育与生理的影响
研究表明,大部分植物在含盐量达0.3%的土壤中会受到伤害[7]。盐胁迫对植物的伤害主要是抑制生长,随着盐胁迫加剧,植物叶面积停止增加,根茎叶的鲜质量和干质量显著降低[8]。研究表明,盐胁迫下黄瓜幼苗根系生长受到抑制[9],随着盐浓度的增加,番茄幼苗的根干质量逐渐降低[10]。研究表明,低浓度的盐溶液促进种子萌发,但随着盐浓度的增加,发芽率和活力指数均降低,过高的盐浓度抑制种子的萌发。赵满兴等研究发现,草木樨和碱茅种子的发芽率随着盐浓度的升高呈先上升后下降的趋势[11]。有研究表明,盐胁迫既可以直接抑制植物生长,也可以通过抑制光合作用减少生长物质的合成从而间接影响植物生长,且盐浓度越高,作用时间越长,抑制效果越明显[12]。盐胁迫抑制植物的生长推测可能是盐分影响了细胞分裂和延伸,并且缩短了延伸时间[13],同样盐胁迫可以缩短小麦主茎的发育及生殖结构的提早发生,缩短开花时间,加速植物的成熟[14]。
盐胁迫使得细胞质膜最先受到伤害,可能是植物在盐胁迫下产生并积累过量的活性氧自由基,破坏了与活性氧清除系统之间的动态平衡,从而导致膜脂过氧化,积累大量的丙二醛,使得细胞质膜透性增大,使植物遭受伤害[15]。李晓雅等研究发现,高盐浓度加快膜脂过氧化程度,增大细胞膜透性,最终导致膜系统受损[16]。冯利波等研究表明,盐浓度越高,质膜透性越大,胞内的电解質及其他小分子物质大量外渗,导致相对电导率增大[17]。盐胁迫产生的大量活性氧加快了膜脂的过氧化进程,促进了细胞膜的损伤,周艳等用100 mmol/L NaCl溶液处理番茄幼苗,发现超氧化物歧化酶(SOD)活性下降,丙二醛(MDA)含量增加,细胞质膜遭受严重破坏[18]。Hsu等的研究表明,种子发芽率的提高与膜完整性的提高、核酸和蛋白质的合成加快以及抗氧化酶活性的提高密切相关[19]。直接证据表明,细胞质膜的破坏是由于盐胁迫破坏了细胞膜内外钠离子与钙离子的平衡[20-21]。盐胁迫造成大量活性氧积累,导致DNA降解,同时造成膜脂过氧化,破坏膜结构,最终导致细胞死亡[22-23]。
盐胁迫影响光合作用主要是由于叶面积减小,叶绿素含量降低,气孔开度减小,并且在一定程度上导致光系统Ⅱ效率降低[24]。盐胁迫对呼吸作用的影响结论不一。有学者认为,盐胁迫抑制棉花、小麦等的呼吸作用,但也能轻度促进植物的呼吸[25],这种促进或者抑制作用存在浓度效应,低盐浓度促进菜豆的呼吸,高浓度下则抑制[26]。无论促进还是抑制作用,都是盐胁迫影响呼吸过程中酶活性的结果。
盐胁迫下,由于植物体内氨基酸、蛋白质及其他激素类物质等发生不同程度的变化,造成植物的生理代谢发生紊乱,主要涉及的代谢过程包括氮代谢、碳水化合物代谢、蛋白质代谢,其中氮代谢紊乱则被认为是造成植物发生盐害的主要原因[27]。
2 植物耐盐的生理及分子机制
2.1 渗透平衡调节机制
渗透调节是植物耐盐必须拥有的特性之一[28]。植物中存在2种渗透调节方式,一种在细胞中吸收并积累Na+、K+、Cl-等无机离子,另一种是积累一定量的可溶性有机物质参与渗透调节。
在盐胁迫下,植物通过选择性吸收或隔离胞外离子维持一个相对稳定的内环境[29-30]。同时在盐生植物和非盐生植物中均存在离子区域化作用,它能将大部分离子隔离在液泡中,使细胞免遭离子的毒害。而非盐生植物则通过减少有害离子的吸收或将吸收的有害离子运输到较老的组织器官来减轻对幼嫩组织的损伤。
植物吸收的无机离子主要有Na+、K+、Ca2+、Cl-等,细胞内Na+/K+浓度的平衡是保证植物在盐胁迫下进行正常生理代谢的关键[31-32]。研究表明,K+在调节植物体内渗透压和酸碱平衡上起重要作用,因此拟南芥在液泡中积累较多的K+以维持较高的酶活性来抵御盐胁迫[33]。有学者认为Cl-在调节渗透方面作用不大,但有研究发现玉米在盐胁迫初期可以通过快速吸收Cl-来增强耐盐性[34]。Ca2+在细胞中起重要的调节作用,尤其在胁迫条件下,它能作为信号物质参与盐胁迫信号的响应转导[35],调节相关基因的表达,从而提高耐盐性。
除離子区域化外,在长期的进化过程中,植物自身形成了各种防御机制来减轻盐胁迫造成的伤害,包括积累一些渗透调节物质,例如可溶性糖类、脯氨酸、甜菜碱等[36],它们在胁迫中的作用主要为调节渗透势、活性氧的解毒作用以及维持蛋白结构[37]。范惠玲等的研究表明,耐盐生态型芸芥在高盐胁迫下检测到了高浓度的可溶性糖和游离氨基酸[38]。尚娜等研究表明,番茄叶片中的可溶性糖含量随着盐浓度的增加而增加[39]。
2.2 抗氧化防御系统调节机制
在长期的进化过程中,植物自身能够产生活性氧清除系统,包括一些抗氧化酶及抗氧化物质,它们是反映植物抗性的重要指标。有研究表明,NaCl胁迫条件下,马铃薯试管苗的过氧化氢酶(CAT)和SOD活性显著上调,在一定程度上缓解了盐伤害[40]。盐胁迫下外源施加谷胱甘肽(GSH),诱导番茄幼苗叶片SOD、CAT、过氧化物酶(POD)活性上调,MDA含量下降,脯氨酸和可溶性糖含量恢复到对照水平[18]。虽然植物在受到胁迫时能够启动自身的酶系统来抵御不良环境,但也仅限于一定的胁迫范围内,当盐胁迫浓度过大时,酶活性下降,从而对植物造成伤害[41]。
2.3 胁迫信号转导系统
在盐胁迫下,胞内Ca2+浓度急剧上升,其中Ca2+通道蛋白作为重要的盐信号受体[42],有研究表明,Ca2+除了能在盐胁迫下维持植物的生长,诱导Ca2+通道阻碍Na+的吸收外,还作为一种信号分子参与盐胁迫信号转导[43-44]。植物在受到胁迫后,胞质内的Ca2+浓度升高,将胁迫信号传到细胞内,通过调控基因的表达产生相应的生理生化变化以应对盐胁迫[45]。根据Ca2+直接或间接作为第二信使参与信号级联作用,将信号转导通路分为Ⅰ型或Ⅱ型,Ⅰ型主要包括超盐敏感(SOS)途径、钙依赖型蛋白激酶(CDPK)级联反应等;Ⅱ型主要为脱落酸(ABA)信号通路、磷脂信号通路等[46]。
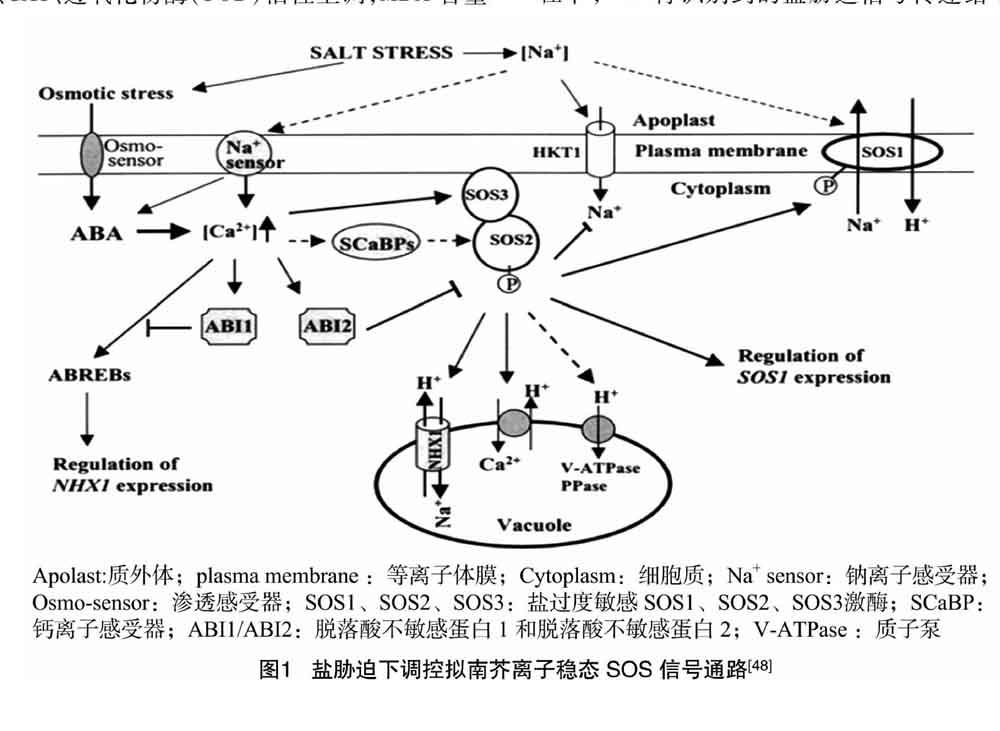
2.3.1 SOS途径 在高盐环境下,植物细胞主要通过SOS途径将Na+排出或区域化至液泡中,以此来减轻盐害。通过对SOS基因的一系列研究鉴定,生理生化、电生理以及分子遗传等证据表明,SOS途径在调控细胞乃至整个植物离子稳态上起重要作用[47]。拟南芥中调控盐胁迫下离子稳态的SOS信号通路如图1所示。由图1可知,细胞质膜上的Na+感受器将感受到的盐胁迫信号传到胞内,引起胞内Ca2+浓度升高,SOS3感知Ca2+信号,进而激活SOS2激酶,活化后的SOS2激酶使得质膜上Na+/H+逆向转运蛋白SOS1磷酸化,将Na+外排。因此SOS1的表达水平以及由Na+转运蛋白高亲和力钾离子转运蛋白(HKT1)转运的Na+水平受到SOS2激酶的调控;SOS激酶同样通过调控离子转运蛋白(NHX1)来调控Na+进出液泡,ABI1通过ABA响应元件结合因子调控NHX1的表达。
2.3.2 ABA信号途径 ABA调控盐胁迫主要有2条路径,一条依赖ABA,另一条则不依赖ABA[49]。在依赖ABA的路径中,ABA将识别到的盐胁迫信号传递给下游转录因子,包
括MYB、MYC、NAC等,这些转录因子与下游相关基因启动子上的顺式作用元件(MYBRS、MYCRS、NACRS)相互识别,从而调控相关基因的表达以应答盐胁迫[50]。对于不依赖ABA的转导途径,植物将识别到的盐胁迫信号进行以Ca2+和干旱应答元件为中心的信号转导,从而诱导植物发生相应的生理生化变化以缓解盐伤害[50]。
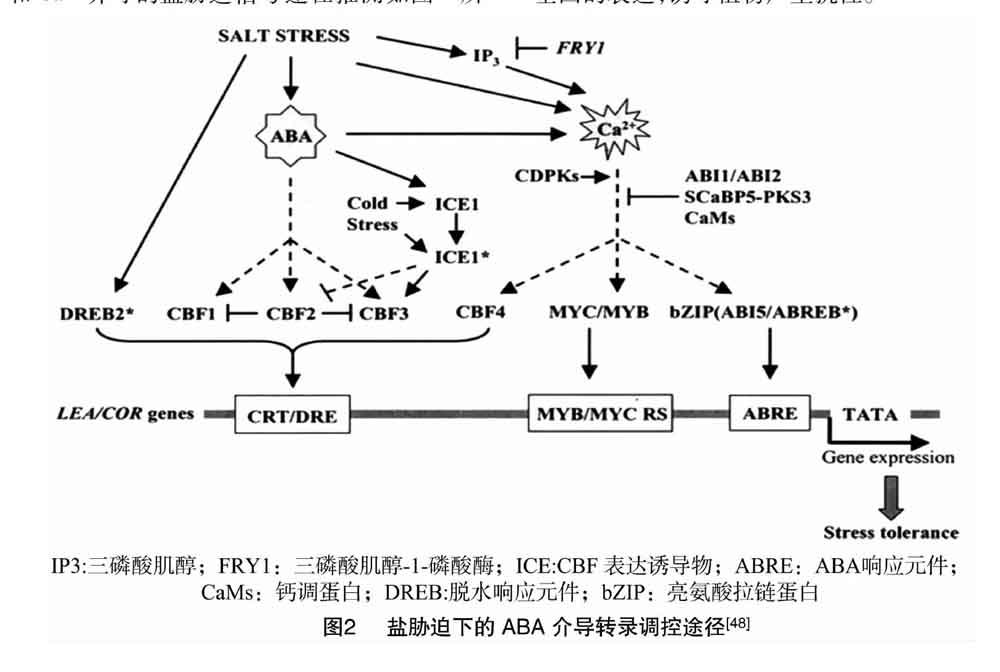
通过ABA和Ca2+介导的盐胁迫信号途径推测如图2所示。盐胁迫诱导ABA积累,激活C-重复结合因子(CBFs)的表达,又通过C-重复/脱水响应(DRE/CRT)顺式元件反馈调节晚期胚胎丰富蛋白/冷响应(LEA/COR)基因表达;盐胁迫激活钙离子通道,此信号通道受CDPK正调控,ABI1/ABI2、CaMs、钙调素蛋白激酶(SCaBP5-PKS3)负调控,调控位于下游的MYC/MYB、bZip等转录因子,继而调控下游目标基因的表达,诱导植物产生抗性。
2.3.3 CDPK级联反应 通常认为,盐胁迫下CDPK主要通过参与调节气孔开闭、离子通道相关基因的表达来调节植物对盐胁迫的耐受性。目前已经从很多种植物中鉴定出了CDPK基因,它能解码和翻译钙浓度升高信号,从而提高蛋白激酶活性并调控下游信号元件[51]。研究表明,拟南芥质膜上的CDPK6过量表达,能够激活胁迫响应相关基因的表达从而增强植株的耐盐性[52]。CDPK还能通过诱导活性氧(ROS)清除基因的表达、抑制还原性辅酶(NADPH)氧化酶的表达来调节活性氧的平衡,从而在抗氧化胁迫响应中起作用,提高植物的耐盐性[53]。
2.3.4 磷脂信号通路 盐胁迫下,细胞膜不仅能将胁迫信号由胞外传递至胞内,其本身也能作为前体参与第二信使的合成而参与磷脂信号通路,这些第二信使主要由磷脂酶C(PLC)和磷脂酶D(PLD)催化产生。PLC能催化形成第二信使IP3,触发Ca2+的释放,这些Ca2+信号被感受器感知后参与ABA调节气孔运动、盐胁迫相关基因的表达[54]。而PLD则参与响应盐胁迫的蛋白激酶信号转导。研究表明,盐胁迫下,PLDα1被激活产生的PA与盐信号靶蛋白MAPK6结合,使其活性增加,促使SOS1磷酸化,增加Na+外排,提高植物耐盐性[55]。
3 主要耐盐相关基因研究
3.1 渗透调节相关基因
在高渗透胁迫环境下,起重要作用的渗透感知通路是高渗透性甘油促分裂原活化蛋白激酶通路,它可以激活一系列应答反应,其中起重要作用的是跨膜组氨酸激酶SLN1[56]。此后在拟南芥上克隆出了一个组氨酸激酶基因HK1,比对发现,其编码的蛋白在结构上与酵母的SLN1具有较高的同源性[57],推测HK1具有感知渗透胁迫功能。丝裂原活化蛋白激酶(MAPK)是最重要的也是分离最多的蛋白激酶,参与了盐胁迫信号转导途径,接收外界胁迫信号并传入胞内,影响胞内盐响应蛋白的表达,从而提高耐盐性[58]。在拟南芥中过量表达CaMAPK9,能显著提高盐胁迫下的发芽率,根系长度也明显长于对照[59]。
脯氨酸、甜菜碱、多元醇等在盐胁迫下会大量积累,因此,编码这几种物质的基因成为重要的耐盐相关基因,如脯氨酸合成中的关键限速酶P5CS,以及甜菜碱合成过程中的关键基因BADH、CMO、mtlD和gutD。将菜豆P5CS1和P5CS2转入拟南芥中,盐胁迫下,这2个基因的表达都强于野生型拟南芥,脯氨酸含量显著高于对照,增强了耐盐性[60]。将BADH基因转入紫花苜蓿中,发现盐胁迫下野生型植株不能正常生长,而转基因植株的相对电导率和MDA含量较低,POD和SOD活性则高于野生型,表明转外源BADH基因能增强苜蓿的耐盐性[61]。
3.2 通道蛋白相关基因
高盐浓度可以促使植物产生2类大分子蛋白,第1类为亲水性蛋白,如水通道蛋白(AQP)和胚胎后期发生富集蛋白(LEA)。水通道蛋白在植物水分转移过程中起重要作用,在逆境胁迫中参与液泡融合以及活性氧的信号传导等[62]。將番茄中克隆到的水通道蛋白SIMIP基因转入拟南芥中,盐胁迫下,转基因拟南芥植株生长受抑制程度要低于野生型,同时转基因拟南芥能够通过加大根尖分生区Na+的外流和H+、K+的内流,更有效地调节细胞内外离子交换能力,这表明转基因拟南芥具有更强的渗透调节能力[63]。胚胎后期发生富集蛋白在种子胚胎发育后期表达丰富,且在盐胁迫等逆境下mRNA也大量积累。Park等将甘蓝型油菜中的Me-leaN4基因导入到生菜中,发现转基因植株有较强的抗盐性,在 100 mmol/L 盐溶液中,转基因植株的平均根长和鲜质量均较野生型有明显提高[64]。第2类为热激蛋白。热激蛋白最早被认为是在热胁迫后受到诱导,通过深入的研究发现它具有分子伴侣功能,受多种生物胁迫诱导[65-66]。用 300 mmol/L NaCl溶液处理胡萝卜,叶片中小分子Hsp17.7蛋白显著增加,原核表达分析,转入Hsp17.7蛋白的大肠杆菌在盐环境中表现更高的存活率,蛋白表达也较强,这些结果表明,Hsp17.7 不仅参与耐热性,也参与耐盐性,且在盐胁迫中表现出分子伴侣的作用[67]。
3.2.1 盐过度敏感基因 通过筛选SOS突变体,发现了SOS1~SOS5[68]。Liu等的研究表明,增强SOS1的表达能在盐胁迫下维持胞内较低浓度的Na+[69],将互花米草SOS1转入水稻中,发现增强了日本晴水稻的耐盐性[70]。SOS4可以催化吡哆醛-5-磷酸的生物合成,而SOS4对盐的超敏性由控制吡哆醛激酶的基因突变所致[71];在拟南芥中新克隆出的SOS6,其编码一个纤维素合成类似蛋白[72],盐胁迫下SOS6引起活性氧的迅速积累,造成氧化胁迫[73]。
3.2.2 离子转运蛋白 在盐环境中,植物能将Na+从胞质内排到液泡中,减少Na+的毒害,这一过程依赖NHX完成。到目前为止,已在许多植物中克隆出了NHX基因,如大豆GmNHX1[74]、小麦TaNHX1-2[75-76]。有报道称,超表达AtNHX的拟南芥具有耐盐性[77],此后将绿豆VrNHX1异源导入拟南芥,显著提高了转基因拟南芥的耐盐性[78]。此外,研究发现,超表达AtNHX1促进盐胁迫下番茄细胞中K+从地下部向地上部运输,使得液泡中K+含量升高,提高了K+/Na+,减轻了Na+毒害[79]。
3.2.3 高亲和K+转运蛋白 HKT被证实与植物耐盐性密切相关,主要分为2种类型:一种特异运输Na+和介导Na+吸收[80],另一种是作为Na+/K+协同转运蛋白[81]。研究表明,水稻HKT1、HKT2受盐胁迫诱导表达,通过调节K+和Na+比例来降低Na+的浓度[82];最近的研究表明,沿海生态型拟南芥Tsu-1 HKT1在茎中表达水平较高,从而减少了Na+向生殖器官的运输,降低了Na+对生殖器官的毒害,使植株具有更强的适应盐环境能力[83]。
3.3 抗氧化相关基因
盐胁迫的主要危害之一就是由于膜脂过氧化导致的细胞膜透性增大,而SOD、POD、CAT、GSH等是植物体内重要的抗氧化保护物质,能抑制清除活性氧。将NtGST/GPX于烟草中过量表达,其耐盐性得到增强[84]。
4 提高植物耐盐性的途径
迄今为止,国内外研究报道了许多提高植物耐盐性的途径,主要有耐盐锻炼、生物化学物质诱导耐盐性以及培育耐盐品种等。
4.1 耐盐锻炼
植物在不同的生长发育时期对盐的抵抗力不同。在对植物进行耐盐锻炼时,以低浓度盐(0.1% NaCl)处理水稻幼苗,可提高水稻的耐盐性,降低0.3% NaCl对其生长的抑制[85]。
4.2 生物化学物质诱导耐盐性
用化学试剂处理种子或者植株,是常用的提高植物耐盐性的途径。研究表明,γ-氨基丁酸[86]、亚精胺[87]浸种后均能提高番茄种子盐胁迫下的萌发,提高番茄幼苗的生长,从而缓解盐胁迫伤害。海藻糖是一种新型的糖类,研究表明,在盐碱条件下,海藻糖能有效提高植物的抗性,缓解番茄幼苗的盐伤害,提高番茄的产量和品质[88]。外源NO能够明显促进盐胁迫下大豆幼苗生长,缓解盐胁迫对大豆幼苗生长的抑制[89]。
4.3 培育耐盐品种
随着生物技术的不断进步,生物学研究的不断深入,植物组学研究的不断发展,耐盐品种的培育已经从普通的生理生化深入到分子水平。研究者已经可以通过构建耐盐基因载体、修饰植物内部基因等方法进一步改良植株。在蔬菜上,将耐盐植物红树的DNA导入辣椒、豇豆、茄子等都获得了耐盐性较强的转化后代[90]。
4.4 其他途径
嫁接是提高果菜类蔬菜对非生物胁迫抗性的重要手段。最近的研究报道阐述了嫁接黄瓜耐盐性提高的机制,主要是南瓜砧木通过根源过氧化氢信号增强了根系Na+的外排能力,并促进盐胁迫早期叶片气孔关闭来适应盐胁迫[91]。
5 展望
