乙醇对谷氨酸棒杆菌重组蛋白表达的影响
2019-08-21刘秀霞孙曼曼杨艳坤白仲虎
高 雄, 刘秀霞, 孙曼曼, 杨艳坤, 白仲虎
(1. 江南大学 粮食发酵工艺与技术国家工程实验室, 无锡 214122; 2. 江南大学 工业生物技术教育部重点实验室, 无锡 214122; 3. 江南大学 生物工程学院, 无锡 214122)
谷氨酸棒杆菌是一种兼性厌氧的革兰氏阳性工业微生物,广泛用于一些有机酸的合成[1]。因具有无内毒素、抗逆性强、蛋白酶水平较低等优势,近年来谷氨酸棒杆菌也正逐渐被开发用于生物燃料的生产以及外源重组蛋白的表达[2-3]。
乙醇是各种分子伴侣的强烈诱导剂,分子伴侣表达水平的提高能够促进重组蛋白的可溶性表达[4-5]。尽管也有一些添加乙醇后对大肠杆菌蛋白表达产生有益效果的报道,但这一策略往往会因为大肠杆菌的乙醇耐受性较差而无法实现[6-7]。相比之下,革兰氏阳性菌株的有机溶剂耐受性要高于革兰氏阴性菌株,谷氨酸棒杆菌又拥有较强的乙醇脱氢酶活性,可以利用乙醇作为唯一碳源生长[8]。为了研究添加乙醇的策略是否能够对谷氨酸棒杆菌表达重组蛋白产生促进作用,笔者就乙醇添加对于谷氨酸棒杆菌EGFP的表达以及菌体生长等方面的影响进行了研究。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和引物
谷氨酸棒杆菌CGMCC1.15647(CorynebacteriumglutamicumCGMCC1.15647)、大肠杆菌DH5α、质粒pXMJ19由本实验室保藏。质粒p19-0(pXMJ19-mut△Ptac,△lacI,T7 Isolator)、pXMJ19-EGFP(pXMJ19-mut,△lacI,EGFP)由本实验室构建和保藏[9]。自诱导载体PICL-B-EGFP在本研究中构建。所用引物见表1,引物的合成和测序工作均由苏州金唯智公司完成。
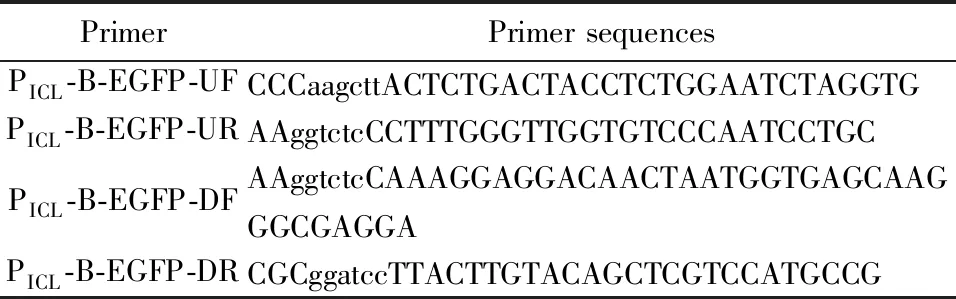
表1 本试验所用的引物Table1 Primers used in this study
1.1.2 培养基和培养条件
大肠杆菌使用LB培养基在37 ℃培养。除非另有说明,谷氨酸棒杆菌使用LBB(LB+1%脑心浸出液)培养基在30 ℃培养,转速为200 r/min。抗生素使用氯霉素,作用终浓度在大肠杆菌中为 34 mg/L,在谷氨酸棒杆菌中为10 mg/L。
1.1.3 酶和试剂
限制性内切酶(Thermo Fisher Scientific);Q5高保真DNA聚合酶(New England Biolabs);EsTaqMasterMix(康为世纪生物科技);T4 DNA连接酶(TaKaRa Bio);质粒提取试剂盒、PCR产物纯化试剂盒和胶回收试剂盒(Axygen Scientific);基因组提取试剂盒(天根生化科技)。
1.1.4 主要耗材和仪器
高速冷冻离心机和PCR仪(Thermo Fisher Scientific);超声波细胞破碎仪:VCX800(SONICS);荧光分光光度计(上海棱光技术)。
1.2 方法
1.2.1 质粒构建
利用引物PICL-B-EGFP-UF/R对谷氨酸棒杆菌基因组进行PCR扩增,得到带有HindⅢ/以及bsaⅠ接头的异柠檬酸裂合酶编码基因的启动子区域(从ATG上游500 bp到ATG下游59 bp,包含了转录起始位点以及完整的5′末端非翻译区)。利用引物PICL-B-EGFP-DF/R对含有EGFP的质粒pXMJ19-EGFP[9]进行PCR扩增,得到含有bsaⅠ以及BamHⅠ接头的EGFP片段(其5′末端含有一个保守的核糖体结合位点AAAGGAGGA)。将得到的启动子片段和EGFP片段分别用上述接头对应的内切酶处理。酶切、纯化后将两片段与HindⅢ和BamHⅠ处理过的p19-0载体一起进行连接反应。转化大肠杆菌DH5α,构建得到乙醇诱导载体PICL-B-EGFP。
1.2.2 生长曲线的绘制
将过夜培养的谷氨酸棒杆菌接种于50 mL新鲜培养基中,使初始OD600值为0.3。用移液器精确分装48 mL培养物至24多孔培养板中,每孔2 mL。置于30 ℃,200 r/min摇床中培养,每隔2 h从对应的孔中吸取培养物用于OD600和荧光强度检测。
1.2.3 增强型绿色荧光蛋白强度的测定
将待测的谷氨酸棒杆菌培养物用PBS缓冲液洗涤两次,重悬并将OD600调至0.5左右,使用荧光分光光度计测定荧光强度。激发波长为488 nm,发射波长为507 nm。
1.2.4 SDS聚丙烯酰胺凝胶电泳样品的制备
收集所有用于蛋白胶检测的样品,弃去上清。用PBS缓冲液洗涤两遍,称取相同湿重的菌体(约0.03 g)。加入1 mL PBS缓冲液重悬,利用超声波破碎样品(间隔2 s,破碎1 s,25%功率,15 min)至不再浑浊,破碎过程置于冰水混合物上。破碎后12 000 r/min,4 ℃离心15 min。取适量上清加入5×蛋白胶上样缓冲液混匀,置于沸水浴煮5 min。
2 结果与分析
2.1 不同乙醇浓度对tac启动子表达EGFP的影响
检测了含有pXMJ19-EGFP载体、tac启动子组成型表达EGFP的谷氨酸棒杆菌在0%、1%、3%和5%乙醇培养基中培养24 h后的OD600以及荧光强度。如图1所示,显然较高浓度的乙醇(4%、5%)对于谷氨酸棒杆菌的生长和外源蛋白表达都是有阻碍的。低浓度的乙醇(1%、2%)不但能促进生物量大幅提升,而且可以显著提高外源蛋白的表达水平。有趣的是,谷氨酸棒杆菌在3%乙醇浓度下培养24 h后,荧光强度和菌体OD600与不加乙醇的对照相比都基本一致,似乎展现出了某种平衡性。

图1 不同浓度乙醇对单位荧光强度和OD600的影响
由此可见,乙醇的添加对谷氨酸棒杆菌存在着正反两个方面的效应:高于某个“平衡浓度”时,菌体生长量和外源蛋白表达水平下降。低于“平衡浓度”时,生物量提高、外源蛋白表达水平提高。需要说明的是,这一“平衡浓度”的具体数值理所当然会与菌株、含有的质粒以及培养条件等因素有关。同时,“平衡浓度”所指的不仅仅是单纯的使菌体生长与对照组最接近时的乙醇添加浓度,这一浓度某种程度上也反映了菌体在胁迫环境中的总体生长过程。实验中发现:培养至16 h之后,“平衡浓度”及以上的实验组和不加乙醇的对照组菌体生长基本都已停滞或极为缓慢,但初始添加了低浓度乙醇的样本此时还没有达到发酵终点,仍有较高的生长速率(图2)。
2.2 乙醇在被利用的过程中促进了绿色荧光蛋白的表达
鉴于低浓度乙醇的添加对谷氨酸棒杆菌EGFP表达展现出了有益效果,笔者对其做了进一步的探讨。谷氨酸棒杆菌具有较强的乙醇脱氢酶活性,乙醇会经过乙醇脱氢酶和醛脱氢酶转化为乙酸,然后通过乙酸激酶(acetate kinase, AK)和磷酸转乙酰基酶(Phosphotransacetylase, PTA)转化为乙酰辅酶A继而进入乙醛酸循环和三羧酸循环途径被菌体利用。并且,谷氨酸棒杆菌存在着与大肠杆菌中葡萄糖效应类似的机制,即菌体会优先利用速效碳源[10]。上述表达EGFP的谷氨酸棒杆菌的生长和单位荧光强度变化曲线如图2所示,不难看出EGFP水平相比对照的提高发生在菌体的二次生长过程中,这一阶段乙醇作为最主要的迟效碳源被菌体利用。葡萄糖的存在能够显著抑制乙醇脱氢酶等乙醇代谢途径关键酶的表达从而抑制乙醇的利用[8, 11]。如图3所示,在培养基中额外添加1%的葡萄糖、培养24 h后,菌体量相比对照大幅增长,但EGFP表达水平下降。而在已含有1%葡萄糖的培养基中再加入1%乙醇后,菌体量和EGFP相比单纯添加葡萄糖的培养基却有所降低。由此可见,乙醇是在被利用的过程中促进了EGFP表达的提高,乙醇对菌体的一些胁迫刺激作用例如对分子伴侣的诱导并不是荧光强度提高的原因。

图2 生长曲线和单位荧光强度的变化
2.3 乙酸无法完全替代乙醇诱导EGFP的表达
乙醇的利用会促进菌体的生长,荧光蛋白表达水平的提升也许只是更多代次的菌体增殖所致。乙酸是乙醇代谢过程的中间产物,谷氨酸棒杆菌同样可以充分利用乙酸作为唯一碳源生长。在Arndt等的报道中,谷氨酸棒杆菌在含有1%乙醇的合成培养基中生长速率要略低于含有同样浓度乙酸作为唯一碳源的培养基[8]。如图4所示,添加1%乙酸培养上述EGFP表达菌株48 h后,单位荧光强度相比对照只提高了约20%。在不添加葡萄糖的MM合成培养基[8]中,以乙醇为唯一碳源培养时的单位荧光强度仍会比乙酸高出约70%。因此,无法完全用乙酸的利用去解释乙醇对EGFP表达的诱导效应。在Arndt等的表达谱数据中,有39个基因在以乙醇为唯一碳源的培养基中表达水平显著高于葡萄糖或乙酸碳源培养基,这些基因的功能涉及了锌、镁、锰离子的吸收以及三羧酸循环途径[8]。此外,一些脱氢酶(如琥珀酸脱氢酶、乙醇脱氢酶、乙醛脱氢酶等)的表达水平也会在以乙醇为唯一碳源时大幅提高,因此乙醇利用所导致的荧光蛋白表达提高或许和胞内还原力水平有关。

图3 添加葡萄糖对单位荧光强度的影响
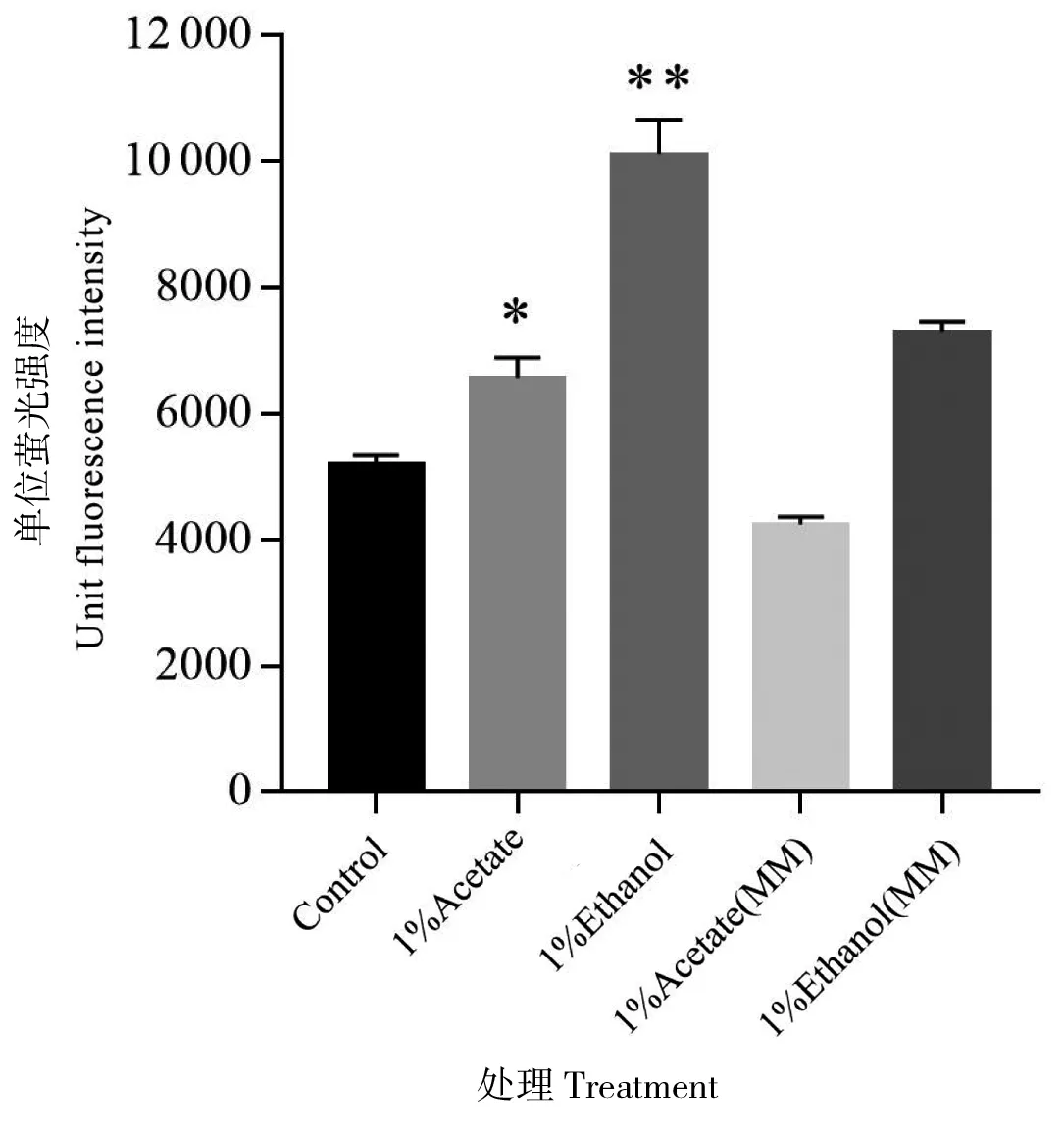
*:P≤0.05; **:P≤0.01
图4乙酸和乙醇对EGFP表达影响的对比
Figure 4 Comparison of the influence on EGFP expression between acetate and ethanol. Statistically significant differences compared with control sample were indicated with asterisks
2.4 几种常见培养基的效果比较
考虑到低浓度的乙醇一方面能在菌体的二次生长阶段作为碳源被利用刺激谷氨酸棒杆菌大量生长,另一方面又对外源蛋白表达有显著的促进作用。因此当利用谷氨酸棒杆菌进行外源蛋白表达时,乙醇或许更适合作为补料碳源。如前文所述,谷氨酸棒杆菌的蛋白表达与大肠杆菌一样会受到速效碳源的抑制,因而培养基中添加葡萄糖对于外源蛋白表达不利。利用大肠杆菌表达蛋白时往往会以甘油为碳源补料,然而谷氨酸棒杆菌很多关于外源蛋白表达的研究仍旧会以葡萄糖作为主要的碳源和能源,所使用的半合成培养基也大多是在酵母粉或LB培养基的基础上进行改进,例如添加脑心浸出液(brain heart infusion,BHI)等物质[13]。因此就乙醇和其他营养物质的添加对谷氨酸棒杆菌荧光蛋白表达和菌体生长量的影响进行了对比。如图5所示,培养48 h后,无论是OD600还是单位的荧光蛋白表达强度,在LB培养基的基础上添加乙醇都要比添加昂贵的脑心浸液要好。有趣的是,完全由4%脑心浸出液构成的BHI培养基虽然也能显著促进菌体生长,但脑心浸出液的添加似乎会对蛋白表达产生一定的抑制作用。
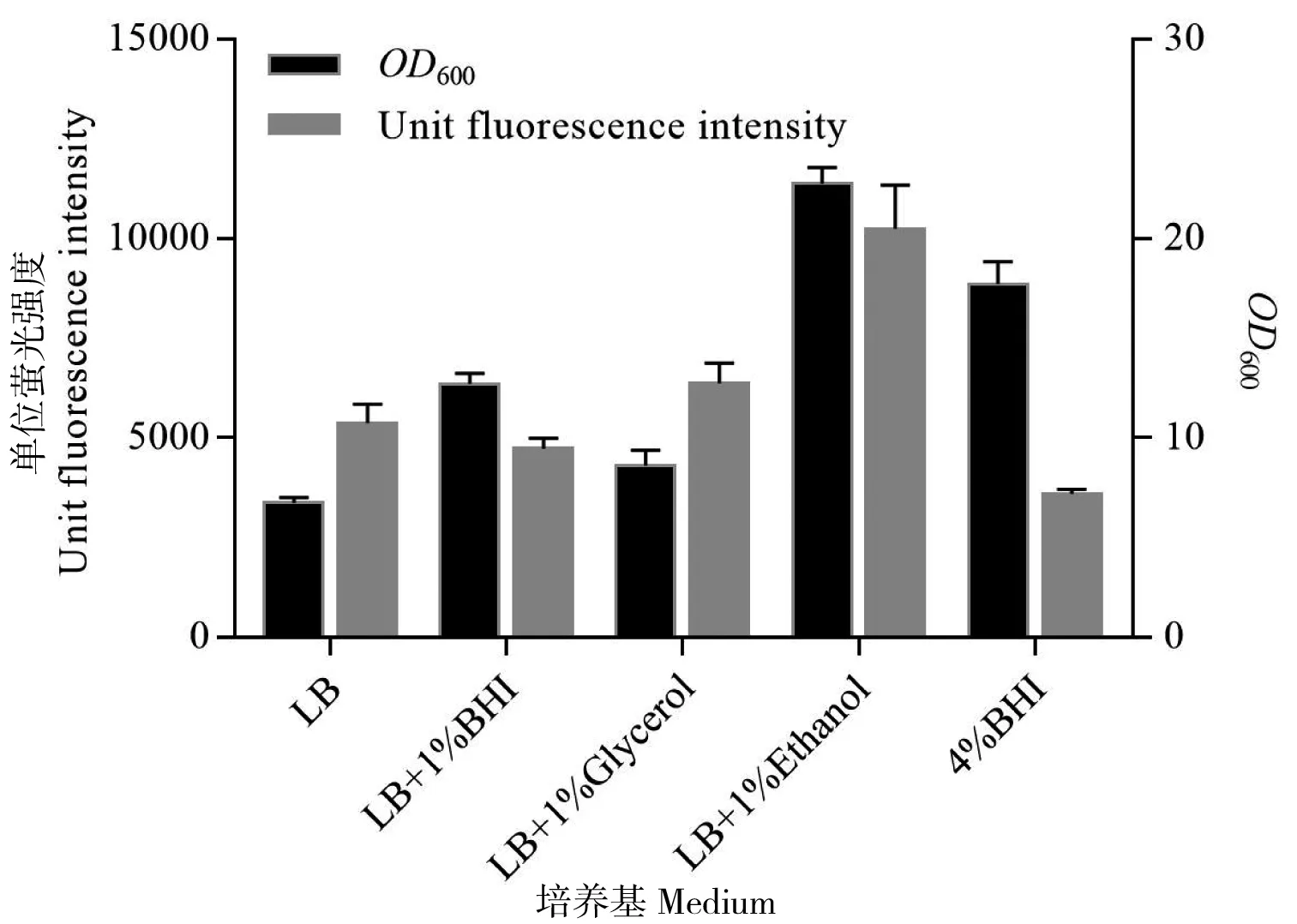
图5 不同营养物质的添加对EGFP和OD600影响的对比
2.5 乙醇诱导启动子的构建
如图6所示,在对图2中36 h的样品进行的SDS-PAGE检测中,1%乙醇的添加会使得菌体胞内蛋白多出一条蛋白条带,该条带相比其他被1%乙醇诱导的蛋白更为显著,这意味着乙醇对该启动子的诱导幅度较大又或者该基因的翻译效率较高。经质谱检测该条带是乙醛酸循环中的异柠檬酸裂合酶(Isocitrate lyase,ICL)。为了对乙醇作为迟效碳源及其诱导外源蛋白表达的效应加以利用,实验用该基因启动子以双顺反子的形式构建了EGFP的表达载体,并对其诱导表达荧光蛋白的能力进行了测试。其中双顺反子结构的应用有助于提高翻译效率以及mRNA稳定性(构建原理见图7)[14-15]。如图8所示,在含有1%乙醇的LBB培养基中培养36 h后,相比不添加乙醇的对照该表达载体具有9.5倍的诱导效果,相比自身对数期(4 h)的表达水平有着21.1倍自诱导效果。添加1%乙醇的条件下该自诱导载体的表达水平达到了tac启动子约65%的强度,高出不添加1%乙醇时的tac启动子约30%。Kim等开发并优化的谷氨酸棒杆菌自诱导载体表达sfGFP时的自诱导倍数为3.5倍,但由于该报道并没有与传统的tac启动子进行对比,培养条件和表达的蛋白种类也有差异,因而无法对两种自诱导启动子的表达强度进行直接对比[16]。

图6 SDS-PAGE检测乙醇利用引起的胞内蛋白表达变化

图7 PICL-B-EGFP双顺反子表达载体结构示意图
TSP: transcription start point; SD: Shine-Dalgarno sequence
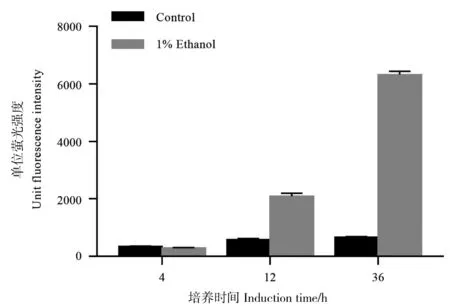
图8 PICL-B-EGFP载体的EGFP表达强度和诱导效果
