醛糖还原酶抑制剂对屋尘螨诱导的人支气管上皮细胞炎症因子的影响*
2019-07-29林玫甄海宁何芳丁敏陈亚隽袁竹青薛欣欣鲍敏
林玫,甄海宁,何芳,丁敏,陈亚隽,袁竹青,薛欣欣,鲍敏
[武汉大学附属同仁医院(武汉市第三医院) 呼吸内科,湖北 武汉 430060]
目前抑制核转录因子-κB(nuclear factor, NFκB)的活性已成为治疗哮喘气道炎症的新靶点。醛糖还原酶(aldose reductase, AR)受到环境中的炎症刺激后,表达明显升高,继而转录因子NF-κB被激活,其下游炎症介质释放,促进炎症的病理过程[1]。醛糖还原酶抑制剂(aldose reductase inhibitors, ARI)可以阻断依赖NF-κB的炎症信号,提示ARI对炎症反应有调控作用[2]。但屋尘螨诱导气道炎症的影响研究甚少。为此,笔者拟探讨ARI对屋尘螨诱导的气道上皮细胞炎症因子的影响。
1 材料与方法
1.1 材料
1.1.1 主要仪器Hettich UNIVERSAL 32R台式离心机(德国Eppendorf公司),微量加样器、微量加样管均购自德国Eppendorf公司,垂直流超净工作台(上海智城分析仪器制造有限公司),恒温二氧化碳培养箱(上海姚氏仪器设备厂),热循环仪(德国Eppendorf公司),酶标仪(德国Satorius公司),Nandrop分光光度计(德国Eppendorf公司),恒温摇床(美国New Brunswich Scientific公司),蛋白电泳仪(北京六一生物科技有限公司)。
1.1.2 主要试剂健康人支气管上皮细胞16-HBE(武汉大风生物科技有限公司),RPMI 1640培养液(美国Invitrogen公司)、胎牛血清(美国Invitrogen公司),屋尘螨抗原(Horsholm,Denmark,丹麦ALK公司),焦碳酸二乙酯(diethy pyrocarbonate,DEPC)(广州索沃生物技术公司),RNA提取试剂盒(日本TaKaRa公司),逆转录酶(M-MLV-RT)、引物均购自上海英骏生物工程有限公司,PCR试剂盒(日本TaKaRa公司),ELISA试剂盒(武汉谷歌生物科技有限公司),核蛋白提取试剂盒(南京凯基生物科技有限公司),醛糖还原酶抑制剂唑泊司他(Zopolrestat)(美国Pfizer 公司)。
1.2 方法
1.2.1 细胞培养将复苏后的16-HBE细胞置于25 cm2培养瓶中,用含12%胎牛血清的RPMI 1640培养液培养,置培养瓶于37℃、5%二氧化碳CO2培养箱中,每日更换培养液。倒置显微镜下可见细胞呈不规则多边形,待90%培养瓶底被细胞呈鹅卵石样铺满后,进行传代培养。换液1次/d,约2 d后传代。按l∶2~1∶4的比例将其分瓶传代培养。当细胞融合至90%~95%后,将细胞消化,并用细胞计数板计数,传至6孔平底细胞培养板,每孔加入密度为2×105个/ml的细胞悬液2 ml,继续培养24 h后,建立细胞模型及相关实验。
1.2.2 细胞分组培养板中的细胞分为空白对照组、屋尘螨组、屋尘螨+Zopol组和Zopol组,每组分别置于12个培养孔中培养。选择既不影响细胞活性,也有显著抑制效应的浓度,屋尘螨+Zopol组以50μmol/L 的浓度加入Zopol,并加入屋尘螨共同培养24 h;Zopol组以50μmol/L的浓度加入Zopol,但不加入屋尘螨;空白对照组不加入刺激物,培养24 h。屋尘螨组加入屋尘螨刺激,培养24 h。
1.2.3 提取核蛋白收集细胞,弃掉培养液,以预冷的磷酸盐缓冲溶液洗涤2遍;用移液枪吸去上清液;每毫升Buffer A中加入5μl 100 mmol/L PMSF、1μl蛋白酶抑制剂、1μl二硫苏糖醇,根据细胞压积,按体积比行细胞压积∶Buffer A为1.0∶1.5,加入上述准备好的预冷的150μl Buffer A,以最大转速进行涡旋剧烈振荡15 s,并置于冰上10 min;加入12.5μl Buffer B,快速震荡混匀,放置冰上1 min后,于4℃、16 000 r/min离心30 s。收集上清至新的离心管。于每毫升Buffer C中加入1μl蛋白酶抑制剂、5μl 100 mmol/L PMSF、1μl二硫苏糖醇,在离心沉淀物中加入上述准备好的预冷的100μl Buffer C,以最大转速进行涡旋剧烈振荡15 s,并置于冰上30 min,每间隔10 min进行涡旋剧烈振荡15 s;4℃、16 000 r/min离心10 min,把上清转入预冷的离心管;以考马斯亮蓝G-250染料,进行蛋白浓度测定,并保存于-80℃,应避免反复冻融。
1.2.4 Western blotting取出聚丙烯酰胺凝胶电泳,装入电泳槽,再加入电泳缓冲液;将蛋白样品与5×十二烷基磺酸钠-聚丙烯酰胺凝胶加样缓冲液相混合,再按照上样顺序进行点样,使样本浓度及体积保持一致;对应正负极盖上盖子,红对红,黑对黑,将电压调整至80 V,进行电泳;气泡出现指示电泳开始,待蛋白样品电泳至下层分离胶时暂停电泳,将电压调至120 V继续电泳;等溴酚蓝电泳到分离胶底部时,停止电泳。将裁剪掉右上角的聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)泡入甲醇中待用;在容器中倒入预冷的转膜缓冲液,将转膜夹和海绵完全浸入转膜缓冲液中,并将滤纸和用甲醇活化的PVDF膜一起放入转膜液中10 min;取出电泳完的凝胶玻璃板,切割目的蛋白所在区域凝胶;将目的蛋白凝胶置于滤纸上,并用转膜液润湿,将PVDF膜置于凝胶之上,赶出气泡,盖上滤纸,防止引入气泡;合上转膜夹,将转膜夹对应正负极放入转膜槽,电极方向为膜正胶负,使夹的黑面对着槽的黑面,且夹的白面对着槽的红面;放入冰盒,灌满转膜液,对应正负极盖上盖子,于200 mA进行转膜60 min。在室温下将PVDF膜正面朝上放入含5%脱脂奶粉的TBST封闭液,摇床上封闭孵育1 h;把一抗(兔抗小鼠NF-κB/p65多克隆抗体,兔抗小鼠Histone H3抗体)以含0.5%脱脂奶粉的TBST抗体稀释液按1∶1 000稀释;取出膜并放于已经加好一抗的小塑料袋中;室温下把膜置于摇床上一抗孵育1 h;取出膜,TBST溶液中洗涤,每次10 min,重复漂洗3次。用抗体稀释液以1∶6 000稀释二抗(辣根过氧化物酶标记羊抗兔免疫球蛋白G), 把膜移到已经加好二抗溶液的小塑料袋中,于室温、摇床上二抗孵育1 h;取出膜并用TBST溶液洗涤 3次,每次10 min。经过显影、定影,将图像输入电脑,应用图像分析软件对Western blotting检测结果进行分析,以Histone H3蛋白作为对照,各组中NF-κB/p65蛋白的面积灰度值与Histone H3蛋白的比值即表达 强度。
1.2.5 提取细胞总RNA吸去各6孔板中的细胞培养液,然后在每孔中加入1 ml Trizol,室温放置5 min,使其充分裂解,收集至去RNA酶的1.5 ml EP管中;12 000 r/min离心5 min,弃去沉淀;加入氯仿0.2 ml,震荡15 s,静置于室温15 min;4℃、12 000 r/min离心15 min;将上层水相转至另一EP管中,加入异丙醇0.5 ml,颠倒混匀,室温下静置10 min;于4℃、12 000 r/min离心10 min,弃上清,RNA沉淀沉于管底;加入75%乙醇lml(用0.1% DEPC水配置),震荡混匀;4℃、8 000r/min离心5 min,弃上清,于室温下自然风干RNA沉淀5~10 min,不要让RNA过度干燥;加DEPC水40μl,置60℃水浴箱5 min,使RNA溶解。在Nandrop分光光度计上测定RNA浓度和 纯度。
1.2.6 逆转录将RNA模板、引物、dNTPmix、RNA酶抑制剂、M-MLV逆转录酶、RT Buffer及RNase-Free Water溶解并置于冰上备用。根据以下配比配制反应体系:dNTPmix 4μl、Primer 2μl、RNA模板2μg、5×RT Buffer 4μl、RNA酶抑制剂2μl、M-MLV逆转录酶1μl及RNase-Free Water补充反应体积至20μl。涡旋震荡混匀,短暂离心,使管壁上的溶液收集到管底。42℃孵育50 min,72℃孵育5 min,反应结束后,短暂离心,置于冰上冷却,置于-20℃条件下保存。
1.2.7 实时荧光定量PCRPCR反应体系:2×Ultra SYBR Mixture(TaqDNA聚合酶和dNTPs)10μl,正向引物(10μmol/L)0.4μl,反向引物(10μmol/L)0.4μl,DNA模板0.8μl,RNase-Free Water 8.4μl,总体积20μl。反应条件:95℃预变性10 min,95℃变性15 s,60℃退火1 min,后2步重复40个循环;熔解曲线分析程序:95℃ 15 s,61℃ 55 s,95℃ 15 s。NF-κB/p65正向引物:5’-ATGTGGAGATCATTGAGCAGC-3’,反向引物:5'-CCTGGTCCTGTGTAGCCATT-3'。反应结束后用熔解曲线分析PCR产物的特异性,排除引物二聚体的存在。将目的基因Ct值用GAPDH的Ct值标准化,用2-△△Ct表示基因表达的相对量。△△Ct=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因一Ct内参基因)对照组。为进一步观察产物的表达情况,将PCR产物进行琼脂糖凝胶 电泳。
1.2.8 酶联免疫吸附试验(enzyme-1inked immunosorbent assay, ELISA)以ELISA检测细胞上清液中IL-29、IL-6的浓度。配制好不同浓度IL-29/IL-6的标准品,加50μl待测的细胞上清液或标准品于酶标板上,每孔加入50μl抗IL-29/IL-6抗体,使之震荡混匀;酶标板于37℃孵育2 h;洗涤4次;每孔加入100μl酶标试剂,于室温孵育30 min;洗涤4次;每孔加入100μl底物显色液,于室温下,避光孵育30 min后显色;加入100μl终止反应液,将反应板置于多功能酶标仪中,测定各孔于450 nm波长处的光密度值,并计算其浓度。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析,两两比较用LSD-t检验,P <0.05为差异有统计学 意义。
2 结果
2.1 各组NF-κB/p65 mRNA相对表达量比较
各组NF-κB/p65 mRNA相对表达量比较,经方差分析,差异有统计学意义(F =160.580,P =0.000);屋尘螨+Zopol组低于屋尘螨组(P <0.05),但高于空白对照组(P <0.05),Zopol组与空白对照组NFκB/p65 mRNA相对表达量比较,差异无统计学意义(P >0.05)。见表1和图1。
2.2 各组NF-κB/p65蛋白相对表达量比较
各组NF-κB/p65蛋白相对表达量比较,经方差分析,差异有统计学意义(F =229.181,P =0.000);屋尘螨+Zopol组低于屋尘螨组(P <0.05),但高于空白对照组(P <0.05),Zopol组与空白对照组NF-κB/p65蛋白相对表达量比较,差异无统计学意义(P >0.05)。见表1和图2。
图1 各组细胞NF-κB/p65 mRNA相对表达量比较
表1 各组细胞NF-κB/p65相对表达量比较 (n =12,±s)
表1 各组细胞NF-κB/p65相对表达量比较 (n =12,±s)
组别NF-κB/p65 mRNANF-κB/p65蛋白空白对照组1.110±0.2110.271±0.043屋尘螨组3.243±0.3821.125±0.145屋尘螨+Zopol组2.016±0.258 0.658±0.098 Zopol组1.105±0.218 0.265±0.042
图2 各组细胞NF-κB/p65核蛋白相对表达量比较
2.3 各组IL-6、IL-29蛋白水平比较
各组细胞上清液的IL-6、IL-29蛋白水平的比较,经方差分析,差异有统计学意义(F =169.729和118.681,均P =0.000);屋尘螨+Zopol组低于屋尘螨组(P <0.05),但高于空白对照组(P <0.05),Zopol组与空白对照组IL-6蛋白水平比较,差异无统计学意义(P >0.05)。见表2和 图3。
表2 各组IL-6、IL-29蛋白水平比较 (n =12,pg/ml,±s)
表2 各组IL-6、IL-29蛋白水平比较 (n =12,pg/ml,±s)
组别IL-6IL-29空白对照组103.916±15.85955.083±13.534屋尘螨组300.000 ±37.033158.833±20.630屋尘螨+Zopol组201.000±25.193103.475±12.409 Zopol组102.791±15.66454.166±15.278
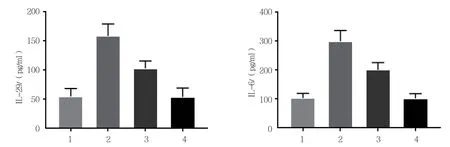
图3 各组细胞上清液IL-6、IL-29蛋白水平比较 (±s)
3 讨论
有研究发现ARI可抑制细胞因子、生长因子、高血糖、LPS诱导的细胞毒信号及炎症标志物的表 达[3-4]。ARI可抑制某些过敏原诱导的小鼠哮喘模型的气道炎症,进一步肯定了ARI的抗炎作用。AR基因敲除的大鼠可耐受变应原,在很大程度上减轻了变应原诱导的肺部炎症改变[5]。丙烯醛是一种重要的内源性脂质过氧化产物。有研究结果表明,ARI可以抑制丙烯醛诱导的肺泡上皮细胞的细胞毒性[6]。
有研究发现,ARI可阻止心瓣膜术后再狭窄、糖尿病并发症及动物模型动脉硬化的发生[7-8]。还有研究显示,ARI通过防止DOX诱导的内皮细胞毒性和功能障碍,避免了与蒽环类化疗相关的心脏毒性[9]。AR还参与多种炎症疾病的病理过程,因此ARI也可能作为抗炎药物而得到发展。
过去的研究显示,在某些动物和细胞模型中,ARI可以调控NF-κB介导的炎症信号;并观察到AR药物抑制剂或基因敲除,防止了小气道上皮细胞的凋亡及活性氧的增殖、炎症标志物的分泌、NF-κB的激活[10]。有研究提示依赖ARI的NF-κB的失活,减少了一些炎症基因的转录和表达[11]。AR可以介导过敏原诱导的气道重塑。AR抑制剂非达司他可以通过抑制TGFβ1诱导的Smad非依赖性和PI3K/AKT/GSK3β依赖性途径,而阻断这个气道重塑过程[12]。
本实验结果显示,屋尘螨+Zopol组经屋尘螨及ARI唑泊司他共同作用24 h后,人支气管上皮细胞的NF-κB/p65 mRNA水平、NF-κB/p65蛋白水平、IL-6及IL-29蛋白水平均低于屋尘螨组。ARI唑泊司他可降低人支气管上皮细胞NF-κB/p65的表达,并可能通过抑制NF-κB介导的炎症信号通路,而减少炎症因子IL-6和IL-29的表达。
有研究显示,ARI明显地减轻了气道高反应性、免疫球蛋白E的水平,嗜酸性细胞的浸润,以及气道Th2细胞因子的释放[13-14],另外,也有实验显示,经卵清蛋白刺激的小鼠,其气道炎症细胞的迁移及炎症细胞因子、趋化因子、杯状细胞化生、胶原沉积及气道高反应性可以被ARI抑制,提示ARI可能提供一个新的治疗途径应对哮喘这类气道炎症疾病。ARI非达司他处理的小鼠,接触过敏原后如鼻划痕,肥大细胞脱颗粒,在鼻通道释放类胰蛋白酶等的早期反应,与对照组比较,明显减弱,且后期反应如炎症细胞浸润、Th2型细胞因子的释放、鼻上皮重塑等均明显减弱,提示了ARI对过敏性鼻炎的疗效[15]。
综上所述,唑泊司他调控了屋尘螨诱导的NF-κB介导的炎症信号,明显地抑制了气道上皮NF-κB的表达及其下游炎症因子的表达,深入研究ARI,可能为屋尘螨引起的气道炎症的治疗提供新的方向。
