二苯乙烯苷对HepG2细胞胆固醇含量的影响及其作用机制研究*
2019-07-29林昶李玉平齐建彤郑曙光朱璨柴艺汇徐昌君王和生杨长福
林昶,李玉平,齐建彤,郑曙光,朱璨,柴艺汇,徐昌君,王和生,杨长福
(贵州中医药大学,贵州 贵阳 550002)
何首乌为蓼科植物何首乌的干燥块根,作为中医常用的一味传统中药,在我国有着悠久的应用历史。现代研究表明,何首乌具有抗动脉粥样硬化的作用[1]。该药主要含3类有效成分:蒽醌类、二苯乙烯苷类及多糖类化合物。其中二苯乙烯苷有降血脂和抗动脉粥样硬化(Atherosclerosis, AS)的作用,但其作用机制还不清楚[2-4]。本实验以肝癌HepG2细胞作为研究对象,采用氧化性低密度脂蛋白(oxidation low density lipoprotein, ox-LDL)制作高胆固醇细胞模型,二苯乙烯苷干预后观察胆固醇含量的变化,以及ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1, ABCA1)、ATP结合盒转运蛋白G1(ATP-binding cassette transporterG1, ABCG1)和B族I型清道夫受体(Scavenger reptor class B type I, SR-BI)mRNA表达水平的变化,初步探索二苯乙烯苷降胆固醇的作用机制。
1 材料与方法
1.1 材料与试剂
肝癌HepG2细胞(上海陆奥生物科技有限公司),0.25%胰蛋白酶(美国Gibco公司),青链霉素混合液(哈尔滨哈药集团制药总厂),高糖DMEM(美国HyClone公司),胎牛血清(杭州四季青生物工程材料有限公司),总RNA提取试剂盒(日本TaKaRa公司MiniBEST Universal RNA Extraction Kit),cDNA链合成试剂盒(PrimeScriptTMRT reagent Kit with Gdna Eraser)、PCR酶(Premix TaqTM)、琼脂糖及DNA Marker等购自宝生物工程(大连)有限公司,ox-LDL(北京索莱宝科技有限公司),胆固醇含量测定试剂盒(苏州科铭生物技术有限公司),DL5和00 DNA Marker(北京康为世纪生物科技有限公司),油红O染液(北京索莱宝科技有限公司),生工生物工程(上海)股份有限公司合成逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)扩增引物。见表1。
1.2 仪器与设备
MSL-3020型全自动高压灭菌锅(日本三洋有限公司),BSC 1800-Ⅱ-A/B3型超净工作台(上海瑞仰净化装备有限公司),TS-100F型倒置相差显微镜(日本Nikon公司),Multiskan FC自动酶标读仪(美国Thermo公司),NKSY恒温水浴锅(江苏诺基仪器有限公司),二氧化碳培养箱(美国Thermo公司),微量加样器(德国Eppendorf公司),D-37520台式冷冻高速离心机(美国Thermo Fisher公司),JA2004N型电子天平(上海箐海仪器有限责任公司),SIM-F140AY6ICEMAKER型制冰机(日本三洋有限公司),ELIX/RIOS-20型反渗透纯水系统(法国Millipore公司),总/游离胆固醇含量测定试剂盒(E1015/E1016)(苏州科铭生物技术有限公司),PCR扩增仪(GeneAmp 9700型,美国ABI公司),凝胶图像分析系统(GGM/D2,英国Syngene公司),超低温冰箱(德国Eppendorf公司),Bio-Rad GEL DOC 2000凝胶成像系统(美国BIO-RAD公司),细胞培养瓶(美国Corning公司),6孔和96孔培养板(美国 Corning公司)。

表1 PT-PCR引物序列
1.3 方法
1.3.1 细胞培养HepG2细胞常规培养于链霉素和青霉素终浓度为100 u/ml的含10%胎牛血清的高糖DMEM培养基中,每2~3天细胞传代1次。取对数生长期的细胞用于实验研究。
取HepG2细胞悬液,在显微镜下进行细胞计数,调整细胞浓度为5×106个/ml,将细胞悬液接种于25 cm2培养瓶内,1ml/瓶,用培养基补足至3.5 ml,在37℃、5%二氧化碳CO2环境下孵育24 h至细胞贴壁,弃培养基,用提前预冷的PBS冲洗2次,更换培养液。实验分为正常组、模型组(ox-LDL 50 mg/L)、 A组(ox-LDL 50 mg/L+二苯乙烯苷250μmol/L)、B组 (ox-LDL 50 mg/L+二苯乙烯苷188μmol/L)、C组(ox-LDL 50 mg/L二苯乙烯苷125μmol/L)及D组(ox-LDL 50 mg/L+二苯乙烯苷62.5μmol/L),每组培养3瓶,重复3次,换成相应的培养液后继续培养细胞48 h后。油红O脂肪染色法观察,测定各组细胞内总胆固醇(total cholesterol, TC)、游离胆固醇(free cholesterol, FC)及培养基上清TC和FC。采用RTPCR检测肝癌HepG2细胞ABCG1、ABCA1和SR-BI mRNA表达水平的变化。
1.3.2 细胞变化按照油红O脂肪染色试剂盒说明书进行染色。吸去培养基,PBS清洗贴壁的细胞3次,ORO Fixative固定10 min,吸去固定液并干燥,ORO Stain液染15 min,加入适量60%异丙醇漂洗30 s并用流水冲洗,苏木精复染2 min,ORO Buffer染1 min,流水冲洗晾干后镜下观察结果。
1.3.3 胆固醇测定室温下2 000 r/min离心5 min后,取各组细胞沉淀和培养基,沉淀需用PBS洗2次后以1×106个细胞加0.1 ml试剂盒配备的裂解液混匀,静置10 min后取上清进行胆固醇测定。用E1015试剂盒和E1016检测沉淀和培养基中TC、FC。取适量上清用BCA法蛋白定量试剂盒(#p1511)测定蛋白浓度,以每毫克蛋白浓度校正上清TC、FC含量,校正上清胆固醇=上清总蛋白/FC浓度×蛋白浓度。应用胆固醇的外流率=培养基TC/(培养基TC+细胞内TC)的方式计算胆固醇的外流率。
1.3.4 总RNA提取及RT-PCR扩增按购买的RNA提取试剂盒说明书和cDNA合成试剂盒的方法进行总RNA提取并合成cDNA链,进行PCR扩增反应,PCR反应条件:94℃预变性2 min,94℃变性30 s,58℃(GAPDH)、60℃(ABCA1、ABCG1)、62℃(SR-BI)退火30 s,72℃延伸30 s,共30个循环,72℃继续延伸10 min。取5μl产物进行电泳检测,用BioRad凝胶成像系统观察并拍照记录,最后用GAPDH灰度值对目的基因进行矫正并采用Quantity One软件分析。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较用LSD-t检验,P <0.05为差异有统计学意义。
2 结果
2.1 二苯乙烯苷在高胆固醇状态下对肝癌HepG2细胞内胆固醇代谢的影响
各组胆固醇情况比较,经单因素方差分析,差异有统计学意义(P <0.05);正常组、A、B、C和D组细胞内TC、FC含量均低于模型组(P <0.05),同时A、B、C和D组上清TC较模型组升高(P <0.05),B、C组上清FC较模型组升高(P <0.05)。二苯乙烯苷能够减少HepG2细胞内胆固醇含量,增加胆固醇外流率(P <0.05),其中二苯乙烯苷浓度为125μmol/L时达最高值(t =10.094,P =0.000)。见表2和图1。
表2 各组胆固醇情况比较 (±s)
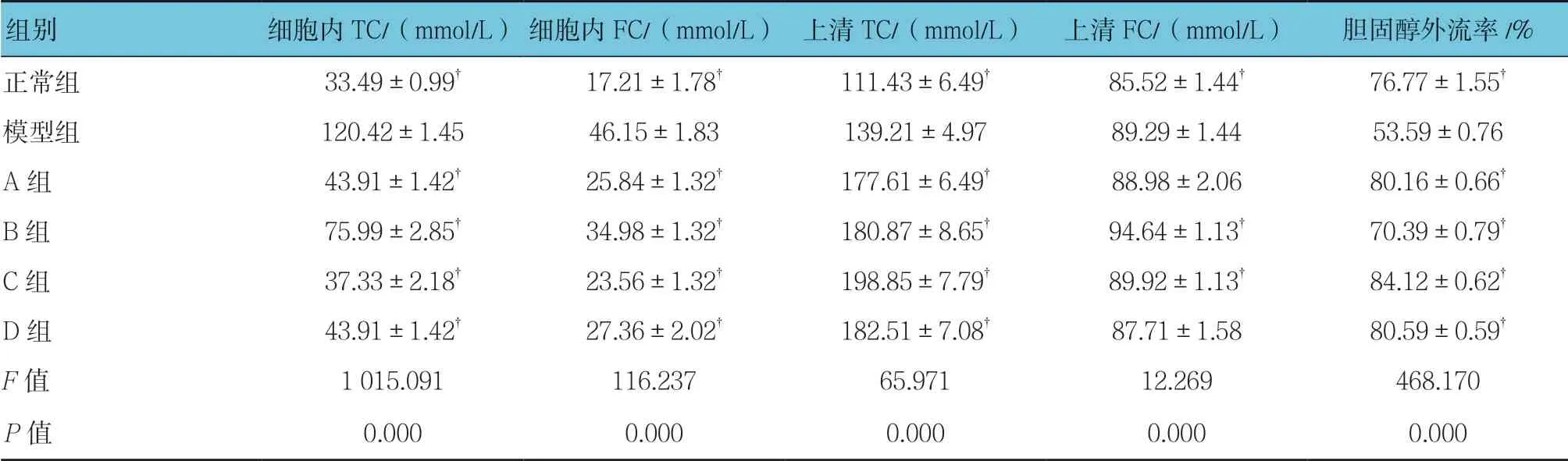
表2 各组胆固醇情况比较 (±s)
注:†与模型组比较,P <0.05
组别细胞内TC/(mmol/L)细胞内FC/(mmol/L)上清TC/(mmol/L)上清FC/(mmol/L)胆固醇外流率/%正常组33.49±0.99†17.21±1.78†111.43±6.49†85.52±1.44†76.77±1.55†模型组120.42±1.4546.15±1.83139.21±4.9789.29±1.4453.59±0.76 A组43.91±1.42†25.84±1.32†177.61±6.49†88.98±2.0680.16±0.66†B组75.99±2.85†34.98±1.32†180.87±8.65†94.64±1.13†70.39±0.79†C组37.33±2.18†23.56±1.32†198.85±7.79†89.92±1.13†84.12±0.62†D组43.91±1.42†27.36±2.02†182.51±7.08†87.71±1.5880.59±0.59†F值1 015.091116.23765.97112.269468.170 P值0.0000.0000.0000.0000.000

图1 油红O脂肪染色结果 (×400)
2.2 不同浓度二苯乙烯苷对肝癌HepG2细胞ABCA1、ABCG1和SR-BI mRNA表达的影响
各组ABCA1、ABCG1和SR-BI mRNA表达水平比较,经单因素方差分析,差异有统计学意义(P <0.05)。模型组可见各基因条带较细,较弱,进一步两两比较显示,模型组细胞ABCA1 mRNA表达水平较正常组下降(P <0.05)。A、B、C和D组ABCA1、ABCG1表达水平较模型组升高(P <0.05),A、B和C组SR-BI表达水平较模型组升高(P <0.05),A组与B组ABCA1、ABCG1及SR-BI mRNA表达水平比较,差异无统计学意义(t =1.586、0.221和0.372,P =0.139、0.829和0.716)。见表3和图2~7。
表3 各组ABCA1、ABCG1和SR-BI mRNA表达水平 比较 (±s)
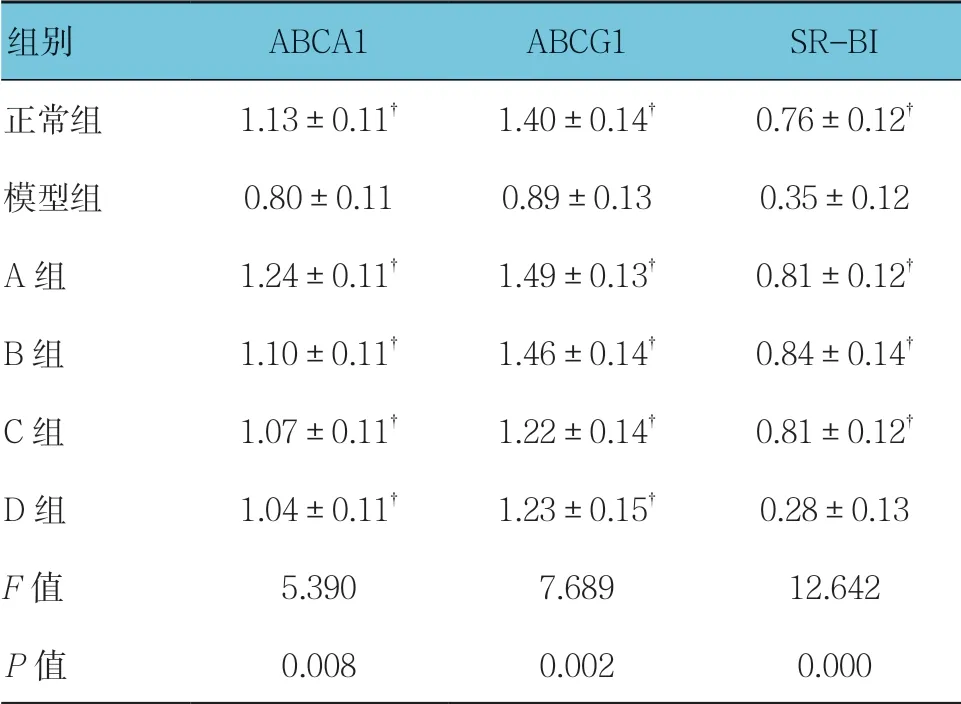
表3 各组ABCA1、ABCG1和SR-BI mRNA表达水平 比较 (±s)
注:†与模型组比较,P <0.05
组别ABCA1ABCG1SR-BI正常组1.13±0.11†1.40±0.14†0.76±0.12†模型组0.80±0.110.89±0.130.35±0.12 A组1.24±0.11†1.49±0.13†0.81±0.12†B组1.10±0.11†1.46±0.14†0.84±0.14†C组1.07±0.11†1.22±0.14†0.81±0.12†D组1.04±0.11†1.23±0.15†0.28±0.13 F值5.3907.68912.642 P值0.0080.0020.000

图2 HepG2细胞ABCA1 mRNA的表达

图3 各组ABCA1与GAPDH比值比较 (±s)

图4 HepG2细胞ABCG1 mRNA的表达

图5 各组ABCG1与GAPDH比值比较 (±s)
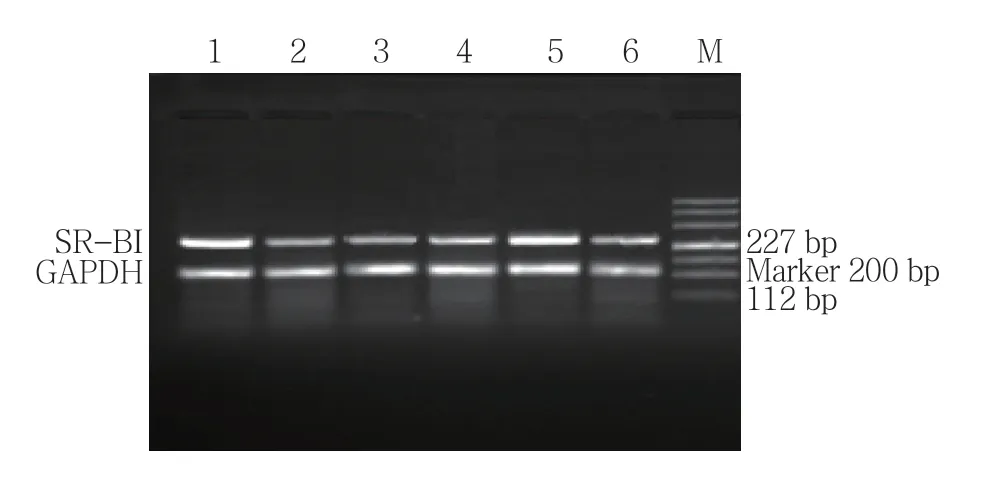
图6 HepG2细胞SR-BI mRNA的表达
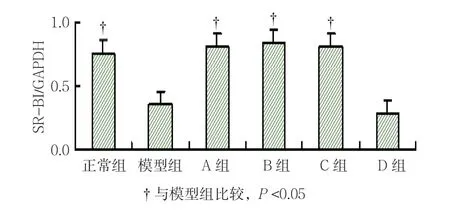
图7 各组SR-BI与GAPDH比值比较 (±s)
3 讨论
高脂血症是指血浆TC或/和甘油三脂(Triglyceride, TG)的异常增高,其是公认的AS发生、发展最重要的原因,AS病变中脂质源于血浆脂蛋白的浸润,主要为FC、胆固醇脂(cholesterol ester, CE),其次为TG、磷脂及载脂蛋白[5]。过多的脂质沉积在动脉膜内,是局部形成隆起的病灶,继而内膜纤维结缔组织增生,将其围起、固定,形成粥样斑块。流行病学调查证明,AS的严重程度随血浆胆固醇水平的升高呈线性加重[5]。
胆固醇外流与多个受体或蛋白参与密切相关[6]。当体内胆固醇过多时,可通过上调ABCA1、ABCG1和SR-BI,增加肝脏胆固醇向胆汁外流[7]。ABCA1、ABCG1和SR-BI是介导细胞胆固醇外流的重要调节蛋白,对调节胆固醇水平起着重要作用[8-10]。ABCA1参与胆固醇外流的最初始的阶段,介导细胞内FC结合到载脂蛋白apoA-I上形成pre-βHDL,接着在卵磷脂-胆固醇脂酰基转移酶(lecithin-cholesterol acyltransferase, LCAT)作用下将结合的FC酯化成CE,从而形成成熟的高密度脂蛋白(High density lipoprotein, HDL)[11]。成熟的HDL在ABCG1介导下继续结合FC,最终形成富含脂质的HDL[12]。富含脂质的HDL转运胆固醇有2条路径:一条是在CETP介导下将自身CE和极低密度脂蛋白(very low density lipoprotein, VLDL)中的TG进行交换,使VLDL颗粒逐渐变小,密度逐渐增加,最终转变成低密度脂蛋白(low-density lipoprotein, LDL),进而被肝细胞上的LDL受体识别而入肝,并在肝脏将CE解离出来[13]。继而又从CE中将FC分解出来,这一部分FC经肝细胞上ABCA1介导再次进入血液循环;另一条是富含脂质的HDL直接被肝细胞上的HDL受体SR-BI选择性识别并介导入肝,肝脏将CE解离出来,最终CE中胆固醇转化为粪甾醇类和胆汁酸后外排到胆汁[11]。ABCA1在肝细胞和外周组织细胞都有大量表达,ABCG1主要表达在外周组织细胞,SR-BI主要表达在肝组织细胞[14-16]。ABCA1使肝细胞和外周组织细胞胆固醇流出至apoA-I形成HDL,ABCG1使外周组织细胞胆固醇流出至HDL形成富含脂质的HDL,增加ABCA1或ABCG1的表达能使肝细胞和周围组织细胞流出到HDL的胆固醇增加,降低胆固醇的含量。增加SR-BI表达后,增加其介导HDL流向肝脏同时,也使胆固醇主要以HDL的形式转移至肝,减少了LDL的生成,进而降低LDL被氧化成ox-LDL的量。ABCA1、ABCG1和SR-BI是一个正性调节剂,其高表达可促进胆固醇外流,清除体内过多的胆固醇[17-18]。
ox-LDL是LDL经氧化而成的,是触发AS炎症反应引起AS的关键因子[19-20]。炎症反应贯穿AS的整个过程,与高胆固醇血症共同构成了AS的主要病因[21]。二苯乙烯苷能通过调脂、抗氧化、抗炎、舒张血管及增强免疫力等多靶点多环节,多途径发挥抗AS作 用[2-4]。有研究表明二苯乙烯苷降血脂的同时ox-LDL减少[22]。
本实验以不同浓度的二苯乙烯苷处理高胆固醇HepG2细胞后,发现二苯乙烯苷确有降胆固醇的效果,与模型组相比,ABCG1、ABCA1和SR-BI mRNA表达水平均明显上调。因此笔者认为二苯乙烯苷可能是通过上调ABCG1、ABCA1和SR-BI的表达,增加肝癌HepG2细胞胆固醇的外流,降低胆固醇的 含量。
