热处理对乳蛋白结构和消化特性的影响
2019-07-24吴相佚刘泽朋毛学英
吴相佚,刘泽朋,毛学英*
(中国农业大学食品科学与营养工程学院,北京 100083)
牛乳蛋白质中含有人体所需的氨基酸,在生长发育中起着重要作用[1-2],且蛋白质品质优[3]。近年来,通过物理或化学方法对牛乳蛋白质进行改性是研究热点,即通过酶解或物理方法(如热处理、超高压和超声波等)使氨基酸和多肽链发生变化,从而引起蛋白质空间结构和理化性质的变化,改性后的蛋白质功能特性和营养特性得到改善[4]。因此,寻找一种适当的处理方法对牛乳进行加工,提高牛乳的营养特性备受关注。
蛋白质的物理改性是指利用热、超高压、超声波等物理作用形式来对蛋白质进行改性,物理改性会改变蛋白质的高级结构和分子间聚集方式,但通常不会改变蛋白质的一级结构[5]。近年来,热处理已经成为一种常用的物理改性方法。王婷婷等[6]对牦牛乳进行热处理后发现,热处理会引起牛乳体系浊度和粒径的增加。除此之外,研究表明,热处理会对乳蛋白的消化性产生一定影响[7]。因此,本研究通过对乳蛋白进行热处理,研究热处理后乳蛋白结构及消化特性的变化,对提高乳蛋白消化特性的进一步研究具有重要的意义。
1 材料与方法
1.1 材料与试剂
浓缩乳蛋白70(milk protein concentrate,MPC70)、胰蛋白酶(Trypsin 1∶250)、胃蛋白酶(Pepsin 1∶10 000)美国Sigma公司;丙烯酰胺(acrylamide,AM)、甲叉丙烯酰胺(bis-acrylamide,BIS)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(tris(hydroxymethyl) methyl aminonethane,Tris)、过硫酸铵(ammonium persulphate,AP)、N,N,N,N’-四甲基乙二胺(N,N,N,N’-tetramathylethylenediamine,TEMED)美国Amresco公司;无水乙醇、冰乙酸、无水甲醇、盐酸、氢氧化钠、氯化钠、磷酸二氢钠、磷酸氢二钠北京化工厂。
1.2 仪器与设备
LGJ-10真空冷冻干燥机 北京松源华兴生物技术有限公司;MDF-C8V1医用低温箱 松下健康医疗器械(上海)有限公司;DSHZ-300A旋转式恒温振荡器北京博宇宝威实验设备公司;DHG-9030电热鼓风干燥箱上海一恒科学仪器有限公司;FE20 pH计 瑞士梅特勒-托利多公司;电泳槽、iMark酶标仪 伯乐生命医学产品(上海)有限公司;RF-6000荧光分光光度计岛津集团(香港)有限公司;MOS-500圆二色谱(circular dichroism,CD)仪 法国Bio-Logic公司。
1.3 方法
1.3.1 样品准备
称取适量MPC70,用去离子水配制成40 mg/mL的乳液,磁力搅拌2 h使其充分溶解。分别在25、75、85、95 ℃加热15 min,冷却至室温,取样调节pH值至7.0后冷冻干燥。
1.3.2 表面巯基含量的测定
采用Ellman’s 5,5’-二硫代双-(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)法测定不同处理后MPC70溶液的表面巯基含量[8]。称取适量MPC70冻干样品,溶于蒸馏水配制为质量浓度2 mg/mL的溶液;吸取1 mL蛋白溶液,顺序加入4.0 mL Tris-甘氨酸(Gly)缓冲液Ⅰ和50 μL Ellman’s试剂,混合均匀后于37 ℃恒温培养箱反应15 min;反应后于412 nm波长处测其吸光度。表面巯基含量按下式计算。
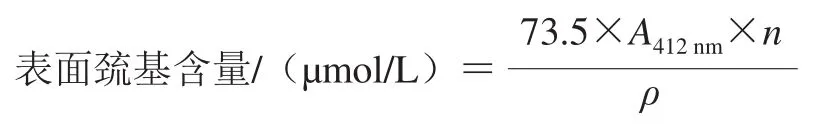
式中:A412nm为样品在412 nm波长处的吸光度;n为稀释倍数;ρ为样品质量浓度/(mg/mL)。
Ellman’s试剂配制:称取0.2 g DTNB,溶于50 mL Tris-Gly缓冲液Ⅰ,4 ℃避光保存。
(六)生化试验 取上述分离菌血清肉汤培养物,分别接种于蔗糖、山梨醇、葡萄糖、甘露糖、乳糖、马尿酸钠及淀粉培养基,37℃培养24 h后,观察其对糖的利用情况,全部重复三次,并记录结果见表1。
1.3.3 表面疏水性的测定
采用8-苯胺基-1-萘磺酸(8-a n i l i n i o-1-naphthlenesulfonic acid,ANS)荧光探针法[6]测定热处理后MPC70表面疏水性的变化。用0.01 mol/L pH 7.4 PBS将热处理后的蛋白样品稀释为质量浓度分别为0.2、0.4、0.8 mg/mL的溶液,取2 mL蛋白稀释溶液与10 μL 8 mmol/L的ANS溶液混合均匀,测定荧光强度。激发波长为390 nm,发射波长为470 nm。以蛋白质量浓度为横坐标,荧光强度为纵坐标,曲线初始段的斜率为表面疏水性。
1.3.4 圆二色光谱的测定
称取适量MPC70冻干粉,溶于蒸馏水配制成质量浓度为0.2 mg/mL的待测样品溶液。设置圆二色光谱仪扫描范围为远紫外区190~250 nm。以蒸馏水为空白,圆二色谱图谱经过仪器本底消除和溶液空白消除后进行拟合[9]。
1.3.5 MPC70的酶解及体外模拟胃肠消化
取热处理MPC70冻干粉,采用两步法模拟胃肠消化,步骤如下:1)取热处理后样品,调节pH值至2.0,按照酶与底物质量比为1∶50加入胃蛋白酶,于37 ℃恒温振荡器酶解2 h,取样待用;2)取胃蛋白酶酶解2 h样品,调节pH值至7.5,按照酶与底物质量比为1∶50加入胰蛋白酶,于37 ℃恒温振荡酶解2 h,取样待用。
调节MPC70胃消化液和胃肠消化液pH值至7.0后冷冻干燥。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)
非还原型上样缓冲液的配制:量取1 mol/L Tris-HCl(pH 6.8)3 mL,加入25 mL 50%甘油、10 mL 10% SDS及5 mL 1%溴酚蓝,加入去离子水定容至50 mL,振荡至充分溶解;还原型上样缓冲液的配制:量取1 mol/L Tris-HCl(pH=6.8)3 mL,加入25 mL 50%甘油、10 mL SDS固体粉末、5 mL 1%溴酚蓝及2.5 mLβ-巯基乙醇(β-mercaptoethanol,β-ME)后,加入去离子水定容至50 mL,振荡至充分溶解。
称取冻干后样品,用去离子水配制成质量浓度40 μg/μL的溶液,振荡使其充分溶解,加入上样缓冲液将样品稀释至4 μg/μL,振荡使其充分混合后于100 ℃水浴锅内加热5 min,取出冷却至室温。分离胶质量分数为12.5%,堆积胶质量分数为5%。胶孔中加入5 μL样品,使蛋白上样量为20 μg,调节电压为90 V,待Marker条带分开,调节电压为110 V。电泳结束后加入考马斯亮蓝染色2~4 h,加入脱色剂脱色12 h。
1.4 数据处理
结果以平均值±标准差表示。采用SPSS 17.0软件进行统计分析,多组数据间进行显著性分析时,使用单因素方差分析(One Way ANOVA)伴随Duncan’s多重比较,当P<0.05时认为具有显著性差异。
2 结果与分析
2.1 热处理对MPC70蛋白组成的影响
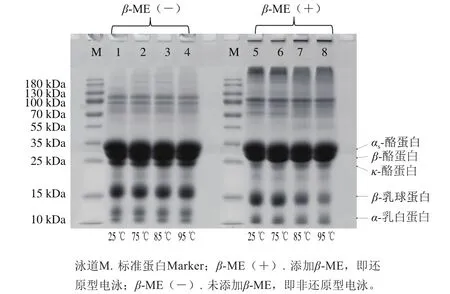
图1 MPC70经不同热处理后的SDS-PAGE图谱Fig. 1 Analysis of SDS-PAGE of MPC70 after different heat treatments
由图1可知,各样品主要包含αs-酪蛋白、β-酪蛋白、κ-酪蛋白、β-乳球蛋白和α-乳白蛋白5 个条带。泳道1~4为非还原型电泳,如泳道1~4所示,经过热处理后,乳清蛋白的变化较明显。与25 ℃热处理样品相比,随着热处理温度的升高,β-乳球蛋白条带逐渐变浅,当热处理温度达到95 ℃时,其条带最浅。当热处理温度达到85 ℃时,α-乳白蛋白条带明显变浅。而热处理后的酪蛋白条带几乎没有明显变化,表明酪蛋白的含量并未降低,这与酪蛋白的热稳定性有关。还原型电泳是在上样缓冲液中加入β-ME,其作为强还原剂能够断开半胱氨酸残基之间的二硫键[10]。通过比较还原型电泳和非还原型电泳泳道可知,非还原型电泳(泳道1~4)胶孔出现聚集物,而还原型电泳(泳道5~8)聚集物消失,即经过热处理后减少的乳清蛋白形成了聚合物。同时,添加β-ME后聚合物消失,表明乳清蛋白聚合物之间通过二硫键结合而成。研究发现,乳清蛋白对热不稳定,在加热过程中会与酪蛋白发生聚合[11]。在加热条件下,β-乳球蛋白也会发生变性聚合,温度升高会引起变性程度更大的聚合物形成[12]。到达85 ℃时,α-乳白蛋白也会发生变性,与β-乳球蛋白聚合物形成复合体[13-14]。
2.2 热处理对MPC70表面巯基含量的影响
由图2可知,样品经过75 ℃热处理15 min后,其表面巯基含量与25 ℃处理组相比没有显著变化。与25 ℃处理样品相比,当热处理温度达到85、95 ℃时,MPC70的表面巯基含量显著升高。巯基是蛋白质分子中重要的功能性基团,通过形成二硫键维持蛋白质高级结构的稳定,从而影响蛋白质的功能特性[15]。乳蛋白中巯基基本位于β-乳球蛋白上,当温度高于85 ℃时,β-乳球蛋白会发生热变性,暴露出内部隐藏的巯基,从而导致表面巯基含量增加[16]。
2.3 热处理对MPC70表面疏水性的影响
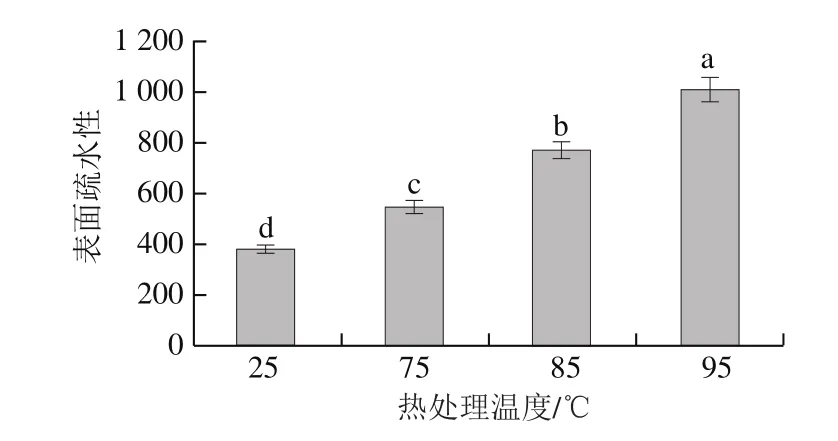
图3 不同热处理对MPC70表面疏水性的影响Fig. 3 Effects of different heat treatments on the surface hydrophobicity of MPC70
由图3可知,MPC70经过热处理后其表面疏水性显著上升,当热处理温度达到95 ℃时,表面疏水性最高。疏水相互作用在维持蛋白质结构中起着主要作用,对蛋白质氢键和静电引力有促进作用。一定程度的热处理会使蛋白质的多肽链展开,暴露出活性基团,从而使蛋白质的表面疏水性上升。活性基团的暴露也会使蛋白质的酶切位点暴露,引起消化性的升高[6]。
2.4 热处理对MPC70二级结构的影响
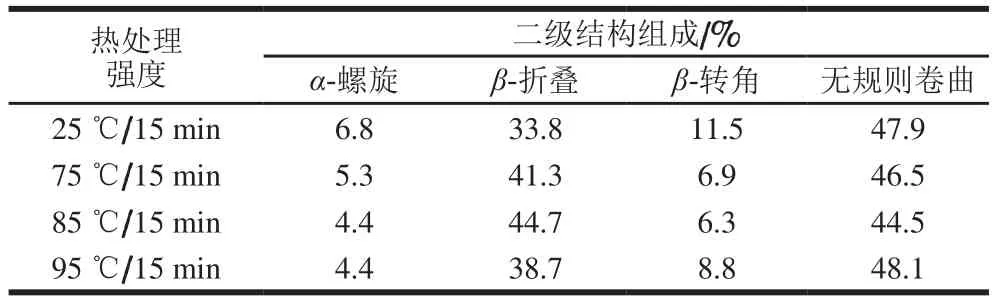
表1 热处理强度对MPC70二级结构组成的影响Table 1 Effects of heat treatment on the secondary structure of MPC70
由表1可知,MPC70经过热处理后,α-螺旋含量降低,经过95 ℃处理15 min后,其含量显著降低至4.4%。随着热处理温度的升高,β-折叠含量呈现先增多后减少的趋势,而β-转角含量呈现先减少后增多的趋势。无规则卷曲呈现先减少后增多的趋势,且95 ℃处理15 min的样品无规则卷曲含量多于对照组。
热处理过程中,乳蛋白发生变性,存在于蛋白质折叠区的β-折叠含量升高,当温度继续上升时,α-乳白蛋白发生变性,与β-乳球蛋白聚集,导致β-折叠含量减少[17]。二级结构的改变是由于蛋白质分子外部环境的变化,且这种改变并不是产生新的二级结构,而是已存在的结构发生构象改变和折叠[18]。无规则卷曲含量增多表明热处理引起的乳蛋白二级结构改变使乳蛋白结构的随机性增强,有序结构逐渐向无规则卷曲结构转化[19]。
2.5 热处理对MPC70消化性的影响
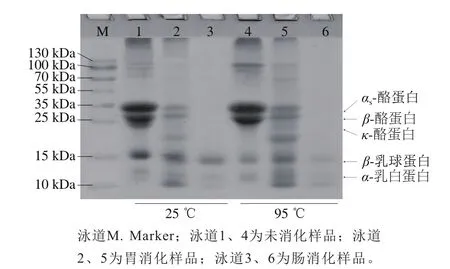
图4 热处理MPC70体外模拟消化过程SDS-PAGE图谱Fig. 4 Analysis of SDS-PAGE of digested MPC70 after being heated at 25 and 95℃
由图4可知:胃消化后总蛋白含量明显减少(泳道2、5),25 ℃处理组的酪蛋白条带比95 ℃处理组样品浅,表明95 ℃处理样品的酪蛋白在胃消化中消化程度降低;胃消化后β-乳球蛋白和α-乳白蛋白条带颜色较深,这表明在此阶段乳清蛋白消化程度不高。经过肠消化后(泳道3、6),25 ℃与95 ℃处理样品酪蛋白条带消失,表明酪蛋白消化程度较高;同时,95 ℃处理样品经过肠消化后,其乳清蛋白条带比25 ℃处理样品浅,表明经过95 ℃处理提高了乳清蛋白的消化率。何光华等[20]发现,随着热处理温度的升高,乳清蛋白的消化速率显著升高,表明热处理提高了乳清蛋白的消化率。Florence等[21]发现,未加热脱脂乳中的酪蛋白和β-乳球蛋白对胃消化有较高的抗性,而加热后β-乳球蛋白对胃消化较敏感。黄俊等[22]将乳清蛋白分别在75、100 ℃湿热处理后模拟体外消化,发现100 ℃加热后乳清蛋白的消化率升高。这可能是由于一定程度的热处理能够使蛋白质分子结构松散,促使分子内部的侧链活性基团暴露出来,因此更易被蛋白酶水解。
3 结 论
热处理改变了MPC70中乳蛋白的表面巯基含量和表面疏水性。在热处理过程中,当处理温度高于75 ℃时,乳蛋白的表面巯基含量显著升高,在95 ℃时达到最高值42.4 μmol/L。表面疏水性也随着热处理温度的升高而升高,同样在95 ℃时达到最高值。热处理改变了MPC70中乳蛋白的二级结构。MPC70经过热处理后,α-螺旋含量降低,β-折叠含量呈现先上升后下降的趋势,而β-转角含量呈现先下降后上升的趋势,无规则卷曲含量呈现先下降后上升的趋势,且在95 ℃时高于对照组。热处理明显改变了MPC70中乳蛋白的消化性,经过95 ℃热处理的乳蛋白在胃消化过程中消化性降低,但肠消化后蛋白条带明显变浅,消化性升高,这与其结构变化相关。
