自主跑轮运动调控MMP-2/TIMP-2稳态平衡改善去卵巢大鼠心脏重塑
2019-07-24秦永生王大宁
任 磊,苗 杰,秦永生,王大宁,彭 朋
绝经前女性患心血管疾病的风险明显低于同龄男性,然而女性的性别优势在绝经后逐渐减退[1],提示性激素对心肌代谢具有重要调节作用。除雌激素减少外,女性绝经后体重增加、肥胖等危险因素同样增加心血管疾病发病率[2]。动物实验及人体研究均证实[3],雌激素减少甚至缺乏(绝经)可诱导心脏发生病理性重塑,心血管发病率(如急性心肌梗塞、心力衰竭)明显升高。
心肌细胞外基质(extracellular matrix,ECM)在心脏生长发育、结构重塑以及功能稳态中起关键作用[4]。心肌ECM主要成分是胶原(I型和III型),后者由成纤维细胞产生。胶原合成与降解的动态平衡对于维持心脏正常结构与功能具有重要调节效应。心脏处于病理状态下(如高血压、心肌梗塞等),心脏发生重塑,表现为心肌胶原过度沉积甚至发生心肌纤维化、心脏肥大、心肌细胞凋亡,导致心脏结构和功能异常甚至引起心力衰竭[4]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一类锌依赖性蛋白水解酶家族,其中MMP-2是最重要的一种MMPs,在大多数细胞内呈组成性表达,其作用是降解变性胶原及其他ECM蛋白[5]。此外,MMPs还受其天然抑制剂——组织金属蛋白酶抑制物(tissue inhibitors of metalloproteinases,TIMPs)的负反馈性调节,以防止ECM被过度降解[6]。因此,MMPs与TIMPs间的稳态平衡是心脏重塑的决定性因素。
规律运动是预防和治疗心血管疾病的重要非药物手段,具有经济、安全、方便、副作用小、疗效显著等突出特点[7]。针对多种心血管疾病患者/动物模型的研究均显示,有氧运动能够诱导心血管系统产生良性适应,包括血压下降、心肌细胞再生、心肌纤维化和心脏肥大减轻,从而抑制病理性心脏重塑[8]。PóSA等[9]的研究发现,有氧运动联合热量限制能够显著降低去卵巢大鼠心血管危险因素水平。业已证实,雌激素缺乏诱导MMP-2活性下调以及MMPs/TIMPs系统稳态失衡是心肌重塑的重要原因[3],而氧化应激介导的翻译后修饰可激活MMP-2[10-11]。由于运动对ECM代谢以及氧化应激均具有调节作用,因此推测规律体力活动能够抑制雌激素缺乏诱导的病理性心脏重塑,其机制可能与调控MMP-2/TIMP-2稳态平衡有关。本研究旨在观察8周自主跑轮运动对去卵巢大鼠心脏重塑的影响并探讨MMP-2和TIMP-2在其间的作用机制,为绝经后女性心血管疾病的康复治疗提供科学依据和有效方法。
1 研究对象与方法
1.1 实验动物与分组
60只8周龄雌性SPF级Wistar大鼠,购自中国人民解放军军事医学科学院实验动物中心。动物分笼饲养,12/12 h明暗交替,温度20~24℃,湿度50%~60%,自由进食水。
动物适应环境1周后依照随机数字表法分为假手术组(n=30)和去卵巢组(n=30),去卵巢组大鼠行卵巢摘除术,方法为[12-13]:腹腔注射0.3%戊巴比妥钠(0.1 mg/kg)麻醉动物,俯卧位备皮,沿背部后正中线做1.0~1.5 cm纵型切口,暴露棕黄色卵巢组织,沿子宫角处结扎并切除卵巢,逐层缝合伤口。假手术组仅切除卵巢周围脂肪,其他步骤同上。术后给予青霉素(0.2 mL,20 000 IU)肌注以预防感染。4周后将假手术组随机分为假手术安静组(sham control group,SC)和假手术运动组(sham exercise group,SE),去卵巢组分为去卵巢安静组(ovariectomized group,OV)和去卵巢运动组(ovariectomized exercise group,OVE),每组n=15。随后SC和OV组动物在鼠笼内安静饲养,SE和OVE组进行8周自主跑轮运动,即鼠笼内安装有一直径为26 cm、宽8 cm并能够自由转动的钢质跑轮,动物可自由进行转轮运动,不控制运动强度和时间[14-15]。干预周期选择8周参照文献报道[16],即诱导心血管系统产生良性变化的最短时间。
实验过程中由于造模失败、意外死亡等原因,共剔除5只动物,最终样本量n=55,分别为SC组n=15、SE组n=15、OV组n=13、OVE组n=12。
1.2 心脏结构与功能测定
末次实验后48 h称量体质量,随后腹腔注射0.3%戊巴比妥钠(0.1 mg/kg)麻醉动物并取仰卧位固定,胸部备皮,用高分辨率小动物超声影像系统(Vevo 3100,加拿大VisualSonics公司)检测心脏结构和功能,取左心室乳头肌水平进行二维短轴扫描(M超)。检测指标包括:左心室舒张末期直径(left ventricular end-diastolic diameter LVEDD)、左心室收缩末期直径(left ventricular end-systolic diameter,LVESD)、左心室壁厚度(left ventricular wall thickness,LVWT)和左心室射血分数(left ventricular ejection fraction,LVEF)。
1.3 大鼠取材
超声检测后每组取4只动物利用Langendorff灌流装置建立离体心脏缺血/再灌注模型(见1.8)。其余大鼠处死后取出心脏并称重(心脏质量),分离左心室并称重(左心室质量),分别计算与体质量的比值作为心脏质量指数(heart mass index,HMI)和左心室质量指数(left ventricular mass index,LVMI)。在左心室最大横径处横切将其分为两部分,一部分利用Masson染色进行组织病理学观察,另一部分投入液氮中并迅速转入-80℃低温冰箱冻存待测。
1.4 心肌病理组织学观察
将心肌组织用10%甲醛溶液固定,经脱水、透明、包埋和切片(5 μm)后利用Masson染色制作组织切片,每张切片随机选取5个视野,用图像分析软件(Image Pro Plus 6.0,美国Media Cybernetics公司)测量胶原面积,用胶原面积与所测视野面积的比值作为胶原容积分数(collagen volume fraction,CVF)以表示心肌纤维化程度。
1.5 心肌MMP-2和TIMP-2蛋白表达量检测
利用Western Blot法检测蛋白表达量。心肌组织匀浆后,提取总蛋白,用BCA法测定蛋白浓度。取100 μg蛋白经7.5%SDS-PAGE分离后转移至PVDF膜。64 kDa MMP-2、72 kDa MMP-2和TIMP-2一抗4℃静置过夜,二抗37℃孵育2 h,充分洗涤后,使用ECL发光成像,利用凝胶成像系统(ChemiDoc XRS,美国BIO-RAD公司)拍摄并扫描各条带灰度值。将每个条带与相应样品的β-actin条带灰度值进行比较,以各组与SC组的比值作为蛋白相对表达量。
1.6 心肌谷胱甘肽(glutathione,GSH)含量检测
心肌组织匀浆后(匀浆液成分:0.25 M蔗糖、20 mM Tris、1 mM二硫苏糖醇),4℃、15 000 g离心30 min,取上清并加入0.1 M CaCl2、0.25 M蔗糖、20 mM Tris和1 mM二硫苏糖醇后孵育30 min,20 000 g离心60 min,取上清按照GSH试剂盒(武汉博士德生物工程有限公司)操作说明,利用紫外分光光度计(U-3010,日本日立公司)以比色法于420 nm波长处测定OD值,根据标准品计算心肌GSH含量(单位:mmol/mg蛋白)。
1.7 心肌I型胶原(type I collagen,Col-I)和3-硝基酪氨酸(3-nitrotyrosine,3-NT)含量检测
取适量心肌组织于磷酸盐缓冲液(pH 7.4)中匀浆,4℃、3 000 g离心20 min,按照相应试剂盒(武汉博士德生物工程有限公司)说明进行操作,利用利用紫外分光光度计(U-3010,日本日立公司)以比色法于450 nm波长处测定OD值,参照标准品计算心肌Col-I(单位为:pg/mg蛋白)和3-NT含量(单位为:pmol/mg蛋白)。
1.8 大鼠离体缺血-再灌注模型制备与心肌梗死面积检测
按10 ml/kg腹腔注射0.3%戊巴比妥钠麻醉大鼠,仰卧固定,开胸后将心脏置于持续通入95%O2和5%CO2混合气体的4℃预冷的肝素化K-H液中,将主动脉连接至Langendorff离体心脏灌流系统(南京美易科技有限公司)末端,灌流条件保持37℃恒温、75 mmHg恒压。心脏灌流平衡10 min后,停止氧供和灌注液,使心脏缺血30 min后再灌注60 min。
灌流完成后收集心脏标本置于-80℃低温冰箱冻存20 min后取出,迅速沿心尖部至心底部横切取1~2 mm厚度心肌组织,置于10%甲醛溶液固定并利用Masson染色制作病理切片,方法同1.4。每张切片随机选取5个视野,用图像分析软件(Image Pro Plus 6.0,美国Media Cybernetics公司)检测心肌梗死面积,根据以下公式计算心肌梗死面积百分比:心肌梗死面积百分比=心肌梗死面积÷所测视野心肌总面积×100%。
1.9 统计学分析
使用SPSS20.0统计软件进行数据分析处理。所有数据以“均数±标准差”表示,组间比较使用单因素方差分析,多重比较使用LSD检验。显著性水平定为P<0.05。
2 结果
2.1 体质量与心脏质量的变化
与SC组比较,OV和OVE组体质量增加(P<0.05),SE组、OV组和OVE组心脏和左心室质量、HMI和LVMI均升高(P<0.05);与OV组比较,OVE组体质量和心脏质量下降(P<0.05),HMI、左心室质量以及LVMI无显著性差异(P>0.05)(见表1)。

表1 体质量与心脏质量的变化Table 1 Body Mass and Cardiac Mass
2.2 心脏结构与功能的变化
与SC组比较,SE组LVEDD、LVWT升高(P<0.05),OV组LVWT升高(P<0.05),LVEDD和LVEF下降(P<0.05),OVE组LVWT升高(P<0.05),LVEF下降(P<0.05);与OV组比较,OVE组LVEDD和LVEF升高(P<0.05)(见表2)。

表2 心脏结构与功能的变化Table2 Cardiac Structure and Function
2.3 心肌病理组织学观察以及CVF和Col-I含量的变化
心脏组织病理学观察见图1,各组CVF的变化见图2,Col-I含量的变化见图3。结果显示:心肌细胞呈红色,胶原纤维呈蓝色。SC和SE组仅含有极少量胶原纤维;OV和OVE组胶原含量明显增多,CVF和Col-I含量均高于SC组(P<0.05);OVE组较OV组胶原纤维显著减少,CVF和Col-I含量降低(P<0.05)。

图1 心肌病理组织学观察(Masson染色,×400)Figure1 Histopathology of Myocardium(Masson staining,×400)

图2 各组CVF的变化Figure 2 CVF in Each Group

图3 各组Col-I含量的变化Figure 3 Col-I Content in Each Group
2.4 心肌MMP-2和TIMP-2蛋白表达量的变化
72 kDa MMP-2活性在各组均无显著性差异(P>0.05)。与SC组比较,OV组64 kDa MMP-2活性、TIMP-2含量以及64 kDa MMP-2/TIMP-2比值均下降(P<0.05);与OV组比较,OVE组64 kDa MMP-2活性、TIMP-2含量以及64 kDa MMP-2/TIMP-2比值升高(P<0.05)(见图4~6)。

图4 各组MMP-2蛋白表达量的变化Figure4 MMP-2 Protein Expression in Each Group

图5 各组TIMP-2含量的变化Figure5 TIMP-2 Content in Each Group
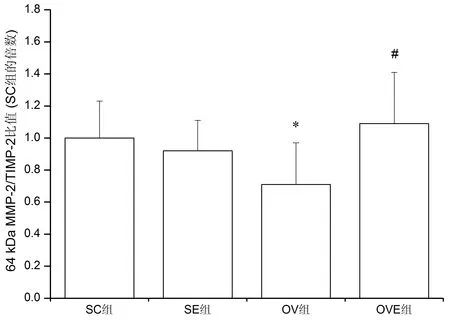
图6 各组64 kDa MMP-2/TIMP-2比值的变化Figure6 64 kDa MMP-2/TIMP-2 Ratio in Each Group
2.5 心肌3-NT和GSH含量的变化
与SC组比较,OV组3-NT和GSH含量均下降(P<0.05);与OV组比较,OVE组GSH含量升高(P<0.05),3-NT含量无显著性变化(P>0.05)(见图7~8)。

图7 各组心肌3-NT含量的变化Figure7 Myocardial 3-NT Content in Each Group

图8 各组心肌GSH含量的变化Figure8 Myocardial GSH Content in Each Group
2.6 离体缺血-再灌注时心肌梗死面积的变化
经Masson染色后,存活心肌被染成红色,梗死心肌呈现蓝绿色(见图9)。与SC组比较,SE组心肌梗死面积百分比下降(P<0.05),OV组心肌梗死面积百分比升高(P<0.05);与OV组比较,OVE组心肌梗死面积百分比下降(P<0.05)(见图10)。
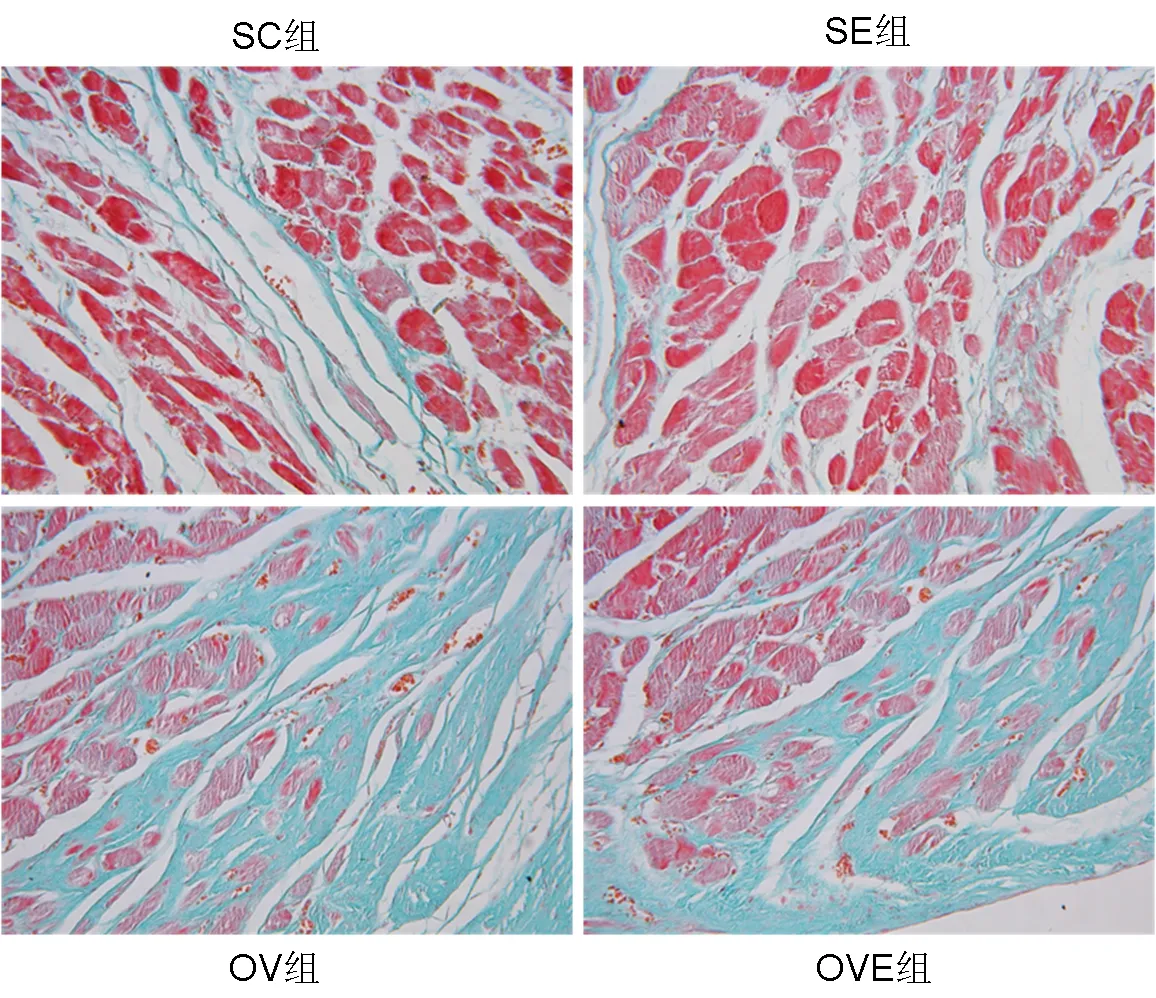
图9 离体缺血-再灌注时心肌梗死区示意图(Masson染色,×400)Figure9 Myocardial Infarct Zone during Isolated Ischemia-Reperfusion(Masson staining,×400)
3 讨 论
3.1 自主跑轮运动抑制去卵巢大鼠心脏重塑

图10 各组心肌梗死面积百分比的变化Figure10 Percentage of Myocardial Infarct Size in Each Group
心肌细胞间质对于维持心脏结构和功能的完整性具有重要意义,心肌间质中的胶原蛋白处于合成-降解动态变化中,当动态平衡被打破时将产生心肌纤维化以及心脏重塑,最终导致心功能障碍[17]。研究显示[3],雌激素及其受体在调节ECM代谢中起重要作用。本研究发现,与SC组比较,OV组大鼠CVF和Col-I含量增加,心脏和左心室质量以及HMI和LVMI升高,超声心动图显示LVWT升高、LVEDD和LVEF下降,提示雌激素缺乏造成ECM代谢紊乱、心肌发生病理性肥大(向心性肥大)以及纤维化、心功能下降。心肌纤维化和心脏肥大导致心肌缺血缺氧、心脏硬度增加、心室壁顺应性下降,进而影响心脏舒缩功能,此外还可增加心肌电异质性,易引发心律失常,是心血管疾病患者心源性猝死的重要原因[17]。由于雌激素缺乏可导致自主神经功能紊乱[18]、NO生物利用度下降[19]、细胞凋亡通路激活[20]以及心脏舒缩功能异常[21],因此去卵巢大鼠发生缺血性损伤(例如心肌梗塞)后心脏重塑进程明显加快[22],更易发生心力衰竭。在本研究中,OV组离体缺血-再灌注时心肌梗死面积百分比较SC组明显增加,提示去卵巢大鼠心脏对缺血-再灌注损伤应激的耐受能力减弱。
调控ECM稳态是治疗多种心血管疾病的重要策略,运动训练是防治心血管疾病的重要非药物手段。在本研究中,8周运动后,OVE组CVF和Col-I含量较OV组下降,这与ALMEIDA等[23]、JITMANA等[24]、HUANG等[20]和MARQUES等[25]分别以8、9、10、13周跑台运动以及FELIX等[26]以10周游泳训练为模型的研究结果一致,提示长期规律体力活动(不论何种运动方式)能够减轻去卵巢大鼠心肌胶原沉积。胶原减少有助于心动周期过程中心肌收缩力分布恢复正常并提高心壁顺应性[27],进而提升心脏舒缩功能。CHOI等[28]的研究进一步发现,长期(12周)有氧运动能够减少心肌胶原交联。总之,运动对胶原含量、结构(即空间排列)以及相互作用均具有有益作用,对雌激素缺乏诱导的心肌纤维化起抑制甚至逆转作用。然而BENITO等[29]发现,健康大鼠进行18周大强度运动后心肌发生纤维化,SCHULTZ等[30]等证实,心力衰竭大鼠进行16个月自主跑轮运动后,心肌胶原沉积增加,提示过量运动可诱导或者进一步加重心肌重塑,即体力活动的心脏健康效应存在“负荷阈值”,超出这一阈值则造成适应不良[31-32]。
值得注意的是,本研究OVE组左心室质量、HMI以及LVMI与OV组并无显著性差异,似乎说明去卵巢大鼠心脏肥大并未改善。然而超声心动图显示,OVE组心腔内径(LVEDD)较OV组升高,左心室形态上显示“离心性肥大”,同时由于心功能改善,说明运动诱导心脏发生生理性肥大。然而LIAO等[33]和ROSSONI等[34]的报道证实,衰老大鼠分别进行13周和18周游泳运动后心脏肥大减轻(心脏质量和室壁厚度下降),但对心肌细胞体积无明显影响,因此认为是ECM减少造成的(心脏质量或室壁厚度增加是心肌细胞体积增大和ECM增多共同作用所致)。研究结果不一致可能与动物模型、运动方式、运动负荷以及干预时间等因素有关。本研究结果与施曼莉等[35]等让心肌梗塞后心力衰竭大鼠进行10周跑台运动以及GARCIARENA等[36]让自发性高血压大鼠进行8周游泳运动的报道一致。针对游泳、长跑等耐力项目运动员的调查同样显示[37],长期有氧运动可引起心室壁增厚、心腔扩大并伴随心功能提高,其机制与运动时心脏前负荷(容量负荷,即回心血量)增加造成肌节串联性增生有关[38]。由此推测,运动诱导的生理性心脏肥大与病理性肥大在去卵巢大鼠运动康复过程中同时存在并相互影响,最终前者的良性作用逆转了后者的负面效应,表现为心脏由病理性肥大向生理性肥大转变,同时心功能增强。此外本研究还发现,OVE组离体缺血-再灌注时梗死面积百分比较OV组显著降低。研究指出,胶原沉积在心肌梗塞后心脏重塑中起促进作用[39],而心肌胶原含量下降则可抑制去卵巢大鼠心肌梗塞后心脏重塑进程[23]。结合本研究结果我们认为,运动通过抑制去卵巢大鼠心肌纤维化不仅提高心脏安静状态下的舒缩功能,还可增强心脏对缺血-再灌注损伤应激的耐受性
3.2 自主跑轮运动激活MMP-2信号途径并改善MMP-2/TIMP-2稳态平衡
心肌纤维化以及心脏重塑是多种因素相互作用的结果,其分子机制涉及ECM代谢中的多个信号转导通路,其中MMP-2活性下降以及MMP-2/TIMP-2稳态失衡是最重要的原因[3]。MMP-2合成初始是以无活性的酶原(即无活性前体物质)形式存在(即72 kDa MMP-2),随后通过翻译后调控而活化(即64 kDa MMP-2,其蛋白表达量可代表MMP-2活性)[40];TIMP-2是MMP-2的天然抑制物,可与MMP-2形成稳定复合物,阻碍酶原活化或抑制已活化的酶活性。在本研究中,OV组72 kDa MMP-2表达量在各组均无显著性变化,说明雌激素下降对MMP-2酶原并无影响,但64 kDa MMP-2蛋白表达下调,提示MMP-2活性受到抑制,这与黄伟等[41]针对衰老大鼠的研究结果一致。然而心肌梗塞造成的心力衰竭大鼠心肌MMP-2表达上调,这可能是动物造模初期的代偿性反应,或者MMP-2升高参与了心梗后瘢痕的形成过程[42]。研究结果存在差异甚至相互矛盾说明不同原因、疾病不同阶段造成的心肌纤维化拥有截然不同的调控机制。OV组TIMP-2表达量与64 kDa MMP-2同步下降,似乎说明MMP-2活性以及对TIMP-2的抑制作用均减弱。YANG等[43]的研究指出,胶原代谢平衡最终由MMPs/TIMPs比值决定。本研究中64 kDa MMP-2/TIMP-2比值在OV组降低,说明MMP-2活性被TIMP-2抑制,降解胶原的能力下降,最终引起胶原沉积直至心肌纤维化。经过8周自主跑轮运动后,与OV组比较,OVE组64 kDa MMP-2和TIMP-2蛋白表达量均显著性升高,这与KWAK等[44]以衰老大鼠为研究对象的研究结果一致,即12周中等强度跑台运动可延缓增龄诱导的MMP-2活性下调。更为重要的是,OVE组64 kDa MMP-2/TIMP-2比值较OV组升高,且与SC组无显著性差异,提示TIMP-2对MMP-2的抑制作用得到解除。在甄洁[45]等的研究中,心力衰竭大鼠10周有氧运动后虽然TIMP-1和MMP-1蛋白表达量均下调,但MMP-1/TIMP-1比值增加,与本研究结果类似。总之,MMP-2/TIMP-2稳态平衡改善是自主跑轮运动抑制去卵巢大鼠心脏重塑的重要机制。
MMP-2可通过蛋白水解和非蛋白水解2条翻译后调节途径激活[11]。蛋白水解途径中,72 kDa MMP-2酶原序列中抑制性前肽被切除后释放具有酶活性的64 kDa MMP-2,非蛋白水解途径即在GSH协助下由过氧亚硝酸盐(ONOO-)对MMP-2酶原进行硝基化修饰而活化[10]。GSH是细胞内的非酶抗氧化剂,其含量减少可作为氧化应激的生物标记。ONOO-是超氧阴离子与一氧化氮(nitric oxide,NO)(活性氮的一种)的反应产物,最终代谢为3-NT。3-NT是蛋白硝基化终端产物,病理条件下产生的多种活性氧和活性氮导致机体氧化损伤,同时引起酪氨酸残基发生硝基化而生成3-NT,故3-NT被认为机体氧化应激和蛋白硝基化的重要评估参数。然而在本研究中,OV组GSH和3-NT含量均下降,MMP-2基因翻译后修饰作用减弱,MMP-2活性随之下调。3-NT含量降低可能与NO合成与利用减少有关。研究显示[2-3],绝经后女性患心血管疾病的风险增加,包括心肌梗塞、高血压等,其机制之一与氧化应激增强以及NO生物利用率降低有关。8周自主跑轮运动后,OVE组GSH含量增加,MMP-2活性上调,但3-NT并无显著性变化。运动既可上调NO水平,同时又能够下调自由基含量[23],故两者(NO+超氧阴离子)反应产物ONOO-最终代谢为3-NT的含量在本研究OVE组与OV组之间并无显著性变化。由于MMP-2非蛋白水解活化途径需要GSH和ONOO-同时参与,因此即使ONOO-含量并未增加,GSH的升高依然能够促进细胞内残存的ONOO-对蛋白质进行硝基化修饰,进而激活MMP-2[46-47]。由此可见,运动通过激活MMP-2信号途径并维持MMP-2/TIMP-2稳态平衡进而对去卵巢大鼠心肌产生保护效应。
4 结论
绝经期妇女心血管疾病发生率明显增加,本研究以去卵巢大鼠为动物模型发现,雌激素缺乏诱导心脏重塑,表现为心肌纤维化、病理性心脏肥大、心功能下降,缺血-再灌注损伤加重,其机制与MMP-2/TIMP-2稳态失衡造成胶原代谢紊乱有关;而长期规律运动可能通过激活MMP-2信号途径并改善MMP-2/TIMP-2稳态平衡抑制去卵巢大鼠心脏重塑(即心肌纤维化减轻,病理性心脏肥大向生理性肥大转变,心功能提升)并增强心脏对缺血-再灌注损伤的耐受能力。因此,运动疗法是防治绝经期女性心血管疾病的重要康复手段。
