土传病原真菌及其生防细菌的分离鉴定
2019-07-19李双明
苏 静,李双明
(1.甘肃农业大学 植物保护学院,甘肃 兰州 730070; 2.解放军联勤保障部队第九四○医院病理科,甘肃 兰州 730050)
土壤既是土传病原真菌的源,同时也是生防微生物的源。科学研究工作者经常从发病植株的根际筛选生防微生物。德国微生物学家Lorenz Hiltner于1904年首次提出根际的概念为根系周围、受根系生长影响的土体[1,5]。根际作为根系、土壤界面的一个微环境,是土壤-根系-微生物三者紧密结合、相互影响的场所[5-6]。植物根际土壤中存在丰富多样的细菌,放线菌和真菌菌株,包括具有丰富的生防功能的菌株。生防微生物通过与病原微生物的竞争、拮抗、抗生和重寄生等达到抑制或消灭病原微生物,通过诱导寄主植物抗病性、分泌植物生长激素和溶磷解钾固氮等促进植物生长[7]。有关植物病害生防细菌资源的研究和应用已成为病害生防领域的热点,在“两减”的大背景下具有广阔的前景。
草坪球场和农田系统类似,都容易产生连作障碍,持续受到土传病害的侵染,从而降低其生产力。将分离自甘肃农业大学草坪实训基地的土传真菌,通过离体叶片和皿内幼苗接种土传真菌分离物测定其致病性,利用形态学鉴定方法确定其分类地位;在此基础上,通过平板稀释法分离根际微生物,利用皿内拮抗试验筛选拮抗细菌,结合形态学和分子鉴定方法确定拮抗菌的分类地位。旨在明确甘肃农业大学草坪实训基地的土传病原真菌种类,并筛选相应的生防细菌,为科学管理实训基地提供理论基础,并为生防细菌资源进一步开发利用奠定基础。
1 材料和方法
1.1 区域概况
试验地处于甘肃省兰州市安宁区甘肃农业大学草坪实训基地。地理坐标为N 36°9′,E 103°7′,海拔1 531 m,气压84 KPa。温带大陆性气候,年均气温10.3 ℃。年均日照时数2 446 h,无霜期180 d,年平均降水量327 mm。实训基地内草坪草主要为高羊茅(Festucaelata)和黑麦草(Loliumperenne)混播,还有紫羊茅(Festucarubra)和翦股颖(Agrostismatsumurae)等。
1.2 土壤采样
试验以甘肃农业大学草坪实训基地土壤为研究对象,随机设置5个3 m×3 m的样地,在样地内采用5点取样法,用直径为5 cm的土钻钻取0~20 cm的土壤,将土壤均匀混合后装入无菌聚乙烯自封袋,转至冰盒保存并带回试验室于当天分离培养土壤微生物。
1.3 土壤微生物的分离与形态学鉴定
称取10 g含根土样,置于盛有90 mL无菌水的(加玻璃珠)三角瓶中,在摇床上以150 r/min振荡15 min后制成10-2悬液后备用。
采用平板涂抹法涂布于马铃薯葡萄糖琼脂培养基(PDA:马铃薯200g,葡萄糖20g,琼脂18 g,蒸馏水1 000 mL),每皿200 μL悬液进行真菌的分离,3个重复,接种后置25±1℃恒温箱培养5 d,对分离菌株进行统计、编号、纯化保存。将纯化菌株接种于PDA平板上,每隔24 h观察菌落形态和颜色;并制作玻片置生物显微镜下观察其产孢结构及分生孢子形态等,并进行鉴定[8-11]。
采用平板涂抹法涂布于营养琼脂培养基(NA:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15~20 g,水1 000 mL),每皿200 μL悬液进行细菌的分离,3个重复,转置28±1℃恒温箱培养3 d后,对分离菌株进行统计、编号、纯化保存。以备土传病原真菌的拮抗试验和细菌分离物的鉴定,将纯化菌株划线接种于NA平板上,24 h后观察记录菌落形态、大小、光泽、质地及培养基的颜色等特征[12]。
1.4 真菌分离物的致病性测定
(1)离体植物组织接种法[13]:采集健康的黑麦草的茎基部(长3 cm),转至培养皿(9 cm)造伤口接种土壤真菌分离物的分生孢子悬浮液(空白对照接种无菌水),于25±1℃光照培养箱内黑暗保湿培养48 h后正常12 h光暗交替培养,3个重复,3 d后观察记录离体叶片侵染症状。(2)皿内发芽接种法[14]:将分离物在PDA培养基上培养5 d后打成直径5 mm的菌饼转置皿内发芽后的健康无病的黑麦草(每皿10株)幼苗,以接种5 mm PDA培养基饼为对照,3次重复,连续观察记录皿内苗的发病情况。
新闻发布会由滕州市委宣传部副部长魏峰主持。在新闻发布会上,滕州市农业系统党委书记、农业局局长李广耀介绍了滕州马铃薯产业融合发展和节会有关情况。
1.5 拮抗菌株的筛选
采用平板对峙培养法将病原真菌置于PDA培养基上活化培养5 d,后打成直径为5 mm的菌饼,接种在PDA培养基中央,土壤根际细菌分离物纯培养物经24 h活化培养后点接在距菌饼2.5 cm处,每平板4点,以点接无菌水为对照,25℃培养,3次重复,待对照病原真菌长满培养皿后,测量处理菌落直径(cm),以抑菌率表示细菌的抑菌能力[15]。
抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.6 拮抗菌株的16S rDNA基因鉴定
细菌DNA提取:细菌活化后在NB培养液中28℃振荡过夜培养,使用天根生化科技(北京)有限公司TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒(离心柱型,目录号,DP302),进行细菌DNA的提取,方法参照试剂盒说明书。
细菌基因扩增[16]:使用27 F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1492 R(5′-CTACGGCTACCTTGTTACGA-3′)为引物(武汉金开瑞生物工程有限公司合成),扩增菌株的16S rDNA。PCR体系建立(50 μL):PremixTaq25 μL,1492R 1 μL,27F 1 μL,DNA 1 μL,补ddH2O至50 μL。PCR反应程序:95℃预变性3 min;94℃变性30 s,52℃退火30 s,72℃延伸1 min,33个循环;72℃终延伸5 min。将PCR扩增产物送至武汉金开瑞生物工程有限公司进行检测。将测得的DNA序列提交GenBank数据库取得序列号。
1.7 系统发育树构建
将测序后获得的细菌的DNA序列分别提交到NCBI网站中的Blast进行序列比对,并根据NCBI数据库中下载的序列信息,利用 MEGA(6.0)软件进行多重序列比较,并采用Neighbor-Joining法构建16S rDNA系统发育树。
2 结果
2.1 土传真菌多样性及其致病性
从草坪实训基地的土壤中分离得到18株真菌分离物,按照菌落形态特征将其归类为5种真菌分离物并编号为GSAF1、2、3、4和5(表1,图1)。根据真菌的形态学特征(图2),初步将GSAF1,4和5分别鉴定为链格孢属(Alternariasp.)、立枯丝核菌(Rhizotoniasolani)和镰孢菌属(Fusariumsp.),GSAF2和3暂时未明,有待分子鉴定方法进行分析。通过离体叶片和皿内发芽致病性测定试验,接种孢子悬浮液和菌饼7 d后土传真菌GSAF1,4和5对黑麦草的离体茎基部和皿内幼苗表现出了侵染症状,表明这3种土传真菌在室内具有一定的致病性(表1)。
2.2 根际土壤细菌分离及拮抗菌筛选
从土壤中分离得到12株细菌分离物,编号为ZSR20-ZSR32,经平板对峙拮抗筛选结果表明, 3株细菌对链格孢属、立枯丝核菌和镰孢菌属有拮抗效果,其中菌株ZSR30的抑菌能力略高于菌株ZSR32,对3种土传病原真菌的抑菌率均高于30%,对立枯丝核菌的抑菌率达36.2%;ZSR32菌株对3种病原真菌也有一定的抑菌作用;ZSR26对3种土传病原真菌的拮抗抑菌作用较低,抑菌率均小于20%(表2)。其余菌株未见拮抗能力。

表1 草坪实训基地土壤真菌种类及其室内致病性测定
注:+,致病;-,不致病
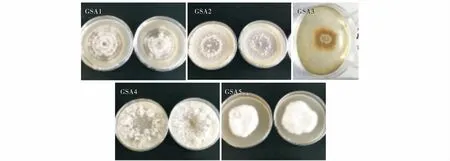
图1 5种土传真菌在马铃薯葡萄糖琼脂培养基的单菌落形态特征Fig.1 The morphology of single colony of 5 soil-borne fungi cultured on potato dextrose agar
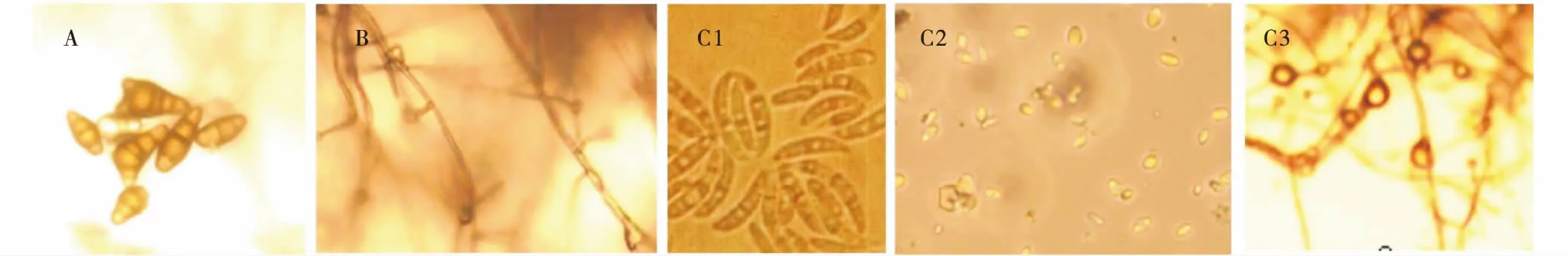
图2 土传真菌细胞形态特征Fig.2 The morphology of soil-borne fungi cell注:A(GSAF1) 链格孢属;B(GSAF4) 立枯丝核菌;C1-C3(GSAF5) 依次为镰刀菌属的大型分生孢子,小型分生孢子和厚垣孢子
具有拮抗能力的3株细菌分离物的形态特征为,ZSR26:G+,菌体杆状,单菌落近圆形,呈柳絮状,稍有凸起,接近白色,稍有光泽,边缘不整齐,有褶皱,半透明,略有粘度,直径3~8 mm(图3A、A1);ZSR30:G+,菌体杆状,单菌落圆形或近圆形,中间凹陷,接近白色,边缘不整齐,有褶皱,稍有光泽,不透明,有粘度,直径8~10 mm(图3B、B1);ZSR32:G+,菌体杆状,单菌落近圆形或圆形,且稍凸起,接近白色,边缘不整齐,有褶皱,半透明,略有粘度,直径4~8 mm(图3C、C1)。
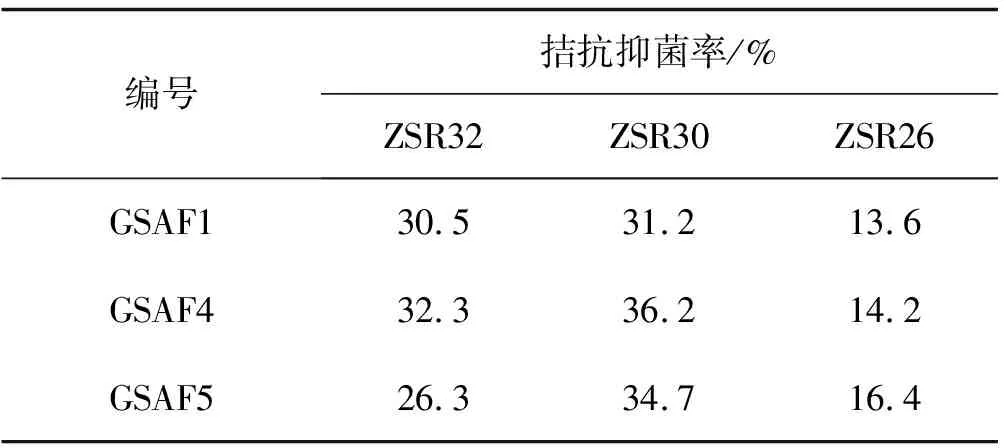
表2 3种细菌分离物对3种土传病原真菌的抑菌效果
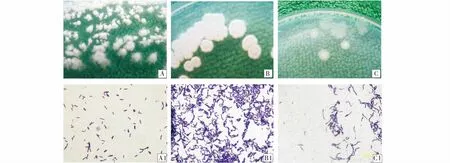
图3 3种根际细菌分离物在营养琼脂培养基的形态特征及革兰氏染色的菌体形态Fig.3 The morphology of single colony of three soil-borne bateria cultured on nutrient agar and their Gram stain
2.3 拮抗细菌的16S rDNA鉴定
成功提取拮抗细菌基因组DNA并扩增出16S rDNA序列(图4)。经16S rDNA序列相似性分析和构建系统发育分析。测定的基因序列分别为,ZSR26(1384 bp),ZSR30(1 412 bp)和ZSR32(1 417 bp)(表3)。
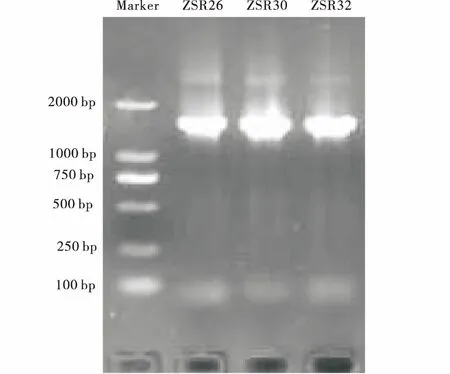
图4 ZSR26,ZSR30和ZSR32菌株PCR产物电泳图Fig.4 Electrophoregram of PCR products of ZSR26,ZSR30 and ZSR32
其序列与GenBank中已报道的序列比较,结果表明:ZSR26的99%相似于内生芽孢杆菌(MH168995.1,GU339236.1和KX783541.1);ZSR30和ZSR32的99%相似于芽孢杆菌属(MF139324.1,JF496436.1,JF496449.1)。鉴于未结合其他鉴定手段,初步将ZSR26,ZSR30和ZSR32菌株均鉴定为芽孢杆菌属Bacillussp.。

表3 细菌分离物ZSR32,ZSR30和ZSR26的16S rDNA序列分析

图5 3株拮抗细菌的系统发育树Fig.5 Phylogenetic trees of 3 antibiotic bacteria
3 讨论
土壤含有丰富的有机物,为其中的真菌、细菌、线虫以及原生动物等提供了基础营养,同时也构成了动态平衡的土壤中的食物网。土壤中某一类微生物的富集,往往容易扰乱系统,打破平衡,从而衍生一系列问题。薛泉宏等[17]报道,在同一田块连续多年种植同一作物会导致该作物产量和品质下降,病虫害加重,连茬作物生产力下降,土壤生物退化。甘肃农业大学草坪实训基地始建于2007年,多年重复利用黑麦草和高羊茅建植的草坪,土壤中存在大量的链格孢属,立枯丝核菌和镰孢属的真菌,其菌在室内对黑麦草离体茎基部和皿内幼苗具有致病性,与其他研究中的3种菌的致病性的报道一致[18-19]。研究中立枯丝核菌和镰孢属可以引起多种作物和牧草的叶斑、茎基腐、根腐等病害,是土传病害的重要病原,同时也是土壤退化的重要指示病原真菌[3]。链格孢属存在于多种生态环境下,可以引起如马铃薯早疫病、番茄早疫病等病害,可存活于土壤中。链格孢属,立枯丝核菌和镰孢属存在于草坪实训基地土壤中,随着种植年限的延长,它们将成为草坪可持续利用的重要限制因子,应因地制宜、生态环保地进行综合管理,提高草坪利用年限。
芽孢杆菌属(Bacillussp.)对各种环境条件具有很强的适应性,广泛地存在于土壤,水和空气中,与自然界中的物质转化、土壤肥力、环境卫生等均密切相关[20]。有的能水解淀粉,分解蛋白质、果胶、藻酸盐等,工业上用于提取淀粉酶、蛋白酶、果胶酶等[20]。有的能分泌IAA、溶解无机磷和有机磷,还可以解钾,同时对多种作物的真菌性病害具有拮抗抑制作用,是重要的生防菌,被广泛的应用于农业生产中,如枯草芽孢杆菌(Bacillussubtilis)和解淀粉芽孢杆菌(B.faciens)[21-22]。试验从实训基地的土壤中分离得到了3株芽孢杆菌属的细菌,且对土传病原真菌具有较好的拮抗作用,为实训基地内因地制宜和生态环保的控制土传病原真菌提供了菌种资源,为进一步开发利用奠定了理论基础。
4 结论
采用平板稀释涂抹法从甘肃农业大学草坪实训基地的土壤中共分离得到18株真菌分离物和12株细菌分离物。室内致病性测定表明真菌分离物GSAF1,4和5具有致病性,经形态学鉴定初步明确它们为链格孢属、立枯丝核菌和镰孢属。采用皿内拮抗法筛选了12株细菌分离物对3种土传病原真菌具有拮抗作用的3株细菌,抑菌率最高为36.2%。结合形态学和16S rDNA分子鉴定方法,初步将ZSR26,30和32均鉴定为芽孢杆菌属。
