高原鼢鼠干扰下高寒草甸无脊椎动物分布与环境因子的关系
2019-07-19叶国辉张飞宇华铣泽花立民
叶国辉,楚 彬,周 睿,张飞宇,华铣泽,花立民
无脊椎动物是陆地生物系统的重要组成部分,通过食物网参与物质循环与能量流动等生态系统过程,在维持陆地生态系统结构和功能方面具有重要调节作用[1-2]。在陆地生态系统中,植被、土壤、气候和地形构成了无脊椎动物群落栖息环境。其中,植被和土壤是两个主要因素[3],植物通过调节输入土壤中有机体的品质和数量影响无脊椎动物食物资源。而土壤作为无脊椎动物生命的承载体,其属性(结构和肥力)变化对土壤无脊椎动物生存和繁殖产生影响。近年来对土壤无脊椎动物研究主要集中在森林生态系统和农田生态系统中,对草地生态系统的研究相对较少[3]。而青藏高原高寒草地生态系统复杂多样,对全球气候变暖响应明显,受气候变化和人为因素等干扰呈退化趋势[4],因此,针对这一敏感生态系统开展无脊椎动物对栖息地环境因子变化响应研究极其必要。
研究表明,植物群落和土壤理化性质等环境因子对土壤无脊椎动物群落和功能产生影响[5-6]。而土壤无脊椎动物受其体型大小影响,在土壤中活动能力相差悬殊,其中土壤无脊椎动物位于土壤食物网的顶端,其类群数和体内矿质元素与植物凋落物质量和矿质元素紧密相关[7],且植物凋落物的前期分解主要由土壤无脊椎动物完成[8]。因此,土壤无脊椎动物对植物和土壤环境因子变化响应比较敏感。在草地生态系中啮齿动物是除家畜外重要的生物干扰源,它对草地物种多样性,生产力以及水土保持等产生复杂而深远的影响[9-10]。其中,高原鼢鼠(Easpalaxbaileyi)作为优势鼠种之一,被誉为草地“生态系统工程师”[11],其推土造丘活动形成草地生境异质性斑块,改变了草地原有植被物种组成以及土壤结构和营养。以往研究主要集中在高原鼢鼠干扰对草地植物群落组成、多样性、生产力以及土壤肥力变化等方面[12-14]。高原鼢鼠干扰造成植物群落特征以及土壤理化性质变化,与土壤无脊椎动物的食物资源和栖息地环境条件紧密相关。因此,研究高原鼢鼠对地下生物影响可以进一步加强地下生物对环境条件变化响应的反馈研究。基于以上认识,在青藏高原祁连山东段典型高原鼢鼠栖息区,选择同一放牧强度下3个不同高原鼢鼠相对种群密度栖息地,以鼠丘数量代表干扰强度,调查土壤无脊椎动物种类,数量以及植被和土壤状况,并分析无脊椎动物类群对高原鼠兔干扰下土壤理化性质和植被性状变化的响应。对于科学解释高寒草甸无脊椎动物类群分布与环境因子关系,进而评价高原鼢鼠在草地生态系统中的功能和位置具有重要意义。
1 材料和方法
1.1 研究区概况
试验地设于甘肃省武威市天祝藏族自治县抓喜秀龙乡,该区位于东祁连山金强河谷地,地理坐标为N 37°12′,E 102°46′,海拔2 937 m,地形受马牙雪山和雷公山影响。年均温-0.1℃,1月平均温度-18.3℃,7月平均温度12.7℃,>0℃年积温1 380℃;年均蒸发量1 592 mm,年均降水量416 mm,多为地形雨,集中于7,8和9月,无绝对无霜期。植物生长期120~140 d。土壤以亚高山草甸土、亚高山黑钙土为主[15]。植被类型为高寒草甸,以莎草科、禾本科植物为主,主要植物有矮嵩草(Kobresiahumilis)、线叶嵩草(Kobresiacapillifolia)、垂穗披碱草(Elymusdahuricus)、鹅绒委陵菜(Potentillaanserina)、蒲公英(Taraxacummaurocarpam)、平车前(Plantagodepressa)、二裂委陵菜(Potentillabifurca)、秦艽(Gentianamacrophylla)、扁蓿豆(Ruthenianmedic)。高原鼢鼠为该地区绝对优势鼠种。
1.2 试验设计与取样
试验选取7 hm2放牧强度一致的冬季牧场。于2017年6月下旬,依据高原鼢鼠造丘数量,将研究区划分为高、中、低3个高原鼢鼠干扰区。各干扰区面积为100 m×100 m,每个区间隔50 m。在每个干扰区随机设置5个土壤无脊椎动物采样点,采样点避开鼠丘。每个样方面积0.5 m×0.5 m,取样深度15 cm。
采用手捡法挑出土壤无脊椎动物,用75%乙醇溶液保存,带回室内鉴定。由于部分土壤无脊椎动物幼虫的科、属鉴定比较困难,其次采集到的土壤无脊椎动物数量相对较少,可鉴定的科、属难以用于数据处理分析。因此,此次研究无脊椎动物参考《中国土壤动物检索图鉴》[16],鉴定统计到目,并统计个体数量。根据土壤无脊椎动物调查样点记录样方内植物物种数目,并剪掉样方内植物,依据莎草科,禾本科和杂类草功能群分开,用烘箱75℃烘干称取地上植物干重。样地总盖度采用步测法[17]。取样调查土壤无脊椎动物采集点附近0~15 cm 土壤的理化性质。土壤含水量用环刀法测定,土壤紧实度使用土壤紧实度仪(Field scout SC900)测定。土壤有机质、全氮、全磷和全钾含量测定方法参考《土壤理化分析》[18],土壤pH测定采用pHSJ-4A型pH计。
1.3 数据分析
1.3.1 植物物种丰富度 丰富度指数R=S(S为样方中出现的物种数)。
1.3.2 无脊椎动物功能群划分 依据无脊椎动物食性将其分为杂食性、腐食性、植食性和捕食性功能群[19]。植食性包括鞘翅目幼虫(Coleoptera)、鳞翅目幼虫(Lepidoptera)、同翅目成虫(Homoptera)、半翅目成虫(Hemiptera )、双翅目成虫(Dipterahrt)和柄眼目(Stylommatophora);捕食性包括蜘蛛目(Araneae)和鞘翅目成虫(Coleoptera );腐食性包括双翅目幼虫(Dipterahr );杂食性有膜翅目蚁科(Hymenoptera:Formicidae)和双尾目(Diplura)[6]。根据栖息生境条件划分为土壤无脊椎动物(鞘翅目幼虫、鳞翅目幼虫、柄眼目、蜘蛛目、鞘翅目成虫、双翅目幼虫膜翅目和双尾目)和地上无脊椎动物(同翅目成虫,半翅目成虫和双翅目成虫),其中土壤无脊椎动物占据优势。
1.3.3 多元排序 采用Canoco 4.5软件分析无脊椎动物类群和数量与环境变量的关系。排序之前做除趋势对应分析[20]。为评估环境因子对无脊椎动物数量的影响,分别计算每个环境因子的总效应和净效应[21],采用CanocoDraw绘制RDA排序图。
试验数据用Excel 2013进行初步处理,用Spass 19.0中的LSD法进行数据的多重比较(a=0.05)。
2 结果与分析
2.1 不同高原鼢鼠干扰强度下植被群落特征和地上生物量变化
高原鼢鼠干扰下植物群落结构和地上生物量明显不同(表1)。随高原鼢鼠干扰强度增加,草地植被总盖度和物种丰富度呈明显下降趋势,且高强度干扰区植被盖度显著低于中低强度干扰区(P<0.05)。植物物种丰富度未发生显著变化(P>0.05)。莎草科和禾本科植物地上生物量伴随高原鼢鼠干扰强度增加呈上升趋势,高强度干扰度区莎草科和禾本科植物地上生物量显著高于低干扰区(P<0.05);而高强度干扰区杂类草植物地上生物量显著高于中、低干扰区(P<0.05)。
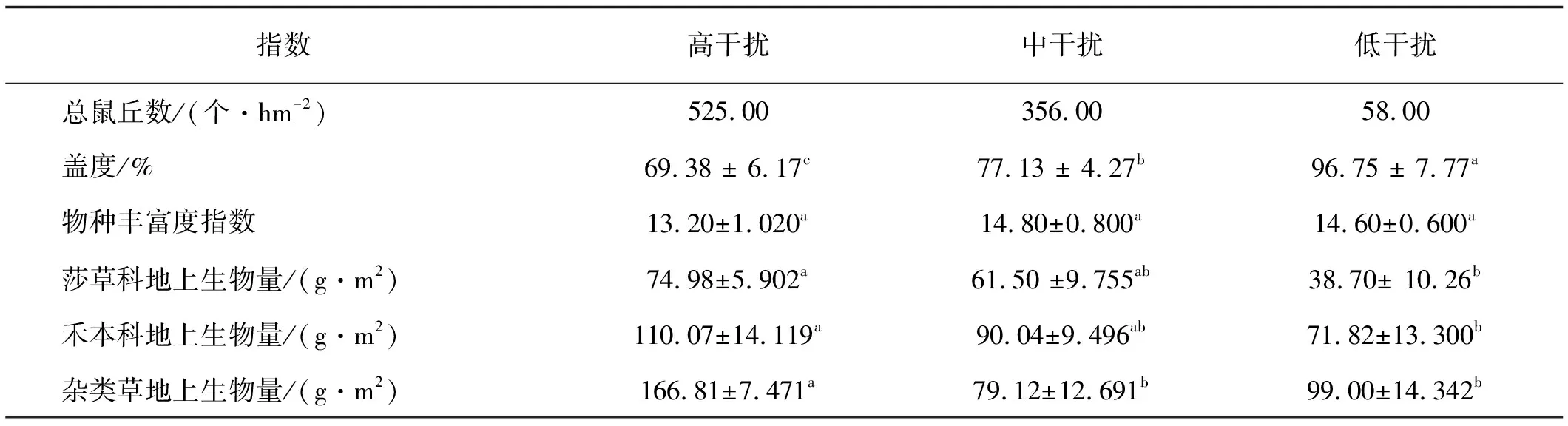
表1 高原鼢鼠干扰下的样地变化
注:同行不同小写字母表示差异显著(P<0.05)
2.2 不同高原鼢鼠干扰强度下土壤理化性状变化
土壤化学性质随高原鼢鼠干扰差异不大(表2),其中土壤有机质,全钾和pH在高原鼢鼠干扰下差异不显著(P>0.05)。土壤全磷和全氮含量伴随高原鼢鼠干扰强度增加呈降低趋势,高强度干扰区土壤全磷含量显著低于低干扰区(P<0.05),而中强度干扰区土壤全氮含量显著低于低强度干扰区(P<0.05)。
土壤物理性质随干扰强度变化不同,0~15 cm土层土壤紧实度伴随高原鼢鼠干扰强度增加明显下降,高干扰区土壤紧实度显著低于低干扰区(P<0.05);土壤含水量呈相反变化趋势,且高强度干扰区土壤含水量显著高于低干扰区(P<0.05)。
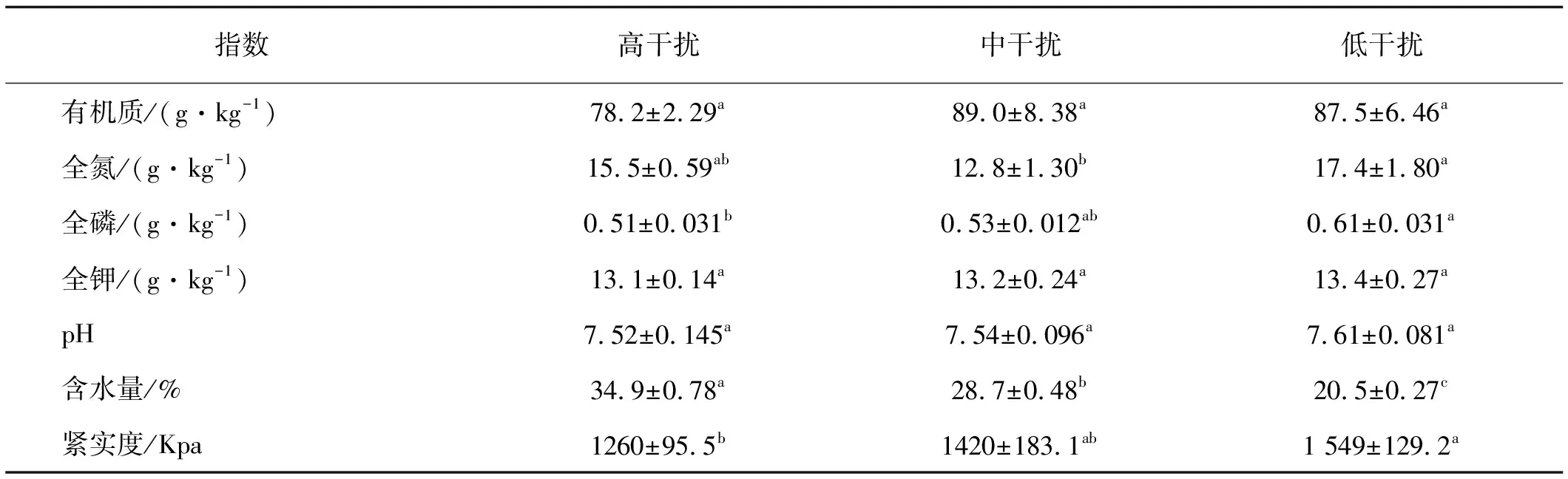
表2 不同高原鼢鼠干扰强度下表层土壤理化性状
注:同行不同小写字母表示差异显著(P<0.05).
2.3 不同高原鼠兔干扰强度下无脊椎动物类群及数量变化
各干扰区共采集到无脊椎动物标本317个,分属于3纲9目(鞘翅目、同翅目、双尾目、蜘蛛目、柄眼目、双翅目、膜翅目、半翅目和鳞翅目)。高,中和低强度干扰样地无脊椎动物类群分别占9目,8目和8目。其中鞘翅目成虫,柄眼目和鳞翅目幼虫为各干扰区共有优势类群,占各调查区域无脊椎动物总数量百分比大于10%;鞘翅目幼虫为高干扰区和中干扰区优势类群,分别占所调查区无脊椎动物总数量的10.27%和10.34%,而双翅目幼虫为中低干扰区优势类群,占所调查区无脊椎动物总数量的32.18%和12.09%。双尾目、膜翅目成虫、半翅目成虫和双翅目幼虫为高干扰样地的常见类群,同翅目成虫、双翅目成虫、膜翅目成虫、半翅目成虫和双尾目为中度干扰区常见类群,蜘蛛目、同翅目成虫、双尾目、膜翅目成虫、双翅目成虫和鞘翅目幼虫为低强度干扰样地常见类群。高,中和低干扰区无脊椎动物密度分别为112,73和68只/m2,且高强度干扰区无脊椎动物密度显著高于中低强度干扰区(P<0.05)(表3)。
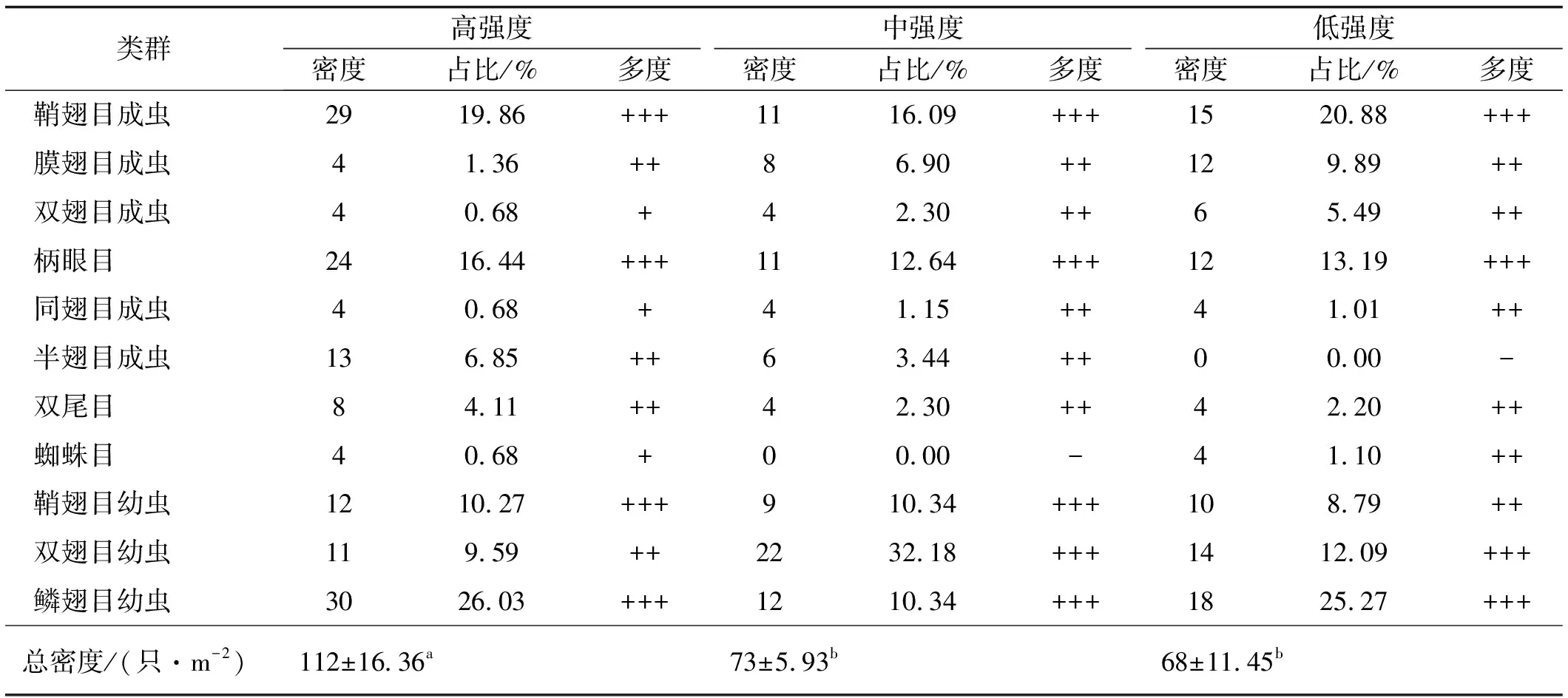
表3 高原鼢鼠不同干扰强度下无脊椎动物的类群和密度
注:“+++”为优势类群,占总个体数10%以上;“++”为常见类群,占总个体数1%~10%;“+”为稀有类群,占总个体数1%以下;“-”表示没有采集到标本。
单因素方差分析结果表明,不同高原鼢鼠干扰强度下无脊椎动物功能群密度在不同生境中存在差异(图1)。植食性无脊椎动物密度在各干扰区占据优势,且植食性无脊椎动物密度随高原鼢鼠干扰强度增加呈明显升高趋势,高强度干扰区植食性无脊椎动物密度显著高于低强度干扰区(P<0.05)。捕食性无脊椎动物密度呈现升高趋势,但差异不显著(P>0.05)。而腐食性和杂食性无脊椎动物类群密度伴随高原鼢鼠干扰强度未呈现规律性变化,表明植食性无脊椎动物对植被生境条件的变化比较敏感。
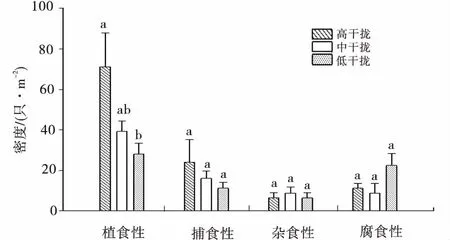
图1 高原鼢鼠不同干扰强度下无脊椎动物功能类群密度Fig.1 The density of functional groups of invertebrate in the plots under different disturbance intensities of plateau zoker
2.4 高原鼢鼠干扰下影响无脊椎动物类群的环境因素
利用冗余分析(RDA)对高原鼢鼠干扰下无脊椎动物类群与环境因子排序(图2),沿着轴1方向,不同干扰强度区无脊椎动物类群分布主要受土壤紧实度的影响,轴2方向表明土壤动态分布主要受土壤含水量和生物量等因子的影响,两轴共解释了51.8%的环境因子对无脊椎动物数量的影响。同翅目(S5)、半翅目(S7)、鞘翅目幼虫(S9)、双翅目幼虫(S10)、鳞翅目幼虫(S11)、柄眼目(S8)、双尾目(S2)和蜘蛛目(S3)类群分布主要受土壤含水量和地上生物量影响,其次受土壤紧实度影响(负相关)。综合分析表明不同干扰区土壤无脊椎动物优势类群与其土壤物理性质相关性强。
不同干扰区无脊椎动物类群分布不同(图3),高干扰区无脊椎动物调查样方在排序轴1的上方分布,而中低干扰区无脊椎动物调查样方基本在排序轴1下方分布,表明无脊椎动物群落结构在不同干扰区存在差异。同时鞘翅目成虫(S1)、双尾目(S2)、蜘蛛目(S3)、同翅目(S5)、半翅目(S7)、鞘翅目幼虫(S9)、双翅目幼虫(S10)、鳞翅目幼虫(S11)和柄眼目(S8)数量在高干扰区较高;而双翅目(S4)、膜翅目(S6)和双翅目幼虫(S11)数量在低干扰区较高。
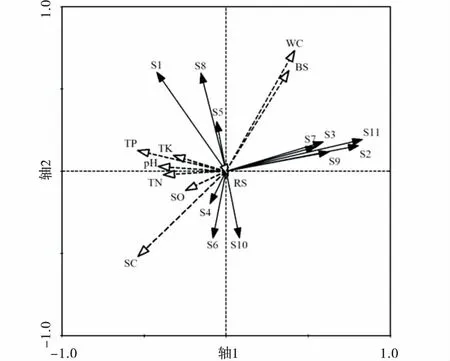
图2 无脊椎动物类群与环境因子排序Fig.2 RDA biplot between environmental factors and soil animal communities注:图2代码S1~S11表示的无脊椎动物类群依次为鞘翅目、双尾目、蜘蛛目、双翅目、同翅目、膜翅目、半翅目、柄眼目、鞘翅目幼虫、双翅目幼虫、鳞翅目幼虫,下同
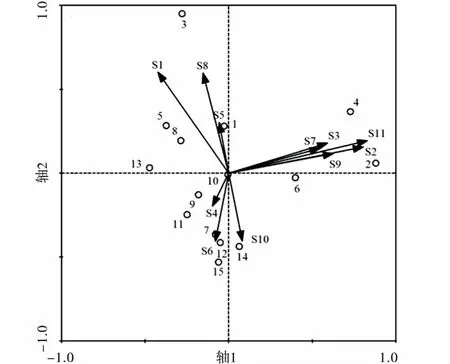
图3 无脊椎动物类群与干扰区样方排序Fig.3 RDA biplot between disturbance zone plots and soil animal communities注:图3数字1~5表示高强度干扰区采样点样方,数字6~10表示中强度干扰区采样点的样方,数字10~15表示低强度干扰区采样点的样方
通过蒙特卡罗置换检验和偏蒙特卡罗置换检验评估每个环境因子对无脊椎动物类群分布影响的解释贡献,检验各环境因子的膨胀系数( Inflation factors,IFs) 均小于10,不受因子自相关性影响。经Monte Carlo 随机置换检验999次(表4),结果表明9个独立的环境解释变量中,土壤紧实度和土壤含水量对土壤无脊椎动物类群分布解释总效应达到显著水平(P<0.05),而其余因子对土壤无脊椎动物类群分布解释的总效应未达到显著水平(P>0.05)。除去协同变量影响,各环境因子解释变量均无显著影响(P>0.05)。
注:* 表示在0.05 水平(双侧)上显著相关,**表示在0.01 水平(双侧) 上显著相关
3 讨论
3.1 高原鼢鼠干扰对无脊椎动物群落影响
伴随高原鼢鼠干扰强度增加,草地植被盖度和地上生物量发生显著变化。高强度干扰区植被总盖度显著低于低干扰区(P<0.05),而莎草科,禾本科和杂类草地上生物量在高干扰区显著较高(P<0.05)。由于单位面积内高干扰区鼠丘数量明显高于低干扰区,造成植被总盖度显著较低,卫万荣[12]研究结果也表明草地植被盖度伴随新鼠丘数量增加显著降低。高原鼢鼠通过采食和推土造丘活动改变了草地植被群落组成。于海玲等[14]研究结果显示伴随鼠丘数量增加,以禾草和莎草为主的植物优势类群向杂类草群落转变。刘锦上[11]结果表明相比无鼠洞道对照,鼠道上方植物生物量明显较高;其次,Yurkewyca等[22]研究发现囊鼠活动强度增加,会导致鼠丘土壤营养矿化,促进鼠丘边植物生长。试验表明高强度干扰区植被受鼠丘微地形和鼢鼠地下复杂洞道影响植物生长趋势明显优于低干扰区,从而造成植物地上生物量显著较高。伴随高原鼢鼠干扰强度增加,高干扰区土壤无脊椎动物密度显著高于低强度干扰区(P<0.05);植食性无脊椎动物密度变化同无脊椎动物总密度变化趋势一致,高强度干扰区植食性无脊椎动物密度最大,而捕食性,腐食性和杂食性类群密度变化不大。表明高原鼢鼠干扰下植食性类群密度对地上植物生物量变化响应明显。研究表明地上植物群落组成能够影响土壤无脊椎动物群落组成和结构[5],其原因是生产力高的植物群落不仅为无脊椎动物提供充足食物资源满足自身需求,同时为无脊椎动物提供合适的栖息环境。试验表明高强度干扰区禾本科和杂类草地上生物量显著高于低干扰区,是造成土壤无脊椎动物密度和植食性类群密度显著高于低干扰区原因之一。RDA 排序图显示植食性类群密度(鞘翅目幼虫、鳞翅目幼虫和柄眼目等)与地上生物量具有相关性。同样张洪芝等[6]研究表明植食性类群密度和地上地下生物量呈正相关。因此,高原鼢鼠干扰下无脊椎动物类群密度(植食性功能群)对生态系统自上至下控制响应明显。
3.2 土壤紧实度和含水量对土壤无脊椎动物类群影响
已有研究表明土壤无脊椎动物类群受植物群落和土壤理化性质变化影响[5-6]。高原鼢鼠干扰下土壤物理性质发生明显改变,高干扰区土壤紧实度显著低于低干扰区(P<0.05)。此次研究高强度干扰区鼠丘数量达到525个/hm2,明显高于低干扰区鼠丘数量。因此,受高原鼢鼠造丘活动影响,高干扰区地下复杂洞道系统,破坏了致密草毡层结构,从而显著降低了表层土壤紧实度。周延山等[23]研究发现绝对鼠密度为28.33只/hm2,相比绝对鼠密度14.67 只/hm2,0~20 cm土壤紧实度显著较低,而0~30 cm土壤含水量显著较高。同样,伴随高原鼢鼠干扰强度增加,土壤含水量显著升高(P<0.05),同土壤紧实度变化趋势相反。高寒草甸植被群落主要以莎草科和杂类草占据优势,其致密根系层严重阻碍降水下渗,由于研究区受降水影响,低紧实度高原鼢鼠干扰区表层土壤含水量明显较高。而土壤无脊椎动物类群密度变化趋势同土壤紧实度和含水量变化相同,表明土壤紧实度和含水量是造成土壤无脊椎动物类群密度变化的主要环境因子。
RDA分析结果表明土壤无脊椎动物类群密度与土壤因子(紧实度和含水量)显著相关(P<0.05)。土壤无脊椎动物优势类群密度(鞘翅目幼虫和成虫、鳞翅目幼虫、柄眼目)与土壤含水量呈正相关,而与土壤紧实度呈负相关关系(图2)。已有研究结果表明环境因子与土壤无脊椎动物类群具有相关性,土壤容重与土壤无脊椎动物类群数和密度呈负相关[5],如鞘翅目和蜘蛛目密度与土壤容重呈负相关[24];土壤无脊椎动物类群密度与含水量呈极显著正相关[24],Setälä等[25]也表明湿度是影响土壤无脊椎动物群落的主要气候因子。此外,已有研究表明土壤化学因子和植被组成与无脊椎动物类群数和密度具有相关性。吴鹏飞等[5]研究发现土壤无脊椎动物密度与pH、有机质和全氮具有显著相关性。不同土壤无脊椎动物类群有其主要的环境影响因子,如双翅目幼虫、鞘翅目和鳞翅目与土壤有机质和全氮呈显著正相关[24],鞘翅目和半翅目与土壤全钾呈正相关[6];其次,刘继亮等[26]研究土壤功能群密度与植物物种丰富度呈显著正相关。此次研究表明伴随高原鼢鼠干扰强度变化,土壤化学因子(有机质、全钾、全氮和pH)和植物物种丰富度未发生显著变化(P>0.05),因此,土壤化学因子和植物物种丰富度对土壤无脊椎动物类群密度影响不明显。
4 结论
试验调查到祁连山东段高寒草甸无脊椎动物共3纲9目,其中鞘翅目成虫、柄眼目、鳞翅目幼虫为土壤无脊椎动物优势类群。高原鼢鼠干扰对无脊椎动物密度和植食性功能群密度具有显著影响,其通过推土造丘活动明显改变了土壤物理性状(紧实度和含水量),进而影响无脊椎动物类群和密度。RDA分析结果表明,土壤紧实度和含水量与无脊椎动物类群和密度具有显著相关性,而植物物种丰富度和地上生物量与无脊椎动物类群和密度不具有显著相关性。
