不同光质对桑树幼苗生长和光合特性的影响
2019-07-19胡举伟孙广玉
胡举伟 代 欣 宋 涛 孙广玉*
(1.金正大生态工程集团股份有限公司/养分资源高效开发与综合利用国家重点实验室/农业部植物营养与新型肥料创制重点实验室,临沂 276700; 2.东北林业大学生命科学学院,哈尔滨 150040)
光不仅是植物光合作用的能量来源,也是影响植物生长发育的重要环境因子。光质的改变可明显影响植物生理过程、形态建成和生长发育,而光质对植物生理过程、形态建成和生长发育的影响会因植物种类的不同而发生变化。相比于其他光谱区域,红光和蓝光可被光合色素更有效的吸收[1~2]。大量研究表明红光、蓝光、红蓝混合光均可对植物的光合作用、形态建成和生理特性产生不同影响[3~7]。
黑龙江省桑蚕业资源丰富,发展桑蚕业具有得天独厚的资源和区位优势,夏季空气干爽,养蚕季节气温适中,蚕发病少,茧质优[8]。2003年以来,黑龙江松嫩平原盐碱土地区开始种桑养蚕,并逐渐大面积推广应用。当地农民在技术人员的帮助下,充分利用桑树(MorusalbaL.)的特点,发展成为养蚕桑树(蚕桑)、桑葚桑树(果桑)、畜牧饲料桑树(饲料桑)、绿化用桑树(绿化桑)、中药材桑树(药桑)、食用桑树(茶桑)等多种桑树产品并进的农村经营模式,桑树种植面积从无到有发展到约3万亩,农民获得了较高经济效益,而且发现种植桑树后盐碱土壤pH明显下降,农业生产得到了长足发展[9]。黑龙江省秋冬季较长,当地农民为了更好地利用冬闲季节,利用设施栽培的方法种植桑树,发展果桑采摘桑葚能获得更大经济效益;同时也在温室中繁育桑树幼苗出售,以满足当前大田桑树栽培和园林绿化的需求。但在设施栽培条件下,晚秋、冬、春等季节都不同程度地存在光照时间短、光照不足等严重缺光的问题,会严重地影响桑树生长。因此,如何调节光照获得健壮幼苗,以满足大田桑树栽培和桑树扦插育苗的需要,成为目前需要解决的问题。蓝光(400~500 nm)和红光(600~700 nm)是对高等植物光合作用最有效的光,鉴于其光谱特性,红蓝光质对植物的生长、光合和生理特征等方面的影响成为国内外学者们的研究热点,目前关于红蓝光对植物生长发育影响的研究多聚焦在蔬菜、花卉等植物,例如黄瓜(CucumissativusL.)[10]、番茄(LycopersiconesculentumMill.)[11]、菠菜(SpinaciaoleraceaL.)[12]等,关于红蓝光对桑树生长影响的研究报道较少。同时由于植物对光质的生理与生长响应多是物种依赖的[13],不能根据前人研究结果推测红蓝光对桑树生长与生理的影响。因此,有必要研究红蓝光对桑树幼苗生长和生理特性的影响,以期探明红蓝光对桑树幼苗生长和生理的调控作用,为设施栽培桑树中光质条件的调控提供参考与技术支撑。
1 材料与方法
1.1 材料与培养环境
试验于2014年9月进行,供试材料为1年生桑树品种“龙桑1号”幼苗(MorusalbaL.cv.Longsang No.1),去掉桑树幼苗的分枝、叶片和须根,仅保留主茎、主根各约2 cm,然后将幼苗移栽到直径8 cm、高12 cm的培养盆中,培养盆内装草炭土和蛭石的混合培养基质(体积比2∶1),每盆定植1株。每株只保留一支枝条。在移栽后将所有植株放置在人工气候室中,由白色冷荧光灯(广州绿荧光电有限公司)提供光照,光照强度为100 μmol·m-2·s-1,环境条件控制为:光周期(14 h/10 h,光/暗),白天温度(28±2℃),夜间温度(23±2℃),相对湿度60%~65%,每3 d浇1次水。
1.2 光质处理方法
幼苗培养2周后挑选健壮、长势一致的幼苗接受不同光质处理。一些幼苗仍在白色冷荧光灯下培养,作为白光(W)对照处理,另设3个LEDs阵列光源处理,分别为红光(R)、蓝光(B)、红蓝混合光(RB)(红光LED数量∶蓝光LED的数量=5∶1),以上LEDs阵列光源均由广州绿荧光电有限公司提供。不同光源的光谱和光照强度通过光谱仪(OPT-2000,Optpe Co.,中国)和光量子传感器(LI-250A,Licor,美国)测定。放置不同光源的灯架外部用遮光布覆盖,以避免外界光照干扰。通过调整光源到植株顶部的距离,使各处理的光照强度保持在100 μmol·m-2·s-1,不同光质的光谱特点详见表1,其它环境条件同1.1。每处理各20盆植株,3次重复。幼苗在不同光质处理下培养30 d后,选取从顶端往下数第2片完全展开叶片进行各项指标测定。
1.3 测定指标与方法
1.3.1 生长指标测定
各处理均随机选取5株幼苗,测定从植株茎基部到顶部的茎长度;用叶面积仪测定叶片面积(LI-3000C,Licor,美国);将植株的茎、叶杀青后,在80℃下烘干至恒重,用电子天平称量干重;根据从顶端往下数第2片完全展开叶片的叶面积、干重,计算比叶重(LMA)。
1.3.2 生化指标测定
各处理均随机选取3株幼苗进行各项指标测定。用打孔器从新鲜叶片取圆形叶片,按照Arnon[14]所述方法测定叶绿素含量。可溶性蛋白含量的测定参照Bradford[15]的方法。
蔗糖、淀粉含量按照前人研究描述的方法测定:称取烘干后的叶片,用25 mL 80%乙醇(V/V)研磨提取蔗糖,离心后,上清用于蔗糖含量的测定;向离心后的沉淀中加入25 mL 2% HCl(V/V),煮沸4 h,冷却后离心,上清用于淀粉含量的测定[16]。用打孔器从新鲜叶片上取圆形叶片,杀青后在80℃下烘干至恒重,然后取烘干后叶片,通过元素分析仪(Vario MAX CN,Elementar,德国)测定叶片总氮(N)含量。
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光还原法[17]。过氧化物酶(POD)活性测定采用愈创木酚法[18]。过氧化氢酶(CAT)活性通过过氧化氢还原法测定[19]。丙二醛(MDA)含量通过MDA与含有0.5%(W/V)硫代巴比妥酸的三氯醋酸溶液的反应产物在532 nm处吸光度测定[20]。
1.3.3 光合气体交换参数和叶绿素荧光参数测定
利用LI-6400XT便携式光合仪(Licor,美国)测定植株叶片的净光合速率(Pn)、气孔导度(Gs),叶室温度控制为28±1℃,相对湿度65%,外界CO2浓度为400 μmol·mol-1,光强为100 μmol·m-2·s-1。叶绿素荧光参数利用FMS-2叶绿素荧光仪(Hansatech,英国)测定,在测定之前先将植株暗适应30 min,试验所用光化光和饱和脉冲光分别为100和5 000 μmol·m-2·s-1,PSⅡ的最大光化学效率(Fv/Fm)、PSⅡ的实际光化学效率(ΦPSⅡ)、开放的PSⅡ反应中心激发能的捕获效率(Fv′/Fm′)、非光化学猝灭(NPQ)参照Wingler等[21]所述的方法测量和计算。
1.3.4 叶片解剖结构测定
用刀片切取1 mm×2 mm的叶片样品,注意避开主叶脉,取样后将样品随即放入1%戊二醛(W/V)中抽真空,而后在4%戊二醛中4℃下固定3 h。固定后用0.1 mol·L-1磷酸缓冲液充分冲洗样品。然后将样品放入2%锇酸(W/V)中,在4℃下后固定1.5 h,之后用0.1 mol·L-1磷酸缓冲液充分冲洗样品,接着样品经一系列不同浓度丙酮梯度脱水。脱水完成后样品用一系列不同比例的纯丙酮和环氧树脂混合物进行渗透与包埋。包埋后,切出超薄切片(70 nm)。超薄切片用5%醋酸双氧铀、柠檬酸铅(W/V)染色,然后用透射电镜(Hitachi-7650,Hitachi,日本)观察,并用透射电镜自带软件测量叶片厚度、栅栏组织以及海绵组织厚度。
1.4 数据统计分析
利用SPSS 17.0软件对数据进行方差分析(one-way ANOVA)分析,并比较不同数据组间的差异(LSD, α=0.05)。采用Microsoft Excel 2007作图,图表中数据均为3次或3次以上重复的平均值±SD。
2 结果与分析
2.1 不同光质的光谱特点
由表1可知,白光的峰值波长为410~700 nm,红光LED和蓝光LED的峰值波长分别为660 nm、465 nm,半峰全宽均为20 nm。
表1 不同光质的光谱参数
Table 1 The light spectral parameters of different light quality

处理Treatments峰值波长Peak wavelength(nm)半峰全宽Halfwave width(nm)光量子通量密度Photon flux density(μmol·m2·s-1)W410~700—100R660±20100RB660,465±20,±20100B465±20100
注:W.白光;R.红光;RB.红蓝混合光;B.蓝光 下同。
Note:W.White light; R.Red light; RB.Mixture of red and blue light(red LED∶blue LED=5∶1); B.Blue light The same as below.
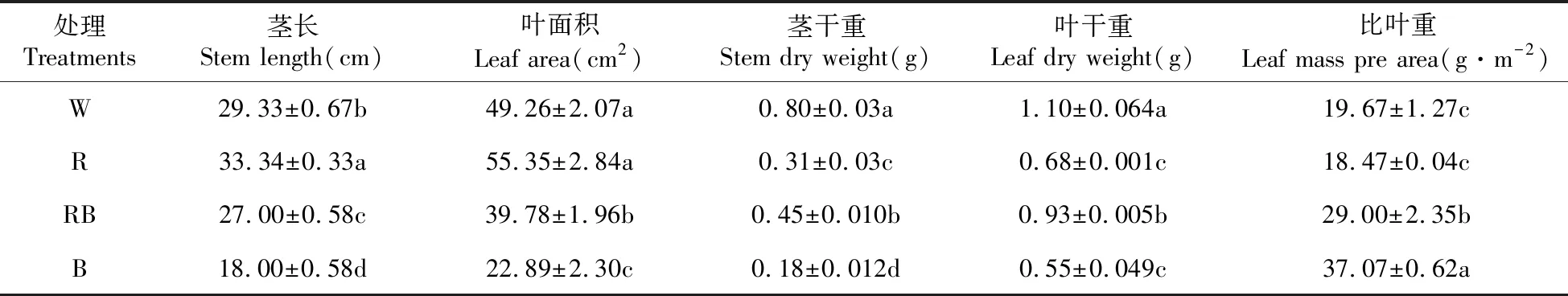
表2 不同光质对桑树幼苗生长的影响
注:同一列中不同小写字母表示处理间差异显著(P<0.05),下同。
Note:Different small letters in the same column indicate significant differences(P<0.05),the same as below.
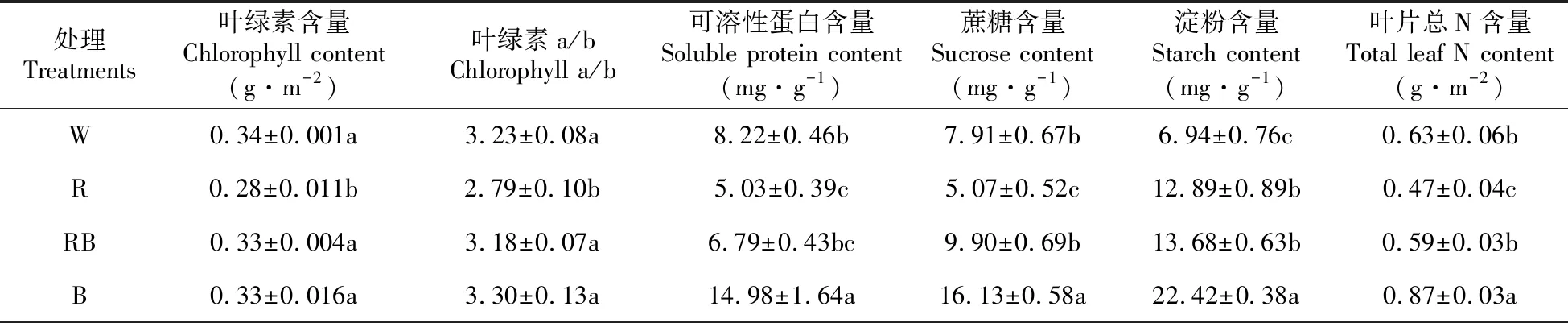
表3 不同光质对桑树幼苗生化指标的影响
2.2 不同光质对桑树幼苗生长的影响
由表2可知,不同光质处理对桑树植株的生长、形态特征产生了明显影响。红光处理下植株茎长、叶面积最大,其次是白光、红蓝混合光处理,在蓝光处理下最小。白光对照处理下植株的茎干重、叶干重显著高于其它光质处理,而蓝光处理下植株的茎干重、叶干重最小。蓝光处理下植株的比叶重最大且显著高于其它光质处理,红光处理下植株的比叶重最小。
2.3 不同光质对桑树幼苗生化指标的影响
如表3所示,白光对照处理下叶片的叶绿素含量最高且显著高于红光处理,但与红蓝混合光、蓝光处理相比无显著差异。而红蓝混合光、蓝光处理下叶片的叶绿素a/b比值与对照相比无显著差异,而红光处理下叶片的叶绿素a/b显著低于对照处理。蓝光处理下植株的可溶性蛋白含量、叶片总N含量最高,其次是白光、红蓝混合光处理,红光处理下最小。蓝光处理下叶片的蔗糖、淀粉含量显著高于其它光质处理,红光处理下叶片的蔗糖含量最低,而白光对照处理下叶片的淀粉含量最低。
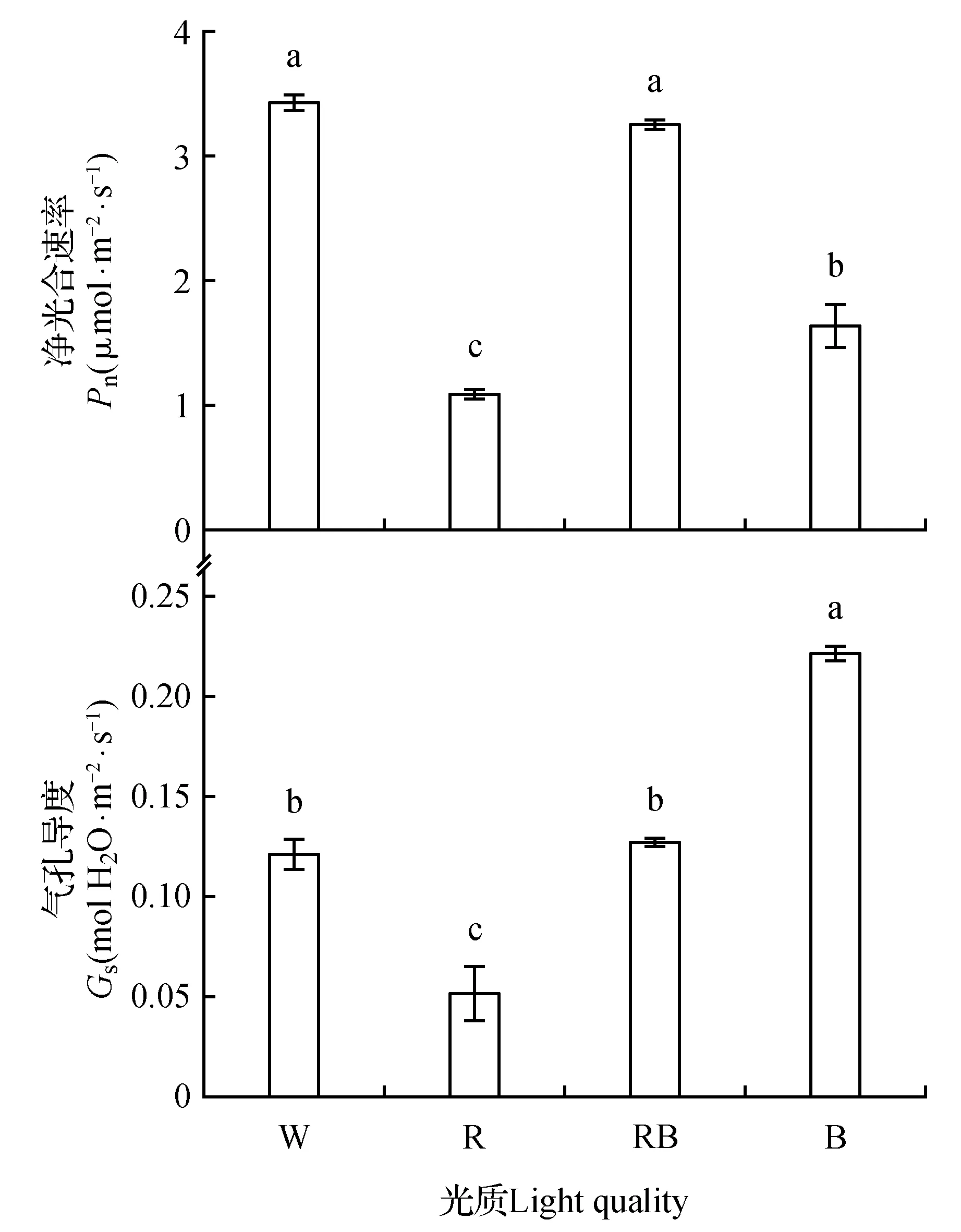
图1 不同光质对桑树叶片光合气体交换参数的影响Fig.1 Effects of different light qualities on photosynthetic gas exchange parameters of mulberry leaves
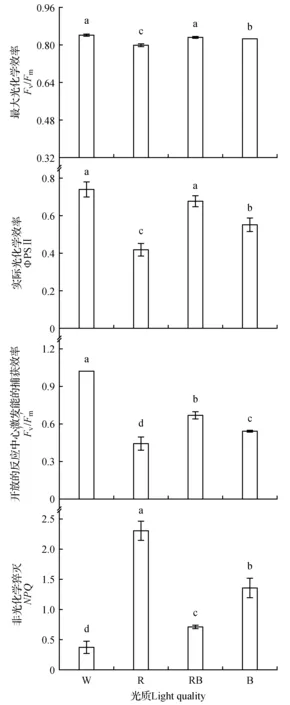
图2 不同光质对桑树叶片荧光参数的影响Fig.2 Effects of different light qualities on chlorophyll fluorescence parameters of mulberry leaves

图3 不同光质对桑树叶片抗氧化酶(SOD、POD和CAT)活性及MDA含量的影响Fig.3 Effects of different light qualities on antioxidant enzymes(SOD,POD and CAT) activity and MDA content of mulberry leaves
2.4 不同光质对桑树幼苗叶片光合气体交换参数的影响
如图1所示,光质显著影响叶片的光合特性(图1)。与白光对照处理的叶片Pn相比,红光和蓝光处理下叶片的Pn显著降低,且红光处理下叶片的Pn最低,红蓝混合处理下叶片的Pn与对照处理相比,无显著差异。同时,蓝光处理下叶片的Gs显著高于其它各光质处理,而红光处理叶片的Gs显著低于其它各光质处理,红蓝混合光处理下叶片的Gs与白光对照相比无显著差异。
2.5 不同光质对桑树幼苗叶片叶绿素荧光参数的影响
如图2所示,与白光对照相比,红蓝混合光对叶片的Fv/Fm无显著影响,而红光、蓝光处理下叶片的Fv/Fm显著降低且红光下降低的程度最大。不同光质对ΦPSⅡ的影响与Fv/Fm相似。与白光对照相比,红光、红蓝混合光和蓝光处理下叶片的Fv′/Fm′显著降低,且红光处理下叶片的Fv′/Fm′最低,红蓝混合光处理的Fv′/Fm′显著高于红光和蓝光处理。红光处理下叶片的NPQ显著高于对照、红蓝混合光和蓝光处理,而红蓝混合光和蓝光处理下叶片的NPQ虽然显著高于对照处理,但显著低于红光处理。
2.6 不同光质对桑树幼苗叶片抗氧化酶活性与丙二醛含量的影响
SOD、POD、CAT是植物活性氧清除系统的重要组成部分,由图3可以看出,不同光质处理显著影响了叶片中SOD、POD、CAT的活性(图3)。红光、红蓝混合光、蓝光处理下叶片的SOD、POD、CAT的活性均显著高于白光对照处理,且在蓝光处理下叶片的SOD、POD、CAT的活性最高。同时,红光、红蓝混合光、蓝光处理下叶片的丙二醛(MDA)含量均显著低于白光对照。
2.7 不同光质对桑树幼苗叶片横切面结构的影响
由表4可知,不同光质也显著影响了叶片横切面的解剖结构(表4)。白光对照处理下叶片厚度、栅栏组织厚度和海绵组织厚度均最大,红蓝混合光、蓝光处理下叶片厚度、栅栏组织厚度、海绵组织厚度次之。红光处理下叶片厚度、栅栏组织厚度、海绵组织厚度最小且显著小于对照和蓝光处理。
表4 不同光质对桑树叶片横切面解剖结构的影响
Table 4 Effects of different light qualities on anatomical structure of leaf cross sections in mulberry leaves
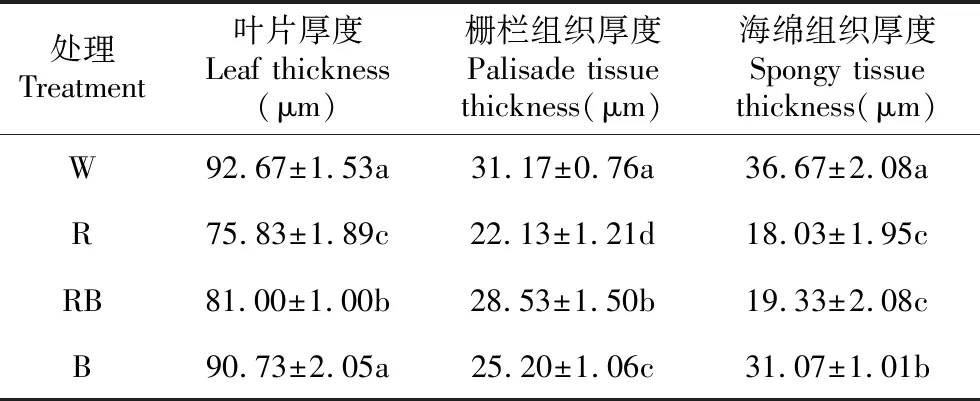
处理Treatment叶片厚度Leaf thickness(μm)栅栏组织厚度Palisade tissue thickness(μm)海绵组织厚度Spongy tissue thickness(μm)W92.67±1.53a31.17±0.76a36.67±2.08aR75.83±1.89c22.13±1.21d18.03±1.95cRB81.00±1.00b28.53±1.50b19.33±2.08cB90.73±2.05a25.20±1.06c31.07±1.01b
3 讨论
松嫩平原盐碱化土地面积已达320×104hm2,已成为世界三大苏打盐碱土集中分布区之一[22]。因此,如何有效地利用和开发盐碱地以减轻土壤盐碱化对农牧业生产和生态环境的危害,成为可持续发展亟待解决的重要课题之一。黑龙江省松嫩平原地区农民通过栽植桑树,不仅改善了当地生态环境,而且促进了蚕业的发展。但是如何在冬季农闲时期采用设施栽培措施获得健壮幼苗还需选取适合桑树幼苗生长的光质。本试验对这一问题进行了初步探究,结果表明,不同光质显著影响了桑树幼苗的生长、形态建成,与白光处理的植株相比,红光处理植株的茎长、叶面积最大,其次是红蓝混合光,蓝光下最小。蓝光可抑制较多植物物种的节间生长和细胞分裂[23~25]。结合这些前人结果,本试验中红蓝混合光和蓝光处理下,桑树幼苗茎长和叶面积变小(图1),可能是由于细胞分裂和细胞扩展受抑制所致。Sebastian和Prasad[26]研究发现生长在单质蓝光LEDs下的水稻(OryzasativaL.)生物量低于白光LEDs下生长植株,但显著高于红光下生长植株。而在一定比例红蓝LEDs光下培养的陆地棉(GossypiumhirsutumL.)组培苗的生物量高于在白色荧光灯下或单质红光LEDs、单质蓝光LEDs生长的植株[27]。本试验结果表明,红蓝混合光处理下植株的生物量虽然显著低于白光对照处理,但高于红光和蓝光处理。Hogewoning等[10]研究发现单质红光处理下黄瓜幼苗的LMA最低,幼苗的LMA随着红蓝组合光中蓝光比例的增加而变大,但在单质蓝光下的LMA有所降低。我们的研究结果与此并不完全一致,本研究中,虽然红光处理下叶片的LMA最低,但蓝光下的LMA显著高于其它光质处理。这些结果表明光质改变可用于调控桑树幼苗的生长和形态,同时植株对光质的响应是物种依赖的。
较高比例的蓝光可使植株叶片呈现“阳生型”特征,这些叶片具有高的LMA和光合能力[28~29]。在本研究中,红蓝混合光处理下叶片的Pn高于红光、蓝光处理,且红蓝混合光处理下叶片的Pn与白光对照处理相比无显著差异。本研究中,蓝光处理下叶片的叶绿素含量与白光对照相比无显著差异,显然蓝光下桑树叶片较低的Pn与叶绿素含量无关。蓝光和红光都可诱导气孔张开[30]。本研究中,蓝光处理下叶片的Gs显著高于其它光质处理,但Pn显著低于白光对照处理。因此,CO2的可利用性并不限制蓝光处理下植株的光合作用。单质光下Pn的降低是由激发能在光系统Ⅰ、光系统Ⅱ间不均衡分配造成的[31]。与此相符合的是,本研究结果表明在红光、蓝光处理下叶片的实际光化学效率(ΦPSⅡ)急剧降低。然而,其它因素可能也造成了红光下叶片Pn降低。本研究中,红光处理下叶片的Gs、叶绿素含量、可溶性蛋白含量、叶片单位面积总N含量大幅降低。由于Rubisco是叶片中可溶性蛋白的主要组成部分,所以红光处理下叶片的Rubisco含量可能显著下降。同时植株的光合作用也依赖于叶片总N含量[32]。因此除了红光下叶片的ΦPSⅡ降低,与红蓝混合光、蓝光下生长叶片相比,卡尔文循环中CO2羧化受抑制也是引起红光下生长叶片Pn降低的原因。而红蓝混合光下生长叶片的Gs、ΦPSⅡ、可溶性蛋白含量、叶绿素含量与白光处理无显著差异,这可能是红蓝混合光下叶片Pn与白光处理无显著差异的原因。此研究结果和红蓝组合光下水稻植株的Pn高于红光处理与红蓝组合光下植株叶片具有较高的Rubisco含量、总N含量有关的报道相符[28]。Hogewoning等[10]则发现红蓝组合光、蓝光处理下植株叶片的Fv/Fm和ΦPSⅡ高于红光处理,而红蓝组合光处理下植株的Fv/Fm和ΦPSⅡ与蓝光下处理无明显差异,单质红光可引起光合机构功能失调。本试验研究结果与这些报道相一致。本试验还发现,与白光对照处理相比,在蓝光、红光处理下叶片的NPQ大幅增加,而红蓝混合光处理下增加幅度较小。这表明,在单质红光、单质蓝光下桑树幼苗叶片的光合机构功能失调导致光系统Ⅱ捕获的激发能以非光化学猝灭形式耗散掉的比例增加。
在本研究中,红光下植株叶片的叶绿素a/b比值显著低于红蓝混合光、蓝光处理。这与光质对黄瓜叶片叶绿素a/b比值影响相一致[10]。光质在叶绿素的生物合成中起重要作用[33]。前人研究结果表明红光不利于叶绿素的形成,表现为红光下叶绿素的生物合成前体5-氨基乙酰丙酸减少[34~35]。而有较多研究表明蓝光有利于叶绿素的积累[34~36]。蓝光可逆转红光诱导的抑制叶绿素合成的响应[35]。因此,在本研究中红蓝混合光、蓝光下较高的叶绿素a/b比值可能是由于蓝光对叶绿素生物合成的影响造成的。同时,在本研究中白光处理下叶片的淀粉含量明显低于红光、红蓝混合光和蓝光处理。显然,本研究中不能排除光合产物积累对红光、红蓝混合光和蓝光处理下桑树植株光合作用的反馈抑制[10]。
最近的研究表明,与白光处理相比,单质红光、单质蓝光处理下水稻叶片中的抗氧化酶活性明显提高,而MDA含量显著降低[26]。同时,Dong等[37]发现,与白光处理相比,红光、红蓝混合光可增强花期小麦叶片的SOD活性。本试验结果表明,与白光处理相比,红光、红蓝混合光和蓝光处理下叶片的SOD、POD、CAT活性大幅提高。这可能是由于红光、蓝光可被光合色素更有效的吸收,从而造成光合电子传递链的饱和,最终引起抗氧化活性的增强[38]。较高的SOD、POD、CAT活性可有效的清除ROS,减轻ROS对细胞膜脂的过氧化伤害。所以在本研究中红光、红蓝混合光和蓝光处理下叶片的膜脂过氧化产物MDA含量显著低于白光处理。
叶片是植物中可塑性较强的器官,植物叶片对环境条件的变化敏感,光质对叶片的解剖结构有较明显的影响[39]。生长在单质蓝光和红蓝组合光下陆地棉叶片厚度、栅栏组织厚度均显著高于单质红光处理,但叶片厚度、栅栏组织厚度与蓝光比例并不呈现线性相关关系[27]。本试验中,相比于红光处理,红蓝混合光、蓝光有利于叶片厚度、栅栏组织厚度和海绵组织厚度的增加。这与前人研究结果相一致[27,40]。以上结果表明,补充蓝光可削弱单质红光对桑树幼苗叶片中叶肉组织发育的不利影响,蓝光可能在调节桑树叶片组织发育中起作用。
综上所述,本研究表明红光促进桑树幼苗茎伸长、叶片展开,降低比叶重、叶片总N含量、Gs。蓝光抑制茎伸长和叶片展开,增加比叶重、叶片总N含量和Gs。蓝光下Pn的降低主要归因于光系统功能失调,而红光下也受叶绿素含量、可溶性蛋白含量和Gs降低影响。红蓝混合光下植株的生长状况、生理特征与白光下相似。本试验研究结果表明一定比例的红蓝混合光可减少单质红光、蓝光对桑树植株生长发育的不利影响,红蓝混合光LED具有应用于黑龙江省松嫩平原盐碱土地区设施栽培桑树幼苗的潜力。
