重组人乙酰胆碱酯酶基因在毕赤酵母中分泌表达及其对农药的敏感性评估
2019-07-08杨芳芳李佳慧张赛南王珍廖志银王首锋
杨芳芳,李佳慧,张赛南,王珍,廖志银,王首锋,3*
(1.浙江大学基础医学系,杭州 310058;2.绿城农科检测技术有限公司,杭州 310052;3.浙江省微生物生化与代谢工程省级重点实验室,杭州 310058)
在过去30年间,有机磷和氨基甲酸酯类农药在全世界得到了广泛的应用,由此引发了许多的食品安全问题[1-3]。我国是农业大国,为了提高粮食产量,对农药的依赖性越来越强,而有机磷和氨基甲酸酯类农药具有高效、低毒、低残留、防治效果好、防治对象多、应用范围广等特点,是目前使用最广泛的一类农药。有研究表明,有机磷和氨基甲酸酯类农药在特定的环境下会在食品中残存较长的时间,既可以在水果、蔬菜等农作物中残留,也可以在动物体内累积。为了提高产量和防治病虫害而大量施用农药使得农作物中农药残留超标的现象非常严重,给食品安全和人类健康造成了严重的威胁[4],因此,找到快速检测农药残留方法对于控制食品安全隐患具有重要意义。
酶抑制法是目前检测有机磷和氨基甲酸酯类农药残留的主要技术,具有简便、灵敏、经济、快速的特点。在酶抑制法中酶最为关键。酶抑制法的基本原理[5]如下:在正常生理情况下,乙酰胆碱酯酶(acetylcholinesterase,AChE)可以选择性水解乙酰胆碱成为胆碱和乙酸。而有机磷和氨基甲酸酯类农药能够特异性抑制乙酰胆碱酯酶的活性,因此,乙酰胆碱酯酶成为酶抑制法的关键酶。将乙酰胆碱和乙酰胆碱酯酶吸附在滤纸片上,加入特定显色剂后,根据滤纸片颜色的变化来判断酶反应产物生成量的多少,进而判定样品中是否存在有机磷及氨基甲酸酯类农药[6]。酶抑制法所用酶包括乙酰胆碱酯酶、丁酰胆碱酯酶和动物与植物酯酶,其中乙酰胆碱酯酶对有机磷和氨基甲酸酯类农药较为敏感,测定的灵敏度高,选择性强,因而被广泛使用[7-9]。
已有研究表明,人乙酰胆碱酯酶(human acetylcholinesterase,hAChE)对有机磷和氨基甲酸酯类农药的双分子速率常数较其他几种来源的酶要高,敏感性更强[10-13],故本研究以人乙酰胆碱酯酶为研究对象。近年来,已有从不同生物组织中提取并纯化AChE的报道[14-18]。然而,通过这些方法得到的AChE不仅含量低,而且存在时间成本高和纯化复杂等问题。目前,已有在毕赤酵母中成功分泌表达了AChE的报道[19],为工业化发酵生产AChE提供了可能。本研究在毕赤酵母中成功分泌表达了hAChE,根据改良的Ellman酶活测定方法,测定了市面上常见的8种农药对hAChE的酶抑制率,进而评估了hAChE对8种农药的敏感性大小,为农药残留快速检测的关键酶——人乙酰胆碱酯酶的工业化生产提供了技术基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
pReceiver-M02-hAChE-ORF质粒购自广州易锦生物技术有限公司;pPIC9K-top10菌株为浙江大学化学工程与生物工程学院姚政博士所赠;DH5α和GS115菌株为浙江省微生物生化与代谢工程省级重点实验室所保存。
1.1.2 试剂
高保真DNA聚合酶(TaKaRa PrimeSTAR HS DNApolymerase)、SnaBⅠ和AvrⅡ(BlnⅠ)限制性内切酶和DNA聚合酶(EasyTaq)均购自宝生物工程(大连)有限公司;割胶纯化试剂盒、聚合酶链式反应产物纯化试剂盒和T4 DNA连接酶试剂盒均购自生工生物工程(上海)股份有限公司;阴离子交换色谱(Q-Sepharose fast flow chromatography)购自瑞典Amersham公司;乐果(98.6%)、敌敌畏(99.3%)、甲胺磷(98.6%)、敌百虫(99.2%)、马拉硫磷(99.5%)、甲萘威(98.7%)、毒死蜱(99.4%)、克百威(98.4%)等8种农药标准品均购自北京世纪奥科生物技术有限公司。
1.1.3 培养基
细菌基础(Luria-Bertani,LB)培养基,酵母膏蛋白胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD),最小葡萄糖培养基(minimal dextrose medium,MD);毕赤酵母诱导表达前培养基——缓冲复合甘油培养基(buffered minimal glycerol-complex medium,BMGY),毕赤酵母诱导表达培养基——缓冲复合甲醇培养基(buffered minimal methanolcomplex medium,BMMY),培养基配方参照美国Invitrogen公司毕赤酵母表达手册。
1.2 方法
1.2.1hAChE基因克隆
根据GenBank公布的人乙酰胆碱酯酶基因序列(NM_000665.4)设计引物 F1和 R1(表1)。以pReceiver-M02-hAChE-ORF质粒为模板,以特异性引物F1和R1进行聚合酶链式反应(polymerase chain reaction,PCR)。PCR反应体系(50 μL)如下:5×PCR 缓冲液 10 μL,dNTP混合物(2.5 mmol/L)8 μL,引物 F1(10 μmol/L)0.5 μL,引物R1(10 μmol/L)0.5 μL,模板0.5 μL,TaKaRa PrimeSTAR HS DNA聚合酶(2.5 U/μL)0.5 μL,ddH2O 30 μL。PCR条件:95℃预变性5 min;95℃变性30 s,65.1℃退火1 min,72℃延伸3 min,31个循环;最后,72℃延伸10 min。将PCR产物纯化后待用。
1.2.2 表达载体pPIC9K-hAChE的构建、转化与筛选
由于在hAChE基因中不包含pPIC9K多克隆位点处的常用酶切位点,因此可以使用传统的酶切连接方法将hAChE基因克隆至pPIC9K载体上。先用SnaBⅠ和AvrⅡ分别双酶切hAChE基因和pPIC9K载体,使其具有相同的黏性末端。对双酶切纯化后的hAChE基因和pPIC9K载体片段利用T4 DNA酶连接体系进行载体构建,其连接反应体系如下:目的片段(75 ng/μL)3 μL,pPIC9K 载体片段(50 ng/μL)1 μL,10×连接缓冲液 1 μL,50% 聚乙二醇(polyethylene glycol,PEG)1 μL,T4 DNA 连接酶1 μL,ddH2O 3 μL。于16 ℃条件下连接12 h,取5 μL反应液用热激法转化至大肠埃希菌DH5α感受态菌株中,将转化液涂布在100 μg/mL氨苄西林LB平板上,于37℃条件下倒置过夜培养,并将通过菌落PCR和双酶切验证为阳性的转化子[20]送上海生工生物工程技术服务有限公司进行测序。
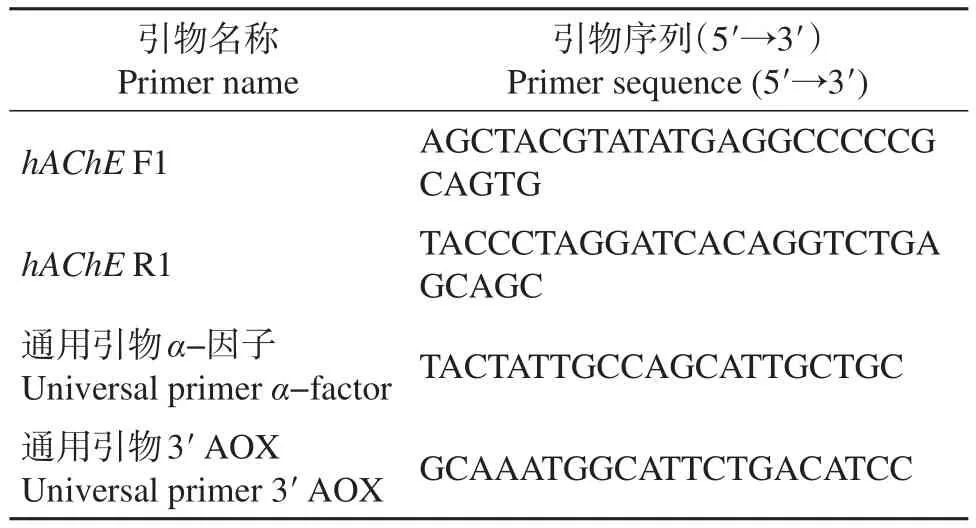
表1 人乙酰胆碱酯酶基因克隆、测序及菌落PCR鉴定所用的引物序列Table 1 Primer sequences for hAChE gene cloning and colony PCR analysis
将构建好的重组质粒pPIC9K-hAChE经SalⅠ限制性内切酶线性化后,用PCR产物纯化试剂盒进行线性核酸片段回收,得到高浓度线性化的重组质粒片段,采用Eporator 2510电穿孔仪(Eppendorf公司,德国)将其电转化至毕赤酵母GS115菌株中。
采用组氨酸缺陷型的MD平板[1.34%酵母氮源,2%葡萄糖,(4×10-5)%生物素,1.5%琼脂]筛选出发生同源重组的His+转化子。用无菌水将平板上的转化子洗下并涂布在含G418(抗性梯度分别为0.25、1.00、2.00、4.00 mg/mL)的YPD平板(1%酵母提取物,2%蛋白胨,2%葡萄糖)上,进行多拷贝重组菌筛选。
1.2.3 重组酵母GS115/pPIC9K-hAChE的菌落PCR鉴定
从含G418(抗性梯度4.00 mg/mL)的YPD平板上挑取单克隆并接种于YPD液体培养基中,培养24 h后 ,取200 μL 培养液,以 1×104r/min 离心5 min。弃上清液,用等体积(200 μL)无菌水洗3次后,用50 μL无菌水重悬菌体,然后取1 μL菌体作为PCR模板,并以重组质粒pPIC9K-hAChE作为阳性对照模板。反应体系按照宝生物工程(大连)有限公司的EasyTaq酶说明书进行,并将PCR产物进行核酸电泳鉴定。
1.2.4 重组酵母GS115/pPIC9K-hAChE的诱导表达
将菌落PCR鉴定为阳性的GS115/pPIC9K-hAChE重组酵母接种于50 mL BMGY中,在30℃条件下振荡培养至D(600 nm)=2.0~6.0,于室温、3 000g条件下离心5 min,弃上清液,菌体用BMMY重悬至D(600 nm)=1.0。上述菌悬液于30℃条件下继续培养,每12 h取样3 mL,同时补加无水甲醇至占终体积的0.5%,诱导表达144 h后,以1×104r/min离心10 min,收集发酵上清液,经三氯乙酸(trichloroacetic acid,TCA)沉淀后,以浓缩胶5%、分离胶12.5%进行十二烷基磺酸钠-聚丙烯酰胺凝胶电 泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析,并用Bradford法测蛋白浓度[21-22]。
1.2.5 表达产物的纯化
根据ExPASy数据库(Compute pI/Mw tool)信息得知,hAChE蛋白的等电点为5.87,因此,采用阴离子交换层析法对表达产物进行纯化。为了从发酵液中得到纯度更高的hAChE目的蛋白,本研究使用QSepharose FF阴离子交换层析柱进行纯化,然后用Sephadex G-25进行脱盐处理。Q-Sepharose FF阴离子交换层析柱先经过0.1 mol/L Tris-HCl(pH 8.5)缓冲液进行预平衡。将离心后的发酵上清液上柱后,用分别含0.1、0.2、0.3、0.4、0.5 mol/L NaCl的0.1 mol/L Tris-HCl(pH 8.5)缓冲液梯度洗脱,平均流速1.2 mL/min,分别收集各峰的产物,并进行SDSPAGE检测。将含目的蛋白的收集产物用Sephadex G-25进行脱盐处理。纯化脱盐后的产物用Bradford法进行蛋白浓度的测定[21-22]。
1.2.6 重组酵母表达产物酶活测定
酶活性测定参照改进的Ellman法[23-24]。作为底物的碘化硫代乙酰胆碱被乙酰胆碱酯酶分解为乙酸和硫代胆碱,接着硫代胆碱与5,5´-二硫代双(2-硝基苯甲酸)[5,5´-dithiobis-(2-nitrobenzoic acid),DTNB]作用,生成一种黄色的络合物,然后利用酶标仪在412 nm波长处测其光密度值。由酶促反应的初速率来确定酶活性。具体操作步骤如下:分别吸取64 μL发酵表达上清液和16 μL磷酸钠缓冲液(0.1 mol/L,pH 7.4),加入96孔板中,充分混匀,于30 ℃条件下孵育15 min后,立即加入 20 μL 1.25 mmol/L Ellman试 剂(1.25 mmol/L ATChI,1.25 mmol/L DTNB,0.1 mol/L磷酸钠缓冲液,pH 7.4)后混匀,并立即将混合液置于酶标仪中,在412 nm波长处进行比色,每隔30 s读数一次,连续测定3 min。根据1 min内在412 nm处值的变化来计算酶活力。以80 μL磷酸钠缓冲液加20 μL 1.25 mmol/L Ellman试剂的混合液作为空白对照。酶活力单位(U)定义为每分钟产生1 nmol硫代胆碱为1个酶活力单位。酶活力用体积比酶活来衡量。计算公式如下:
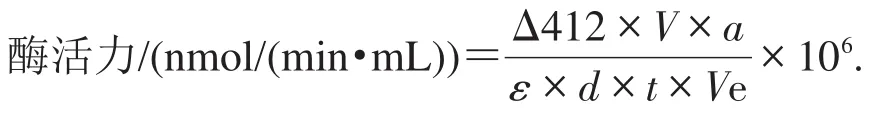
式中:Δ412为在412 nm处反应前后吸光度的变化值;a为酶的稀释倍数;ε为消光系数[1.36×104L/(mol·cm)];t为反应时间,min;d为光程,cm;V为反应体系总体积,mL;Ve为反应体系中酶液的体积,mL。
1.2.7 农药敏感性试验
用0.1 mol/L pH 7.4磷酸钠缓冲液分别将8种农药标准品配成1 mg/mL的母液,并用磷酸钠缓冲液(0.1 mol/L,pH 7.4)分别进行逐级梯度稀释,最终配制成一系列反应梯度为1、1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6mg/mL的农药反应液。取每种质量浓度农药反应液16 μL代替1.2.6中酶活测定反应体系中的磷酸钠缓冲液,于30℃条件下孵育15 min后,立即加入 20 μL 1.25 mmol/L Ellman 试剂,充分混匀后,立即将混合液置于酶标仪中,在412 nm波长处进行比色,每隔30 s读数一次,连续测定3 min。以16 μL对应农药反应液+64 μL磷酸钠缓冲液+20 μL 1.25 mmol/L Ellman试剂作为每次测定的空白对照。以磷酸钠缓冲液代替农药反应液作为无农药抑制酶活对照。计算每种农药的酶活抑制率,比较每种农药的半抑制浓度(50%inhibitory concentration,IC50)。

式中:E1为未加农药时对照组反应体系的酶活;E2为有农药抑制时反应体系的酶活。
根据每种农药系列质量浓度梯度对hAChE发酵上清液的酶抑制率,绘制每种农药质量浓度-酶抑制率曲线,由此比较得出8种农药对hAChE的IC50大小。
2 结果与分析
2.1 hAChE基因克隆结果
采用特异性引物F1和R1,以pReceiver-M02-hAChE-ORF质粒为模板,经过高保真酶Prime-STAR HS DNA聚合酶特异性PCR扩增后,得到约1.8 kb大小条带,与预期大小相符(图1)。

图1 hAChE基因的PCR扩增产物Fig.1 Amplified PCR product of hAChE gene
2.2 表达载体pPIC9K-hAChE的构建分析
由于在hAChE基因中不包含pPIC9K多克隆位点处的常用酶切位点,因此本研究使用传统的酶切连接方法将hAChE基因克隆至pPIC9K载体上。重组载体pPIC9K-hAChE构建完成后,将经菌落PCR验证为阳性转化子(图2)的测序结果用Lasergene软件中的MegAlign程序进行序列比对分析,结果表明,目的基因与从NCBI数据库中下载序列的一致性达100%。证明在PCR过程中没有引入碱基突变,目的片段为人乙酰胆碱酯酶基因,载体构建与预期结果相符。同时,生物信息学分析表明,该基因编码614个氨基酸,蛋白质分子质量为65 kDa,等电点为5.87。

图2 重组表达载体pPIC9K-hAChE阳性菌落的PCR鉴定结果Fig.2 PCR identification result of recombinant expression vector pPIC9K-hAChE positive colony
2.3 表达载体pPIC9K-hAChE的转化与筛选分析
将线性化的pPIC9K-hAChE电转GS115后,经MD平板筛选His+重组转化子,该重组转化子再分别经0.25、1.00、2.00、4.00 mg/mL的G418筛选,结果如图3所示:随着G418抗性梯度增加,克隆数逐步减少,最终从4.00 mg/mL G418培养基上筛选到了具有抗性的高拷贝重组菌株。
2.4 重组酵母GS115/pPIC9K-hAChE菌落的PCR鉴定结果
从含4.00 mg/mL G418的YPD平板上挑取高拷贝单克隆,以特异性引物F1和R1进行菌落PCR鉴定,结果扩增出一条1.8 kb大小的条带(图4),大小与预期相符。表明pPIC9K-hAChE已经整合到酵母染色体上。

图3 重组酵母GS115/pPIC9K-hAChE的G418抗性平板筛选结果Fig.3 Screening results of G418 resistant plates of recombinant yeast GS115/pPIC9K-hAChE

1:DL2000 DNA标志物;2:重组hAChE抗性酵母菌株阳性菌落的PCR产物。1:DL2000 DNA marker;2:Positive colony PCR product of recombinant hAChE resistant yeast strain.
2.5 hAChE重组蛋白的表达与纯化分析
重组表达菌株GS115/pPIC9K-hAChE在0.5%甲醇、30℃条件下诱导表达144 h,每12 h进行取样,同时补加无水甲醇至占终体积为0.5%,以1×104r/min离心5 min,收集发酵表达上清液。取1 mL上清液进行TCA沉淀处理,进行SDS-PAGE蛋白分析。结果(图5)表明,在65 kDa处有重组蛋白条带出现,与预期蛋白相对分子质量大小相符,且在144 h处蛋白表达量最高。由图6可知,从96 h后发酵上清液的酶活趋于稳定。取表达量最高的144 h处的发酵上清液进行Q-Sepharose FF阴离子交换层析柱纯化,结果(图7)表明,纯化效果较理想。用Bradford法对发酵上清液中蛋白质量浓度测定表明,菌株GS115/pPIC9K-hAChE的总蛋白质量浓度为23.825 mg/mL,纯化后的蛋白质量浓度为1.330 mg/mL,占总蛋白的5.58%。纯化后的hAChE比酶活达到1 080 nmol/(min·mL)。
2.6 农药敏感性试验结果
如图8所示,计算8种常见农药对hAChE酶的抑制率,得出8种农药对hAChE的IC50,从大到小依次为敌百虫>敌敌畏>克百威>马拉硫磷>乐果>甲胺磷>甲萘威>毒死蜱。说明该酶对毒死蜱最敏感。
3 讨论
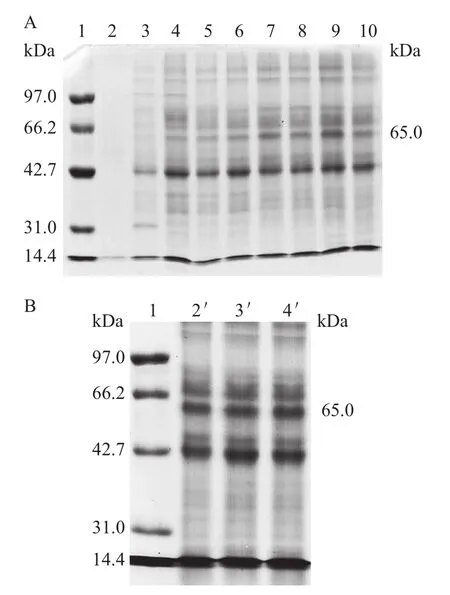
图5 发酵上清液蛋白的SDS-PAGE分析Fig.5 SDS-PAGE analysis of fermentation supernatant protein
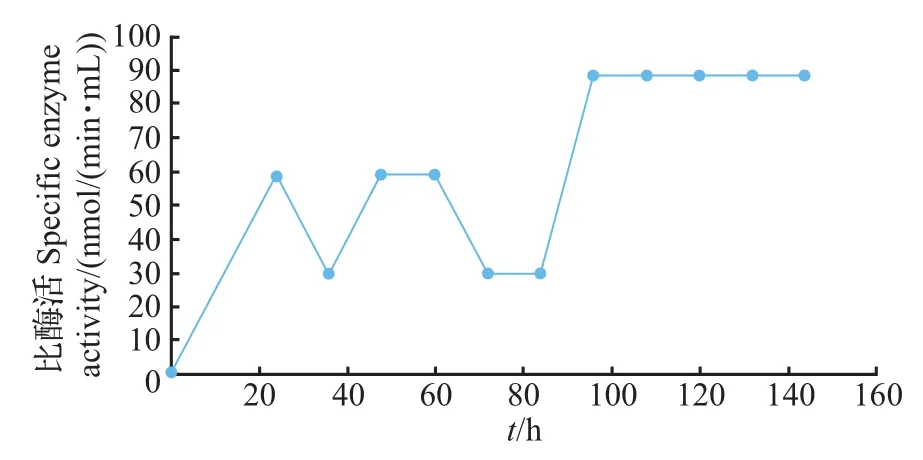
图6 发酵上清液酶活-时间曲线Fig.6 Enzyme activity-time curve of fermentation supernatant
酶抑制法是通过一种逆向思维的方法来检测在农药中占主要比例的有机磷和氨基甲酸酯类农药的方法[25-26]。由于有机磷及氨基甲酸酯类杀虫剂能特异性抑制乙酰胆碱酯酶的活性,阻断乙酰胆碱的水解,使乙酰胆碱在突触间隙积累并引起昆虫中毒死亡,因此,乙酰胆碱酯酶是有机磷及氨基甲酸酯类杀虫剂的作用靶标。目前,影响该方法大量推广的主要原因是酶的来源有限,而且产量低,对农药的敏感性不高等。而经真核或原核表达体系可生产具有生物学活性的重组人乙酰胆碱酯酶[27]。其中毕赤酵母真核表达体系在蛋白质表达方面具有高密度发酵培养、可分泌表达和利于纯化、外源基因表达稳定、启动子强度大、表达量高和糖基化程度低等优点而得到越来越广泛的应用[28]。
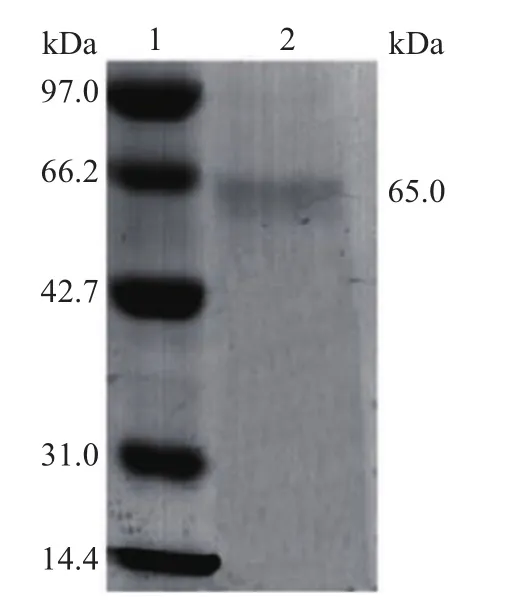
图7 纯化后的目的蛋白的SDS-PAGE分析Fig.7 SDS-PAGE analysis of purified target protein

图8 8种常见农药对hAChE抑制率大小比较Fig.8 Comparison of inhibitory rates of eight common pesticides on hAChE
本实验通过毕赤酵母表达系统获得了人乙酰胆碱酯酶,为了更好地将其运用到农药残留快速检测领域,对其酶活大小和其对农药的敏感性进行了测定。由于同一种酶对不同种类的农药敏感性不同,因此,为了更准确地表征该酶源的农药敏感性,本实验针对市面上最常见的8种农药标准品进行了农药敏感性测定。
由于目前利用基因工程发酵手段大量生产敏感型乙酰胆碱酯酶技术还存在酶活不高、酶稳定性差和酶纯度低等问题,所以基于本实验的研究结果,下一步将利用体外定点突变技术从酶活、稳定性方面进一步提升酶的性能,为食品中农药残留快速检测技术的工业化应用提供更优质的酶源。
4 结论
本文通过构建人乙酰胆碱酯酶基因高效表达工程菌,在实验室阶段进行甲醇诱导表达,并对发酵上清液进行初步纯化和SDS-PAGE分析,结果发现,在65 kDa处有特异性蛋白条带出现,大小与预期结果相一致。用Bradford法测得发酵上清液中hAChE蛋白质量浓度为1.330 mg/mL,占总蛋白的5.58%;纯化后的hAChE比酶活达到1 080 nmol/(min·mL)。通过初步计算比对该重组工程菌发酵上清液对8种常见农药的IC50,得出敌百虫>敌敌畏>克百威>马拉硫磷>乐果>甲胺磷>甲萘威>毒死蜱,即本实验获得的人乙酰胆碱酯酶对毒死蜱最敏感。
