COPD对非小细胞肺癌临床特点及病理类型的影响
2019-07-06张学培李建国
张学培 李建国

【摘要】目的分析COPD与非小细胞肺癌(NSCLC)的临床关系,探究COPD对NSCLC病理类型的影响。方法收集327例原发性NSCLC患者的临床及病理资料,按患者是否合并COPD分为单纯NSCLC组242例和COPD合并NSCLC组85例,分析2组患者的一般资料、胸部CT、肺功能及病理特征的差异。另按患者肿瘤病理类型分为非鳞癌组226例和鳞癌组101例,应用Logistic回归分析NSCLC患者病理类型为鳞癌的影响因素。结果与单纯NSCLC组患者相比,COPD合并NSCLC组患者的年龄偏大、BMI较低,男性、有吸烟史者、合并肺气肿者、临床分期W期者比例较高(P均<0.05),FEV1、FEV,占预计值比例、FVC、FVC占预计值比例、FEV1/FVC均较低(P均<0.05)。单纯NSCLC组病理类型以腺癌居多,而COPD合并NSCLC组以鳞癌居多,2组的NSCLC病理类型構成比较差异有统计学意义(P<0.05)。多因素Logistic回归分析显示,有吸烟史(OR=5.993,95%CI 3.096~11.599,P<0.05)、FEV,占预计值<80%(OR=1.814,95%CI 1.197~2.749,P<0.05)是NSCLC病理类型为鳞癌的危险因素。结论COPD与NSCLC在临床特征上关系密切,有吸烟史及FEV,占预计值比例低是NSCLC病理类型为鳞癌的危险因素。
【关键词】慢性阻塞性肺疾病;临床特征;气道阻塞程度;鳞状细胞肺癌
原发性支气管肺癌(肺癌),是最常见的恶性肿瘤,占全部肿瘤的11.6%,同时也是病死率居首位的恶性肿瘤,5年总体生存率仅17%左右,每年有超过一百万人死于肺癌[1-2]。COPD是一种以持续性气流受限为特征的慢性炎症性疾病,是常见的慢性呼吸系统疾病。据估计,至2020年,全球将有超过3亿人催患COPD,COPD将跃居全球人口患病率及死亡病因的第3位[3-4]。由此可见,肺癌及COPD不仅严重危害着人类健康,还带来了巨大的经济和社会负担。多项研究显示,COPD和肺癌之间密切相关[5-7]。COPD是发生肺癌的危险因素,特别是鳞状上皮细胞癌的独立危险因素[6]。COPD对肺癌的生存率也造成了巨大负面影响,有研究显示合并COPD的晚期非小细胞肺癌(NSCLC)患者中位生存期为224d,较无合并COPD的NSCLC患者减少115d[7]。NSCLC分为鳞癌和非鳞癌2大类,鳞癌占20%~30%,非鳞癌包括腺癌、大细胞癌和其他类型,占70%~80%。鳞癌的一个重要临床特征就是其与吸烟的关联程度较非鳞癌更强,与吸烟相关疾病如COPD的关系更紧密[8-9]。日本的一项研究显示,在吸烟的NSCLC患者中,合并COPD使发生鳞癌的风险增加约3倍[10]。我国台湾地区的一项大样本研究显示,合并COPD的男性和女性群体罹患鳞癌的风险分别增加了1.66倍和1.44倍[11]。目前关于COPD和鳞癌的临床研究仍有限,本研究将结合我院相关病例的临床及病理资料,进一步探究COPD与NSCLC的临床关系,同时探究COPD等因素对NSCLC病理类型为鳞癌的影响。
对象与方法
一、研究对象
在2015年6月至2018年6月中山大学孙逸仙纪念医院收治的初诊原发性NSCLC患者中,选择经病理活组织检查(活检)确诊为原发性NSCLC,并已行肺功能及胸部CT检查者。排除合并其他系统肿瘤者、肺功能检查配合欠佳者及临床资料不完整者。研究共纳入327例原发性NSCLC患者。所纳入病例均已征得患者或家属知情同意,本研究已通过医院医学伦理委员会批准。
二、诊断标准
参照2017年美国国立综合肿瘤网络(NCCN)肿瘤学临床实践指南进行原发性NSCLC的诊断及分期阳]。应用2018年《慢性阻塞性肺疾病防治全球倡议》(GOLD)进行COPD的诊断及气流受限严重程度分级[4]。
三、研究方法
查阅患者病历,收集其性别、年龄、吸烟史、职业史、临床症状体征、胸部CT报告(肿瘤部位、肿瘤最大径、有无恶性淋巴结转移、有无胸水、是否合并肺气肿)、肺功能测定指标(BMI、FEV1、FEV1占预计值比例、FVC、FVC占预计值比例、FEV1/FVC)及肿瘤病理类型。根据患者是否合并COPD分为单纯NSCLC组242例和COPD合并NSCLC组85例。比较单纯NSCLC组和COPD合并NSCLC组患者人口学特征、临床特征,并进行病理类型为鳞癌的影响因素分析。
四、统计学处理
采用SPSS 20.0进行数据统计分析。首先对资料进行统计描述,计量资料若分布对称,采用x±s表示,组间比较采用,检验,若分布不对称,采用中位数(四分位数间距)表示,组间比较采用Wilcoxon秩和检验;计数资料采用例数(百分比)表示,其中无序分类资料组间比较采用χ2检验,等级资料组间比较采用Wilcoxon秩和检验。应用多因素Logistic回归分析NSCLC病理类型为鳞癌的影响因素。P<0.05为差异有统计学意义。
结果
一、COPD合并NSCLC组和单纯NSCLC组患者的人口学特征比较
327例原发性NSCLC患者中,男231例(71%)、女96例(29%),年龄63(14)岁,有吸烟史196例,BMI(22.9±1.50)kg/m2。与单纯NSCLC组患者相比,COPD合并NSCLC组患者的年龄偏大、男性及有吸烟史者比例较多、BMI较低(P均<0.05),见表1。
二、单纯NSCLC组和COPD合并NSCLC组患者的临床特征比较
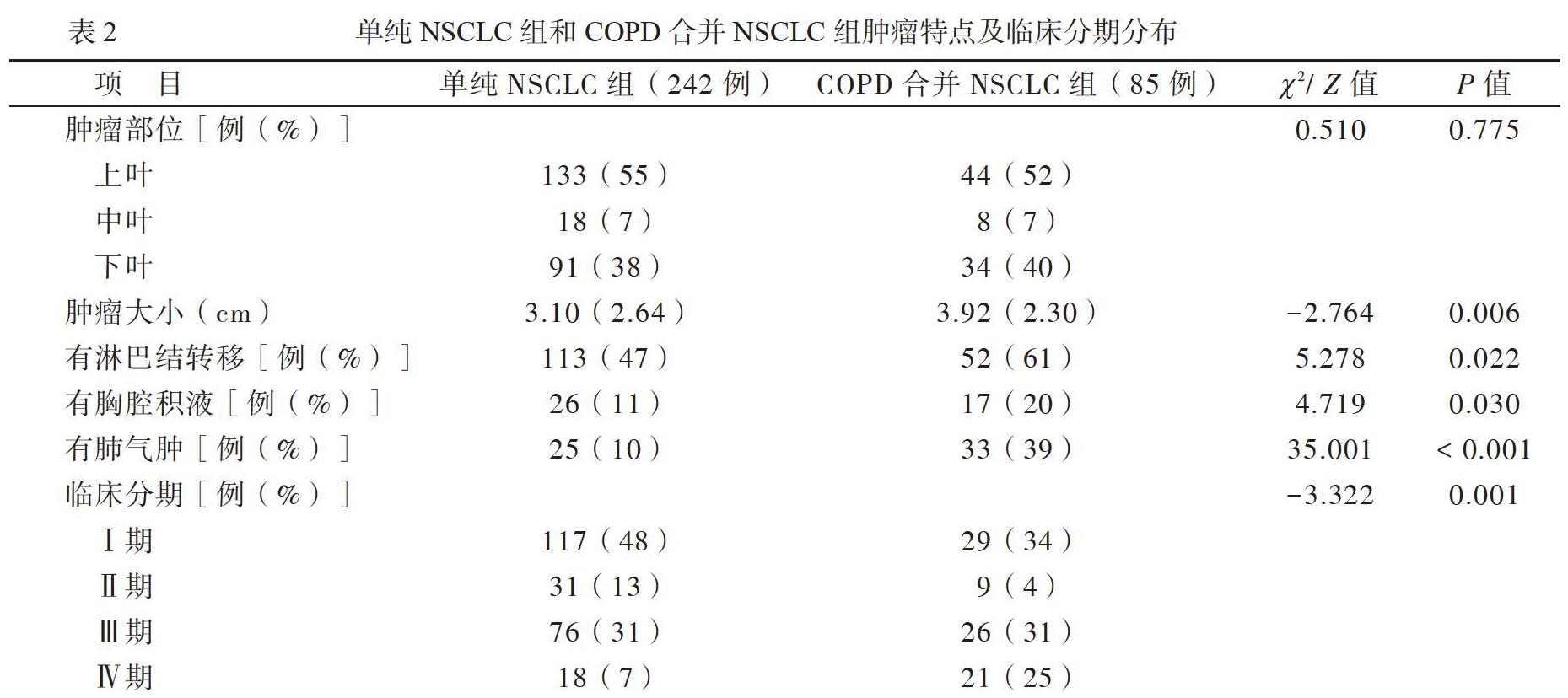
1.2组NSCLC患者的肿瘤分布部位、合并症及临床分期分布
327例原发性NSLCL患者中,肿瘤位于上叶、中叶、下叶分别为177例(54%)、25例(8%)、125例(38%),肿瘤大小3.29(2.69)cm,有淋巴结转移162例(50%)、胸腔积液43例(13%)、肺气肿58例(18%),临床分期Ⅰ期146例(45%)、Ⅱ期40例(12%)、Ⅲ期102例(31%)、Ⅳ期39例(12%)。与单纯NSCLC组相比,COPD合并NSCLC组患者合并肺气肿者、中晚期(Ⅲ~Ⅳ期)者比例较高(P均>0.05)。
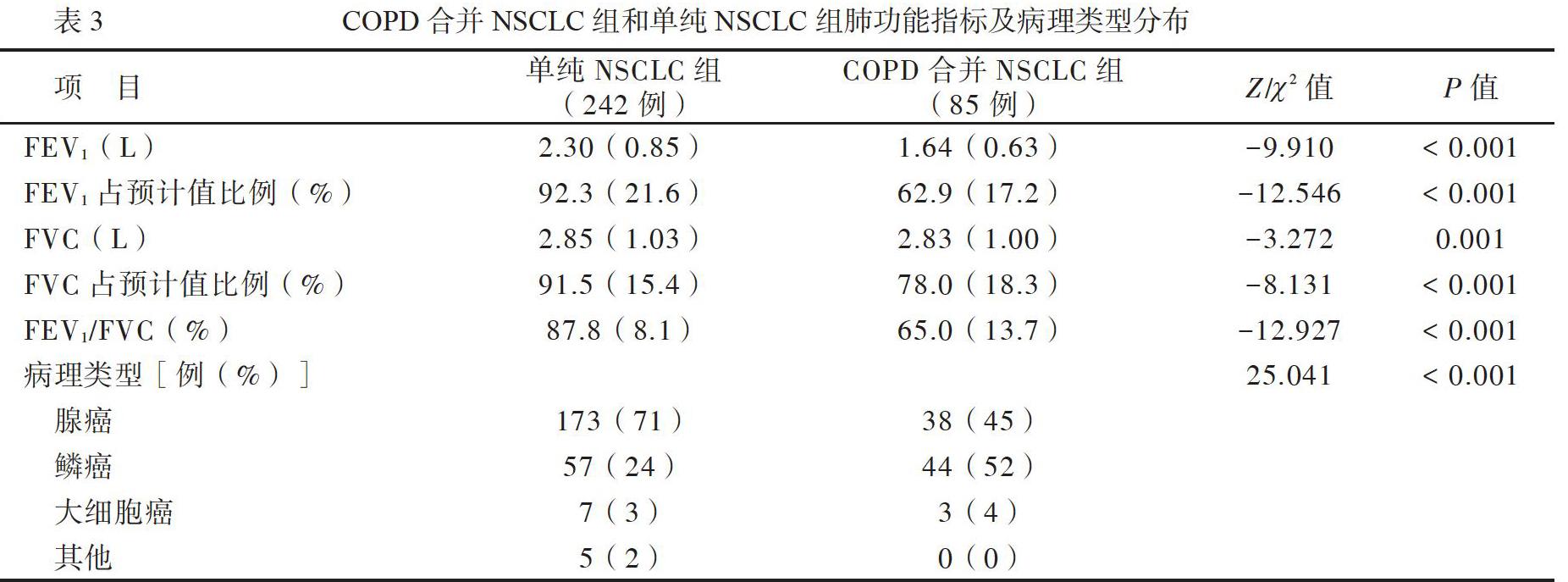
2.2组NSCLC患者的肺功能指标及病理类型分布
327例原发性NSLCL患者中,FEV12.10(0.52)L,FEV1占预计值比例86.2(25.8)%,FVC 2.83(0.90)L,FVC占预计值比例88.0 (18.0)%,FEV1/FVC 80.0(14.5)%,病理类型为腺癌211例(65%)、鳞癌101例(31%)、大细胞癌10例(3%)、其他5例(2%)。与单纯NSCLC组比较, FEV1、FEV1占预计值比例、FVC、FVC占预计值比例、FEV1/FVC均较低(P均<0.05)。单纯NSCLC组病理类型以腺癌居多,而COPD合并NSCLC组以鳞癌居多,2组NSCLC患者病理类型比较差异有统计学意义(P<0.05),见表3。
三、病理类型为鳞癌的影响因素分析
1.单因素分析
将纳入的NSCLC患者分为非鳞癌组和鳞癌组,其中非鳞癌组226例、鳞癌组101例。单因素分析显示,男性、高龄、有吸烟史、合并肺气肿、临床分期高、BMI低、FEV1、FEV1占预计值比例和FEV1/FVC及FVC占预计值比例低、合并COPD是NSCLC的病理類型为鳞癌的危险因素(P均>0.05),见表4。
2.多因素Logistic回归分析
有吸烟史(OR=5.993,95%CI 3.096~11.599,P<0.05)、FEV1占预计值<80%(OR=1.814,95%CI 1.197~2.749,P<0.05)是NSCLC病理类型为鳞癌的危险因素,见表So性别、年龄、吸烟史、合并肺气肿、临床分期、BMI、FEV1、FEV1/FVC及FVC与NSCLC的病理类型为鳞癌无关(P均>0.05)。
讨论
多项研究显示,COPD是肺癌的重要危险因素,合并COPD的肺癌患者患病率及病死率均高于未合并者[5-7]。本研究显示,与单纯肺癌组相比,COPD合并肺癌组患者年龄偏大、男性比例更高、80%以上患者有吸烟史,且BMI偏低、合并肺气肿者比例更高,气道阻塞程度更严重,这与在日本人群中的2项研究结果相符[12-13]。本研究中,NSCLC患者女性仅占29%,COPD合并肺癌组女性仅占12%,且女性COPD合并肺癌患者中仅有3例既往有吸烟史。吸烟是肺癌和COPD重要的共同危险因素,肺癌及COPD在不同性别中患病率差异悬殊,这与我国吸烟者主要集中在男性群体,而绝大部分女性无吸烟史有很大关系队[14]。
肺癌中,腺癌是最常见的病理类型,且其所占比例在非吸烟人群中逐步增长[8]。本研究所纳入的NSCLC患者中,也是以腺癌为主。但在COPD合并肺癌组患者中,鳞癌所占的比例最高,达52%,这与国外的一项研究发现的合并COPD的肺癌患者中鳞癌所占的比例最高(56.33%)的结果高度一致[15]。蔡静静等[16]的回顾性研究中也显示COPD合并肺癌组患者中鳞癌比例最高,达43.9%。有研究对COPD与鳞癌之间密切关系的机制进行了总结,特别是对烟草相关的COPD和鳞癌之间可能的致病分子联系进行了全面分析,主要涉及基因、炎症和免疫方面[17]。
目前,关于COPD与鳞癌的临床研究尚不多。为此,本研究进一步探究在同时存在其他因素影响下COPD是否为NSCLC病理类型为鳞癌的危险因素。单因素分析显示,男性、高龄、有吸烟史、肺气肿、临床分期高、BMI低、FEV1和FEV1占预计值比例及FEV1/FVC与FVC占预计值比例下降、合并COPD是NSCLC的病理类型为鳞癌的危险因素。本研究多因素分析显示,有吸烟史、FEV1占预计值<80%是COPD合并NSCLC病理类型为鳞癌的危险因素。
FEV1的下降不仅是COPD严重程度的标志,也是普通人群肺癌、心血管疾病和过早死亡风险增加的预测因子。有研究表明FEV1的下降是NSCLC预后不良的独立危险因素[18-21]。本研究显示,FEV1占预计值<80%是NSCLC病理类型为鳞癌的独立危险因素,与上述研究结果相符。Papi等[10]研究显示,吸烟患者中,COPD是肺癌病理类型为鳞癌的独立危险因素,FEV、占预计值比例与鳞癌的发生风险无关。本研究单因素分析显示,COPD和FEV1占预计值比例均是NSCLC病理类型为鳞癌的危险因素,且FEV1占预计值比例<80%是其独立危险因素,而不是COPD。这一矛盾结论还需要更多关于COPD与鳞癌的临床研究去进一步验证。
本研究存在着一些局限及不足之处:首先,本研究是单中心研究,不能完全代表所有NSCLC患者临床特点。其次,研究将肿瘤部位按其所在肺叶进行划分,结果显示肿瘤部位与鳞癌发生风险无关,但鳞癌的其中一个重要临床特点是以中央型肺癌多见,因此若将肿瘤部位按中央型肺癌与周围型肺癌进行分类,可能得出肿瘤部位与鳞癌相关的结论。这需要我们与影像专科医师共同努力进一步完善肺癌胸部CT特点的相关资料进一步探究。
綜上所述,本研究通过对COPD合并肺癌组与单纯肺癌组临床资料的比较,进一步证实了COPD与NSCLC两者之间的密切关系。多种因素影响NSCLC病理类型,其中有吸烟史及FEV1占预计值比例低是NSCLC病理类型为鳞癌的危险因素。
参考文献
[1]Bray F,Ferlay J,Soerjomataram I,Siegel RL,Torre LA,Jemal A.Global cancer statistics 2018:GLOBOCAN estimatesof incidence and mortality worldwide for 36 cancers in 185countries.CA Cancer J Clin,2018,68(6):394-424.
[2]Vachani A,Sequist LV,Spira A.AJRCCM:100-year anniversary.The shifting landscape for lung cancer: past,present,and future.Am J Respir Crit Care Med,2017,195(9):1150-1160.
[3]Chan KY,Li X,Chen W,Song P,Wong NWK,Poon AN,Jian W,Soyiri IN,Cousens S,Adeloye D,Sheikh A,CampbellH,Rudan I;Global Health Epidemiology Research Group(GHERG).Prevalence of chronic obstructive pulmonary dise-ase(COPD)in China in 1990 and 2010.J Glob Health,2017,7(2):020704.
[4]Mirza S,Clay RD,Koslow MA,Scanlon PD.COPD guidelines:a review of the 2018 GOLD report.Mayo Clin Proc,2018,93(10):1488-1502.
[5]Stallberg B,Janson C,Johansson G,Larsson K,Stratelis G,Telg G,Lisspers KH.Management,morbidity and mortality ofCOPD during an 11-year period:an observational retrospectiveepidemiological register study in Sweden(PATHOS).PrimCare Respir J,2014,23(1):38-45.
[6]Durham AL,Adcock IM.The relationship between COPD andlung cancer.Lung Cancer、2015,90(2):121-127.
[7]Yi YS,Ban WH,Sohng KY.Effect of COPD on symptoms,quality of life and prognosis in patients with ad,anced non-smallcell lung cancer.BMC Cancer、2018,18(1):1053.
[8]Ettinger DS,Wood DE,Aisner DL,Akerley W,BaumanJ,Chirieac LR,DAmico TA,DeCamp MM,Dilling TJ,Dobelbower M,Doebele RC,Govindan R,Gubens MA,Hennon M,Horn L,Komaki R,Lackner RP,Lanuti M,LealTA,Leisch LJ,Lilenbaum R,Lin J,Loo BW Jr,MartinsR,Otterson GA,Reckamp K,Riely GJ,Schild SE,ShapiroTA,Stevenson J,Swanson SJ,Tuner K,Yang SC,GregoryK,Hughes M.Non-Small Cell Lung Cancer,Version 5.2017,NCCN Clinical Practice Guidelines in Oncology.J Natl ComprCane Netw,2017,15(4):504-535
[9]Socinski MA,Obasaju C,Gandara D,Hirsch FR,BonomiP,Bunn P,Kim ES,Langer CJ,Natale RB,Novello S,Paz-Arcs L,Perol M,Reek M,Ramalingam SS,Reynolds CH,Spigel DR,Stinchcombe TE,Wakelee H,Mayo C,ThatcherN.Clinicopathologic features of advanced squamous NSCLC.JThorac Oncol,2016,11(9):1411-1422.
[10]Papi A,Casoni G,Caramori G,Guzzinati I,Boschetto P,Ravenna F,Galia N,Petruzzelli S,Corbetta L,Cavallesco G,Forini E,Saetta M,Ciaccia A,Fabbri LM.COPD increases therisk of squamous histological subtype in smokers who developnon-small cell lung carcinoma.Thorax,2004,59(8):679-681.
[11]Huang JY,Jian ZH,Nfor ON,Ku WY,Ko PC,Lung CC,HoCC,Pan HH,Huang CY,Liang YC,Liaw YP.The effects ofpulmonary diseases on histologic types of lung cancer in bothsexes:a population-based study in Taiwan.BMC Cancer,2015,15:834.
[12]Hashimoto N,Matsuzaki A,Okada Y,Imai N,Iwano S,WakaiK,Imaizumi K,Yokoi K,Hasegawa Y.Clinical impact ofprevalence and severity of COPD on the decision-making processfor therapeutic management of lung cancer patients.BMC PulmMed,2014,14:14.
[13]Omote N,Hashimoto N,Morise M,Sakamoto K,Miyazaki S,Ando A,Nakahara Y,Hasegawa Y.Impact of mild to moderateCOPD on feasibility and prognosis in non-small cell lung cancerpatients who received chemotherapy.Int J Chron ObstructPulmon Dis,2017,12:3541-3547.
[14]Liu S,Zhang M,Yang L,Li Y,Wang L,Huang Z,Wang L,Chen Z,Zhou M.Prevalence and patterns of tobacco smokingamong Chinese adult men and women:findings of the 2010national smoking survey.Epidemiol Community Health,2017,71(2):154-161.
[15]de Torres JP,Marin JM,Casanova C,Cote C,Carrizo S,Cordoba-Lanus E,Baz-Davila R,Zulueta JJ,Aguirre-JaimeA,Saetta M,Cosio MG,Celli BR.Lung cancer in patientswith chronic obstructive pulmonary disease——incidence andpredicting factors.Am J Respir Crit Care Med,2011,184(8):913-919.
[16]蔡静静,苗健龙,周金花,张影影,刘瑞娟.慢性阻塞性肺疾病合并肺癌的临床特点分析.临床荟萃,2017,32(12):1065-1068.
[17]Bozinovski S,Vlahos R,Anthony D,McQualter J,AndersonG,Irving L,Steinfort D.COPD and squamous cell lung cancer:aberrant inflammation and immunity is the common link.Br JPharmacol,2016,173(4):635-648.
[18]Kang HS,Shin AY,Yeo CD,Kim JS,Kim YH,Kim JW,Lee SH.A lower level of forced expiratory volume in one secondpredicts the poor prognosis of small cell lung cancer.J ThoracDis,2018,10(4):2179-2185.
[19]Shibata Y,Inoue S,Igarashi A,Yamauchi K,Abe S,Aida Y,Nunomiya K、Sato M,Nakano H,Sato K,Nemoto T,Kimura T,Watanabe T,Konta T,Daimon M,Ueno Y,Kato T,Kayama T,Kubota 1.A lower level of forced expiratory volume in 1 secondis a risk factor for all-cause and cardiovascular mortality in aJapanese population:the Takahata study.PLoS One,2013,8(12):e83725.
[20]Menezes AM,Perez-Padilla R,Wchrmeister FC,Lopez-VarelaMV,Muino A,Valdivia G,Lisboa C,Jardim JR,de OcaMM,Talamo C,Bielemann R,Gazzotti M,Laurenti R,CelliB,Victora CG:PLATING team.FEV、is a better predictor ofmortality than FVC:the PLATING cohort study.PLoS One,2014,9(10):e109732.
[21]陈卫军,陈岸,梁兆惺,张继平.肺功能检测在吸烟人群中肺癌筛查的作用.新医学,2013,44(2):101-104.
(收稿日期:2019-02-04)
(本文编辑:林燕薇)
DOI:10.3969/j.issn.0253-9802.2019.05.012
基金項目:广州市科技计划项目(201604020103)
作者单位:510120 广州,中山大学孙逸仙纪念医院呼吸内科
通信作者,李建国,E-mail:jgli88@126.com
