基于不同频段时频特征的阿尔兹海默症脑功能异常分析*
2019-06-24高大川曾佑琴张建炜
周 川,高大川,钱 丽,文 萍,曾佑琴,张建炜
成都医学院 人文信息管理学院(成都 610500)
随着社会老龄化程度的逐渐加重,阿尔兹海默症(Alzheimer's disease,AD)发病率迅猛上升[1]。AD是一种慢性神经退化性疾病,其神经病理学特征是β-淀粉样蛋白斑块和tau蛋白构成的神经原纤维缠结在脑内沉积[2],伴随着一系列脑功能异常症状,包括:记忆障碍、认知能力障碍、语言障碍以及情绪障碍等[3]。静息态功能磁共振成像(resting-statefunctional magnetic resonance imaging,rs-fMRI)作为一种非侵入式成像方法,可反映脑内神经元的自发活动。因此,该技术已广泛应用于研究AD的脑功能异常[4-5]。
目前,大多数文献[6-7]利用rs-fMRI数据具有生理学意义的低频信号(0.01~0.08 Hz),通过计算局部一致性(regional homogeneity,ReHo)或者低频波动幅值(amplitude of low-frequency fluctuation,ALFF)特征图展开研究。本研究则将低频信号分割为更具有生理意义的Slow-5(0.010~0.027 Hz)和Slow-4(0.027~0.073 Hz)两个子频段[8];并分别在两个子频段下,基于信号时频分析理论构建特征图,分析AD和正常被试特征图的组间差异,获得了显著差异脑区,以及脑区内特征值强度与AD临床诊断量表评分之间的关系,从而获得具有病理学意义的AD脑功能异常区域。这些脑区可作为生物标记物,有助于研究者更好理解AD的神经学机制,帮助临床及时诊断和介入治疗AD患者。
1 资料与方法
1.1 临床资料
本研究所采用的rs-fMRI数据均来源于ADNI共享数据库(http://adni.loni.ucla.edu)。包含129名被试者,其中,AD患者70例,正常被试者59例。被试者同时接受了临床诊断量表检测,包括:简易精神状态检测(mini-mental state examination,MMSE)和临床痴呆检测(clinical dementia rating,CDR)。所有的rs-fMRI数据采集工作均符合人体试验伦理学标准,得到了伦理委员会批准,被试者签署了知情同意书。利用GE3.0T核磁共振设备扫描,具体扫描参数如下:TR=3 s;TE=30 ms;翻转角=80°;扫描厚度=3.31 mm;扫描层数=48层;体素大小=3.31 mm×3.31 mm×3.31 mm;扫描时间点=140个。
1.2 方法
1.2.1 数据预处理 每个被试者rs-fMRI数据预处理工作采用静息态数据处理助手软件DPARSF(http://www.restfmri.net/forum/DPARSF)完成,具体步骤如下:1)考虑到被试者刚开始扫描时需适应仪器噪声,以及信号稳定性,去除前10个时间点数据;2)时间层校正;3)头动校正;4)利用DARTEL算法将个体数据标准化到MNI空间;5)图像重采样到3 mm×3 mm×3 mm体素大小;6)进行半宽度为4 mm的高斯平滑滤波;7)为了减小生理学伪影、头动校正和非神经元信号波动对数据的影响,采用多重线性回归分析方法,将全脑信号、白质信号和脑脊液信号的均值以及24个头动参数[9]作为冗余协变量去除。在预处理过程中,还获得了各被试者rs-fMRI数据相邻时间点的逐帧位移量(frame-wise displacement,FD),计算平均FD值用于描述被试者在数据采集时的头动大小,将平均FD>0.2 mm的被试者数据去除[10]。接着,利用带通滤波思想,分别获得Slow-5和Slow-4两个子频段的AD组和正常被试组预处理后数据。
1.2.2 特征图计算 预处理后,任意体素的rs-fMRI信号是由130个时间点构成,利用时频分析理论将其转换为时频分布图,再计算特征值并赋值回该体素,从而获得被试者特征图。而时频分析的核心思想为:通过时频分布函数,将一维时间信号投影到二维的时间-频率坐标系中,从而达到描述信号在不同时间和频率的能量密度或强度变化的目的,对应到神经学中便是描述神经元激活过程中的强度及其分布。现今学术界常用的构建时频分布函数策略有:短时傅里叶变换、小波变换和“魏格纳-威利”变换等。本研究采用“平滑伪魏格纳-威利”分布函数(smoothed pseudo Wigner-Ville distribution,SPWVD)实现时间信号的时频分析[11]。SPWVD函数表达式如式1所示:
式1
其中t表示时间,f表示频率,x(t)指时间信号。此分布函数本质是以t时刻为中心,求解一段长度为τ的时间信号自相关结果。但因为SPWVD函数的非线性函数性质,自相关结果中存在影响分析准确性的干扰信号,并且此干扰信号垂直于时间轴震荡分布。所以在函数中加入一个时间窗口函数h(τ),通过平滑滤波的方式减弱干扰信号。由于h(τ)通常设计为一个短时间窗口函数,具有时域尺度小、频域尺度大的特点,故其滤波结果时间分辨率好,而频率分辨率差。为解决此问题,表达式中又加入一个自由度函数g(s),用于独立调节频率分辨率好坏与干扰信号强弱之间的反比关系。因为rs-fMRI数据是离散形式,所以将式1离散化得到DSPW(p,q)。其中,p和q分别代表离散的时间点和频率点,取从1到M整数。M按如下原则取值:Min[(M=2n,n=1,2,3,L)U(M≥130)],依据是由于SPWVD函数实现过程需进行傅里叶变换,以及本研究所用rs-fMRI数据的时间信号长度为130。此外,p,q,t和f之间的关系为p=t·fs和q=fM/fs。fs指采样频率,本研究中fs=1/TR。
时频分析结果DSPW(p,q)可视为一幅M×M大小的时频分布灰度图像。基于直方图扩展原理(spread in the histogram of image,SHI)计算图像的特征值,用于描述体素rs-fMRI信号的频率随时间波动的特性,并赋值回该体素。SHI特征值的计算如式2所示:
式2
其中,cj表示时频分布图中某像素的灰度值,fj表示图中取该灰度值的像素数量,L为图像的灰度级,μ是图像灰度值的平均强度,由式3计算获得:
式3
此外,为了减小体素特征值在不同被试之间的全局效应,在下一步数据分析之前,对所有被试者特征图进行费舍尔Z变换,即:各体素的特征值减去全脑体素特征值的均值,再除以全脑体素特征值的标准差。
1.3 统计学方法
1.3.1 被试者基本信息统计 采用SPSS 22.0软件对两组被试者基本信息进行统计分析,其中性别采用2检验,年龄、MMSE评分和CDR评分采用双样本t检验。检验水准α除特殊说明外均设定为0.05。
1.3.2 特征图统计分析 利用脑图像数据处理和分析工具箱DPABI(http://rfmri.org/DPABI),对Slow-5和Slow-4两个子频段的AD组和正常被试组特征图分别进行双样本t检验,并将被试者平均FD值、年龄和性别作为协变量,去除其对结果的潜在影响。再采用TFCE结合置换检验的策略(双边P<0.05,体素数>70)进行多重比较校正[12]。最终获得两组被试者特征图在全脑范围内的明显差异区域。为了探讨显著差异脑区与AD临床诊断量表评分之间的线性相关性,以各差异脑区内特征值峰值点为圆心,5 mm为半径,构建球形区域;计算各AD特征图区域内平均特征值,分别与患者的MMSE评分和CDR评分求皮尔森相关系数。同样将平均FD值、年龄和性别作为协变量去除,并设P<0.05为明显线性相关标准。
2 结果
2.1 一般材料
基于头动大小标准,排除了22个头动太大的被试者数据(AD患者15个,正常被试者7个),剩下107个被试者(AD患者55个,正常被试者52个)用于数据分析。并且,由于部分被试者随着病程发展接受了多次rs-fMRI扫描,而初次扫描时未进行临床诊断量表检测,故实际具有MMSE评分和CDR评分的被试者只有53例(其中,AD患者28例,正常被试者25例)。两组被试者的年龄和性别相匹配,差异无统计学意义(P>0.05)(表1)。具有MMSE评分和CDR评分的被试者年龄、性别和临床诊断量表评分情况显示,两组被试者在年龄和性别上相匹配,差异无统计学意义(P>0.05);而MMSE评分和CDR评分差别有统计学意义(P<0.05)(表2)。

表1 全部被试者基本情况比较

表2 具有MMSE和CDR评分的被试者基本情况比较
2.2 特征图组间差异比较
对两组特征图进行双样本t检验和多重比较校正后的结果表明,在Slow-5频段,AD组较正常被试组特征值明显增高的脑区是左脑核间小叶,特征值明显降低的脑区包括右小脑后叶和左脑枕叶舌回(表3、图1)。表中上标为“+”的脑区其AD组特征值<正常被试组,t值为正,在图1中用暖色表示;“-”脑区表示AD组特征值>正常被试组,t值为负,对应图1中的冷色区域;而在Slow-4频段,两组间差异无统计学意义(P>0.05),所以没有差异脑区(图2)。

表3 Slow-5频段两组被试者显著差异脑区
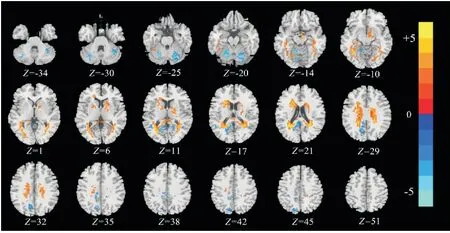
图1 Slow-5频段两组被试者显著差异脑区

图2 Slow-4频段两组被试者显著差异脑区
2.3 显著差异脑区特征值与认知量表值相关性分析
通过相关性分析发现,AD患者的MMSE评分与左脑核间小叶的特征值呈明显正相关(r=0.577,P=0.001),与左脑枕叶舌回的特征值呈明显正相关(r=0.396,P=0.037);而CDR评分与左脑枕叶舌回的特征值呈明显的负相关(r=-0.483,P=0.009)(图3~4)。其中A图是显著差异区域的横切面图,B图为以AD患者临床诊断量表评分和显著差异脑区内平均特征值分别为横坐标和纵坐标的相关性结果散点图。
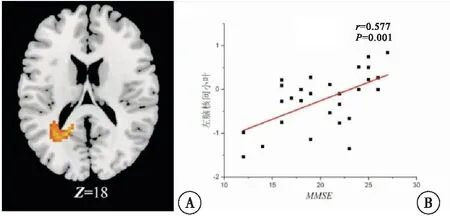
图3 AD患者左脑核间小叶特征值与MMSE评分关系注:A:左脑核间小叶的横切面图;B:AD患者左脑核间小叶内平均特征值与MMSE评分相关的散点图,其中每个点代表1个AD患者
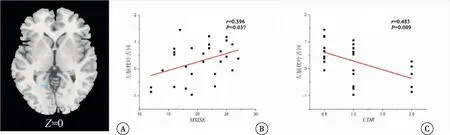
图4 AD患者左脑枕叶舌回特征值与MMSE评分和CDR评分关系注:A:左脑枕叶舌回的横切面图;B:AD患者左脑枕叶舌回的特征值与MMSE相关的散点图;C:AD患者左脑枕叶舌回的特征值与CDR相关的散点图;B、C中每个点代表1个AD患者
3 讨论
rs-fMRI数据能表达血氧依赖水平信号(blood-oxygen-level-dependent signal,BOLD)的低频波动,反映大脑局部神经元活动情况以及不同的生理状态,具有重要的生理学意义。本研究将rs-fMRI低频信号分为Slow-5和Slow-4两个子频段,并基于时频分析技术计算信号特征值,构建特征图。最终,在Slow-5频段发现了AD患者的异常自发脑功能活动。
rs-fMRI的低频信号可表达神经元的自发活动,Buzsáki 等[8]的研究将其细分为4个子频段,分别为:Slow-5(0.01~0.027 Hz)、Slow-4(0.027~0.073 Hz)、Slow-3(0.073~0.198 Hz)和Slow-2(0.198~0.25 Hz),这些子频段信号来源于不同的神经元组,与不同脑功能处理过程相关。其中,Slow-5和Slow-4两个频段的信号振动与灰质的BOLD信号密切相关,因此适用于脑功能障碍与功能处理过程的相关性分析[13]。Egorova等[14]进一步发现,Slow-5频段的振动更适合于检测抑郁症引起的脑功能异常,因为抑郁症患者和正常被试者只在Slow-5频段存在组间差异。此外,有研究[15]提出,Slow-5频段的信号可能对AD引起的大脑自发异常活动更加敏感。这些结论与本研究只在Slow-5频段发现了组间明显差异的结果相一致。
本研究采用了时频分析原理描述子频段的BOLD信号,而大量利用rs-fMRI研究脑功能障碍疾病的文章常采用ReHo和ALFF指标描述BOLD信号。这两种方式仅在时间域或频率域提取信息,但是基于BOLD信号的脑功能异常情况并不是独立存在于单一的维度上,时频分析技术提供了信号在两个维度上的联合分布形式,描述了信号频率随时间变化的能量密度和强度变化,从而可构建最全面描述信号的特征[16],并在脑电研究领域被广泛应用。如Bajaj等[16]利用SPWVD函数对癫痫患者的脑电信号进行了时频分析,并将分析结果根据脑电信号节律分割成不同频带的时频分布图,然后计算特征值,输入到支持向量机分类器,实现了癫痫的自动分类;Boashash等[17]采用时频分析方法,检测新生儿异常大脑活动情况,实现了癫痫的诊断和预后,并从方法论上证明,相比较于仅在时间域或频率域的特征,时频特征能更好描述非稳定信号的变化状态。
在rs-fMRI的研究中,Chang等[18]证实了BOLD信号是非稳定的,会随着时间和频率一起变化,并且给出了后扣带回与其他负相关网络之间的功能连接强度随时间和频率变化的结果,从而为本研究利用时频分析定义BOLD信号特征提供了实验基础。本研究将rs-fMRI数据中每个体素的BOLD信号进行时频分析,获得时频分布图,再利用直方图扩展原理计算其特征值,该特征值可描述信号频率随时间变化的强度波动程度,所以会随着AD患者大脑内出现β-淀粉样蛋白斑块和神经原纤维缠结而发生变化。所有体素的特征值构成特征图,通过AD与正常被试者的组间比较,所获得的显著差异区域包含了AD大脑局部神经元异常活动所引起的BOLD信号变化。
本研究发现,AD患者左脑核间小叶的时频特征值明显高于正常被试者,并与MMSE评分明显正相关。核间小叶在情感加工中扮演了非常重要的角色[19]。因为该脑区位于LCSPT神经环路的皮层-子皮层情感回路中,此回路包括海马、杏仁核和丘脑等区域,被认为与情绪性行为有关[20]。在关于AD脑网络的荟萃分析[21]中,证实这些脑区均存在功能障碍。并且,针对AD临床症状的研究[22]表明,超过半数的AD患者都深受激动和攻击性等不良情绪困扰,这些不良情绪所引发的症状会随着病情发展而日愈严重。本研究一方面进一步证实了上述临床结论,另一方面也可能表明核间小叶作为白质区域在AD的情感回路功能异常问题中发挥着重要的信息传递作用。此外,AD患者通常会伴随出现抑郁问题[23],而在抑郁症研究[20]中,也报道了核间小叶存在功能异常。
本研究结果显示,AD患者左脑枕叶舌回的特征值明显低于正常被试者。舌回是视觉网络的一部分,负责视觉记忆功能[24];并在视空间注意的自上而下过程中,担负控制区域和视觉处理区域之间的信息传递角色[25]。因此,本研究中AD患者左脑枕叶舌回功能活动程度降低的结果,可能揭示了上述信息传递存在不充分的情况,从而导致记忆功能障碍。Phillips等[26]在利用PET影像技术预测AD认知功能改变的研究中发现,以18F作为放射性示踪物,舌回吸收18F的程度主导了对AD患者视空间表现异常的预测,而18F对tau蛋白纤维缠结的沉积又非常敏感,从而说明舌回功能异常会影响AD患者的视空间执行能力,以及舌回功能异常的病理学基础;Li等[27]对36篇任务态fMRI研究AD的文章进行了荟萃分析,总结出相对于正常被试者,AD患者左脑枕叶舌回的神经活动降低。本研究基于静息态fMRI的研究,得到了相同结果,发现AD患者左脑枕叶舌回的时频特征值与MMSE评分正相关,而与CDR明显负相关,说明左脑枕叶舌回的功能活动可作为生物标记物评价AD的病症程度。对于小脑,不仅具有运动功能,还参与了记忆、学习、语言和情感等认知过程[28]。研究[29]显示,AD患者小脑内出现了神经退化性改变,小脑皮层有大量淀粉样斑块形成。其中,小脑后叶在正常被试者执行语言、空间、执行能力和工作记忆等认知任务时都有激活表现[30]。本研究发现,AD患者右小脑后叶自发活动程度明显低于正常被试者,提示了小脑后叶功能活动的改变可能与AD认知功能障碍有关。
综上所述,本研究利用时频分析理论,提取rs-fMRI低频信号特征,并获得了AD患者脑功能异常活动区域。最终发现,在Slow-5频段AD患者的左脑核间小叶、左脑枕叶舌回和右小脑后叶存在自发性脑功能紊乱,并与MMSE和CDR评分线性相关。这些区域涉及情感加工、视觉记忆和视空间执行能力等功能,其异常活动可部分阐述AD的神经病理基础,从而为进一步采用时频分析技术分析rs-fMRI数据提供了经验依据。
