人脂肪间充质干细胞通过抑制小胶质细胞迁移活性对MPP+诱导帕金森细胞模型的保护作用*
2019-06-24胡康安刘漪沦
胡康安,刘漪沦,李 灿,孙 静
1.成都医学院 生物科学与技术学院(成都 610500);2.成都医学院第一附属医院 四川省老年医学临床医学研究中心(成都 610500);3.成都医学院 发育与再生四川省重点实验室(成都 610500)
帕金森病(parkinson's disease,PD)的特征性病理改变为中脑黑质多巴胺能神经元(dopaminergic neurons,DA)变性及坏死而诱发神经炎症反应[1]。小胶质细胞是中枢性神经系统的固有免疫细胞,当DA能神经元损伤时,小胶质细胞迅速活化,并向病损区迁移。小胶质细胞的趋向性迁移是其参与免疫反应的重要基础和前提[2]。研究[3]表明,小胶质细胞及其介导的神经炎症在PD 进展中发挥重要作用。间充质干细胞(mesenchymal stem cells,MSCs)是一种具有多向分化潜能及免疫抑制功能的成体干细胞[4],可调节巨噬细胞M1/M2活化表型,并且MSCs干预炎症性疾病的可行性和有效性已经被证实[5]。本研究旨在通过PD细胞损伤模型及细胞共培养系统,探索hADMSCs干预后的小胶质细胞对DA神经元的存活及功能的影响及其机制。通过调控小胶质细胞炎症表型、调节炎症微环境,有望为PD抗炎策略提供新的视角。
1 材料与方法
1.1 主要试剂
1-Methyl-4-phenyl tetrahydropteridine(MPP+)购于Sigma-Aldrich公司。TUNEL细胞凋亡检测试剂盒购于Roche公司。TH、GAPDH及DAT抗体购于Abcam公司。HRP标记羊抗兔二抗购于武汉博士德生物工程有限公司。ECL发光试剂盒购自Pierce公司。
1.2 主要细胞
实验中应用的MN9D细胞系(BNCC340551)为小鼠多巴胺能神经元细胞,BV2细胞(BNCC102012)为小鼠小胶质细胞,均购自北京北纳创联生物研究院细胞库。
1.3 实验方法
1.3.1 hADMSCs的分离培养 获取成人吸脂术抽取的脂肪组织150 mg,用PBS溶液冲洗3次,用眼科剪剪碎。加入0.1%Ⅰ型胶原酶10 mL,在37 ℃的恒温摇床中振荡培养30 min,12 000 r/min离心半径10 cm,离心5 min,轻吸去上清液。用0.15 mol/L的NH4Cl溶解红细胞,PBS清洗3次,弃上清,细胞沉淀用DMEM培养基重悬后用70 um滤网过滤以去除未消化的脂肪。将细胞按照1×109个/mL浓度接种至培养皿中,置于37 ℃、5%CO2培养箱中培养。当细胞融合度达到80%时,用0.25%胰酶消化传代,获得Pl代细胞。将P3代细胞用于后续流式细胞仪检测。
1.3.2 hADMSCs条件培养基制备 取对数生长期的hADMSCs 细胞,0.25% Trypsin 消化成细胞悬液,取 5×105个细胞用 DMEM/F12 完全培养基重悬与培养瓶中,置于5% CO2、37 ℃恒温培养箱中培养 24 h。将完全培养基倒出,加入5 mL不含血清的DMEM/F12 培养基,并置于5% CO2、37 ℃恒温培养箱中培养继续24 h。将细胞上层的培养基吸入15 mL 离心管中,2 000 r/min,离心5 min 后放入-80 ℃冰箱中冻存备用。
1.3.3 PD体外细胞模型构建 MN9D细胞于实验前用丁酸钠进行分化诱导,将MN9D细胞以1×105/孔浓度接种于24孔板,加入培养基常规培养。待细胞融合度达75%左右时,将常规培养基换成含1 mL丁酸钠的诱导培养基,隔天换液。将丁酸钠诱导第5天的细胞用PBS漂洗。吸去漂洗液,改用含2 mM MPP+的常规培养基培养细胞24 h,用于后续实验。
1.3.4 MN9D与BV2细胞共培养 将小胶质细胞与将MPP+处理后的MN9D细胞于37 ℃、5%CO2条件下共培养24 h。实验共分3组(n=5):正常对照组(control)、MPP+处理组及hADMSCs条件培养基处理组(MPP+/CM)。正常对照组(control):上室:BV2细胞,常规培养基;下室:MN9D细胞,常规培养基。MPP+处理组:上室:BV2细胞,常规培养基;下室:MN9D细胞,含200 μM MPP+的常规培养基。hADMSCs条件培养基处理组(MPP+/CM):上室:BV2细胞,hADMSC条件培养基;下室:MN9D细胞,含200 μM MPP+的常规培养基。共培养时间为24 h,每组设3个生物学重复。收集下层MN9D细胞,TUNEL法检测MN9D细胞凋亡情况;Western blot方法检测MN9D细胞内TH及DAT的蛋白表达水平。
1.3.5 TUNEL法检测MN9D细胞凋亡 收集下层MN9D细胞,采用TUNEL原位凋亡检测试剂盒检测细胞凋亡。将细胞爬片浸入4%的多聚甲醛(pH7.4)中室温固定25 min,PBS 清洗。然后于TritonX-100溶液中浸泡3 min后PBS 洗涤。加 50 μL TUNEL 混合液于标本上,37 ℃避光孵育1 h。PBS 洗涤后滴加DAPI避光孵育5 min。于荧光显微镜下观察采集图像。计算5个视野下的凋亡指数(AI)。
1.3.6 Western blot检测MN9D细胞TH/DAT蛋白的表达 MN9D细胞与BV2细胞共培养24 h后,将下层MN9D细胞冰上裂解30 min后,于4 ℃下12 000 r/min,离心半径10 cm,离心5 min。进行SDS-PAGE电泳,采用湿转印法转膜,加入相应一抗(TH 1∶1 000,DAT 1∶1 000),4 ℃孵育过夜,TBST洗涤PVDF膜5次(5 min/次)。二抗稀释后(1∶50 000稀释),用其浸泡PVDF膜,37 ℃摇床孵育2 h,TBST洗去多余二抗。ECL发光试剂盒显色。利用Image Proplus 6.0软件分析目的条带和内参GAPDH条带的灰度值。
1.4 统计学方法
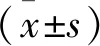
2 结果
2.1 hADMSCs阻碍PD细胞损伤模型中BV2细胞的迁移能力
Transwell共培养结果发现,正常对照组(control)、MPP+处理组及hADMSCs条件培养基处理组(MPP+/CM)细胞迁移数分别为(16.23±6.38)、(96.3±10.13)及(40.33±13.19)。MPP+处理组与正常对照组相比较,从Transwell上室穿透到下室的BV2细胞迁移率明显增加,差异具有统计学意义(P<0.001)。与MPP+处理组相比较,hADMSCs条件培养基处理组(MPP+/CM)中的BV2细胞迁移率明显减少,且其差异具有统计学意义(P<0.001)(图1)。

图1 结晶紫染色检测hADMSCs对MPP+诱导PD细胞模型中BV2 细胞的迁移活性影响注:A:正常对照组(×400);B:MPP+处理组(×400);C:hADMSCs条件培养基处理组(MPP+/CM)(×400);D:BV2平均细胞迁移数,与control组和MPP+组比较,***P<0.001
2.2 hADMSCs减轻共培养体系中MPP+诱导的MN9D细胞凋亡
TUNEL检测结果发现,MPP+处理组中,MN9D细胞单纯经200 μM MPP+处理24 h后,出现凋亡,细胞凋亡数量为(22.10±1.74)个。然而,与MPP+处理组相比较,hADMSCs条件培养基处理组(MPP+/CM)MN9D细胞凋亡数量为(10.2±1.70)个,细胞的损伤程度减轻(P=0.004)(图2)。

图2 MN9D细胞TUNEL染色及细胞凋亡分析注:A:正常对照组(×400);B:MPP+处理组(×400);C:hADMSCs条件培养基处理组(MPP+/CM)(×400);D:MN9D凋亡细胞数统计,与MPP+/CM组比较,** P<0.01;与control组比较,***P<0.001
2.3 hADMSCs增加共培养体系中MN9D细胞TH/DAT表达
Western blot结果表明,与对照组相比,MN9D细胞单纯经200 μM MPP+处理24 h后,MN9D细胞的TH表达量(0.21±0.09 vs 1.01±0.03,P=0.002)及DAT表达量(0.20±0.05 vs 0.99±0.03,P=0.002)均明显下调。并且,与MPP+处理组相比,MPP+/CM组中MN9D细胞的TH(0.72±1.00 vs 0.21±0.09,P=0.004)及DAT表达水平(0.75±1.24 vs 0.20±0.05,P=0.003)均有明显上调(图3)。

图3 hADMSC对共培养体系中MN9D细胞TH/DAT表达的影响注:A:共培养系统中Western blot检测MN9D细胞TH/DAT表达;与MPP+组相比,MPP+/CM组中MN9D细胞的DAT及TH表达水平均有明显上调;B:MN9D细胞TH/DAT表达水平的定量分析,与MPP+组相比较,**P<0.01
3 讨论
研究[3]发现,神经炎症反应是PD的重要病理学特征。CNS中过度炎症反应可加重DA神经元损伤[6]。基于此理论,抑制小胶质细胞介导的过度炎症反应,为神经系统多种炎症性疾病的治疗提供新思路。
MSCs的免疫抑制功能使其成为抗炎治疗的理想细胞。在多种CNS疾病动物模型中均证实,MSCs可通过减弱局部神经炎症反应从而缓解疾病进展[7-8]。本实验采用MPP+诱导的MN9D与BV2细胞共培养体系,通过TUNEL法检测hADMSCs条件培养基处理后对体外PD细胞模型中MN9D 细胞的凋亡情况。TUNEL结果发现,hADMSCs可减轻MN9D细胞的凋亡程度,此结果提示hADMSCs对于MPP+损伤的MN9D细胞具有神经保护作用。DA能神经元中酪氨酸羟化酶(TH)和DAT的分泌能力是反映DA能神经元生理功能的重要指标。TH催化氨基酸L-酪氨酸转变为二羟基苯丙氨酸(多巴)的关键酶,其表达可决定多巴胺水平。DAT是摄取释放多巴胺的主要载体。因此,为进一步检测hADMSCs在共培养系统中对MN9D细胞功能影响,利用Western blot检测MN9D 细胞中DAT及TH的表达水平。Western blot结果进一步证实,hADMSCs诱导后的BV2细胞可以增加MN9D细胞中DAT及TH的表达水平,此结果提示hADMSCs诱导后的BV2细胞可保护MN9D细胞功能。
以上结果均证实,hADMSCs条件培养基处理后BV2对于MPP+致毒的MN9D细胞具有神经保护作用本课题研究结果与以往研究结果相一致。Constantin 等[9]发现,ADMSCs可通过免疫调节机制缓解EAE动物模型的疾病进程,减少脱髓鞘反应及神经元轴突丢失,并且可诱导T细胞向保护性Th2免疫表型转化。Tsumuraya 等[10]研究表明,MSCs在鼠脊髓损伤模型中通过激活TNF-a等促炎因子表达降低,而IL-4等抗炎因子的表达增加,从而抑制炎症反应。此外,Schwerk等[11]将hADMSCs移植于6-OHDA诱导PD动物模型后发现,hADMSCs聚集于黑质部位,并且上调局部抗炎因子的表达。Noh等[12]利用MSCs与小胶质细胞进行的间接培养试验发现,MSCs通过TGF-β调控小胶质细胞的炎症活化表型,进而增强MSCs在中枢神经系统临床试验中的治疗效果。
综上所述,MSCs进入损伤部位后介导的免疫调节和诱导内源性再生是其治疗效果的主要机制,PD等神经退行性疾病发生过程中,小胶质细胞向病灶区域趋化和迁移。为了探索hADMSCs是否能够调节小胶质细胞迁移,本研究采用小鼠小胶质细胞系BV2 细胞Transwell迁移试验来验证hADMSCs对于小胶质细胞迁移的作用及影响。Transwell迁移试验结果证实,hADMSCs可阻碍PD细胞模型中BV2细胞的迁移。总之,本研究表明,通过hADMSCs调控小胶质细胞在炎症反应中的作用,进而缓解局部神经炎症反应,有望成为PD治疗的有效靶点。
