以壳聚糖金纳米粒子为载体构建Ch-GNPs/β6复合物的相关研究
2019-06-22潘夏薇赖颖真许铭炎
潘夏薇 赖颖真 许铭炎
1. 361000, 厦门医学院口腔医学系; 2. 厦门医学院附属口腔医院
基金项目: 2015 年福建省卫生系统中青年骨干人才培养项目(编号: 2015-ZQN-ZD-35); 厦门医学高等专科学校自然科学基金(编号: K2015-06)
整合素αvβ6对调节细胞间或者细胞和细胞外基质(ECM)附着力,粘附固定细胞,促进信号通路等[1],起着重要的作用。壳聚糖(chitosan)是一种带高正电荷的天然高分子多糖,可与带负电荷的基因、生长因子、抗肿瘤药物等结合形成纳米粒子[2]。金纳米粒子(GNPs)因其良好的化学稳定性及与蛋白质、DNA和RNA有着良好的生物相容性,在抗原中是最常用的[3]。本实验将研究制备Ch-GNPs聚合物,以壳聚糖金纳米粒子为载体搭载质粒pcDNA-β6,形成Ch-GNPs/β6复合物,分析其在小鼠成骨前体细胞MC3T3-E1细胞中的转染能力。为后期在钛种植体表面构建生物涂层做前期准备和实验基础。
1 材料与方法
1.1 基本材料
壳聚糖-10、 HAuCl4·3H2O、 硼氢化钠(Sigma Aldrich, 美国); pcDNA-β6、 X-gal、 NP40、 EDTA, 胰蛋白酶抑制剂、亮抑蛋白酶肽、胃蛋白酶抑制剂、 anti-β-Gal(CST, 美国)。
1.2 实验方法
1.2.1 Ch-GNPs溶液的制备 将壳聚糖溶于0.1 mol/L的HCL中,配置出质量体积分数为0.33%的壳聚糖溶液。取1 ml新鲜配制的10 mmol/L的HAuCl4溶液,加入2 ml 0.33%的壳聚糖溶液中,搅拌1 h。 取0.1 mol/L新鲜配制的冰冷的冰硼氢化钠溶液0.4 ml快速添加到溶液中,不断搅拌。溶液迅速变成酒红色。置于超速离心机在4 ℃, 35 000 g 运转30 min收集Ch-GNPs沉淀。将收集的Ch-GNPs加入超纯水后配制成50 mg/ml的浓度,做进一步的鉴定和实验[4]。通过紫外可见吸收光谱和TEM对Ch-GNP的大小和形状进行评估。
1.2.2 Ch-GNPs/DNA复合物的制备 将5、 10、 15和20 μg的 Ch-GNPs溶液(50 mg/ml)与5 μg的pcDNAβ6(150 μg/ml) 混合形成比例分别是1∶1, 2∶1, 3∶1和4∶1的Ch-GNPs/DNA复合物, Control为纯DNA。通过1%琼脂糖凝胶电泳带分析Ch-GNPs/DNA的最优结合比率。
1.2.3 细胞培养 将原代小鼠前成骨细胞系MC3T3-E1,用α-MEM完全培养基(含10%FBS, 100 U/ml青霉素, 100 μg/ml链霉素),在37 ℃下、 5% CO2饱和湿度的孵育箱中培养。
1.2.4 免疫印迹 使用改良的裂解缓冲液(150 mmol/L NaCl, 50 mmol/L pH8的Tri-HCl, 1% NP40, 5 mmol/L EDTA, 1 mmol/L胰蛋白酶抑制剂, 0.1 mmol/L亮抑蛋白酶肽和 1 mmol/L胃蛋白酶抑制剂)裂解细胞, 收集细胞,提取蛋白后依次经10% SDS-凝胶电泳、转膜、封闭、一抗及二抗孵育、化学增强发光系统检测免疫条带。
1.2.5 X-gal半乳糖苷酶染色 转染前24 h, 以每孔4×104的密度接种到24 孔板。设置对照组,A组为未加入Ch-GNPs/DNA的空白组, B组加入比例为1∶1的Ch-GNPs/DNA, C组加入比例为2∶1的Ch-GNPs/DNA组。转染时,将24 孔板中按标准培养条件下生长的转染细胞,用含2%(V/V)甲醛, 0.2%(V/V)戊二醛的1×PBS溶液固定1 h后, 用PBS溶液清洗3 次, 使用X-gal染色溶液 (含2 mmol/L X-gal, 2 mmol/L K3Fe(CN)6、 2 mmol/L K4Fe(CN)6、 2 mmol/L MgCL2、 1×PBS)在37 ℃下染色24 h。使用立体显微镜对转染细胞进行观察并存储数字图像。
2 结 果
2.1 大体观察
Ch-GNPs溶液紫外可见吸收峰集中在520 nm, 这是Ch-GNPs典型的表面等离子体共振吸收峰 (图 1)。 TEM图像显示Ch-GNPs表现出均匀、分散的粒度分布,粒子呈球形,平均直径10~20 nm(图 2)。
2.2 Ch-GNPs/DNA复合物
4 个不同浓度Ch-GNPs/DNA加样孔由于DNA和Ch-GNPs之间静电力吸引力以至于DNA无法迁移,仍位于凝胶加样孔中。通过比较DNA的亮度分析结果(图 3)。
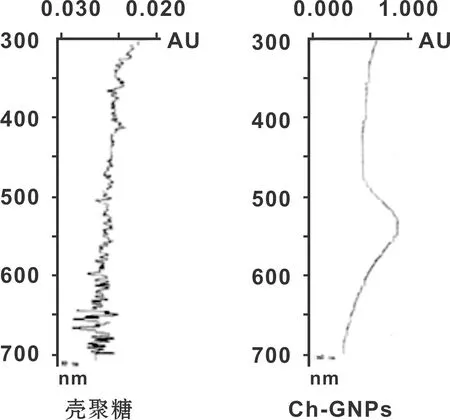
图 1 紫外可见分光光度计测得吸收峰
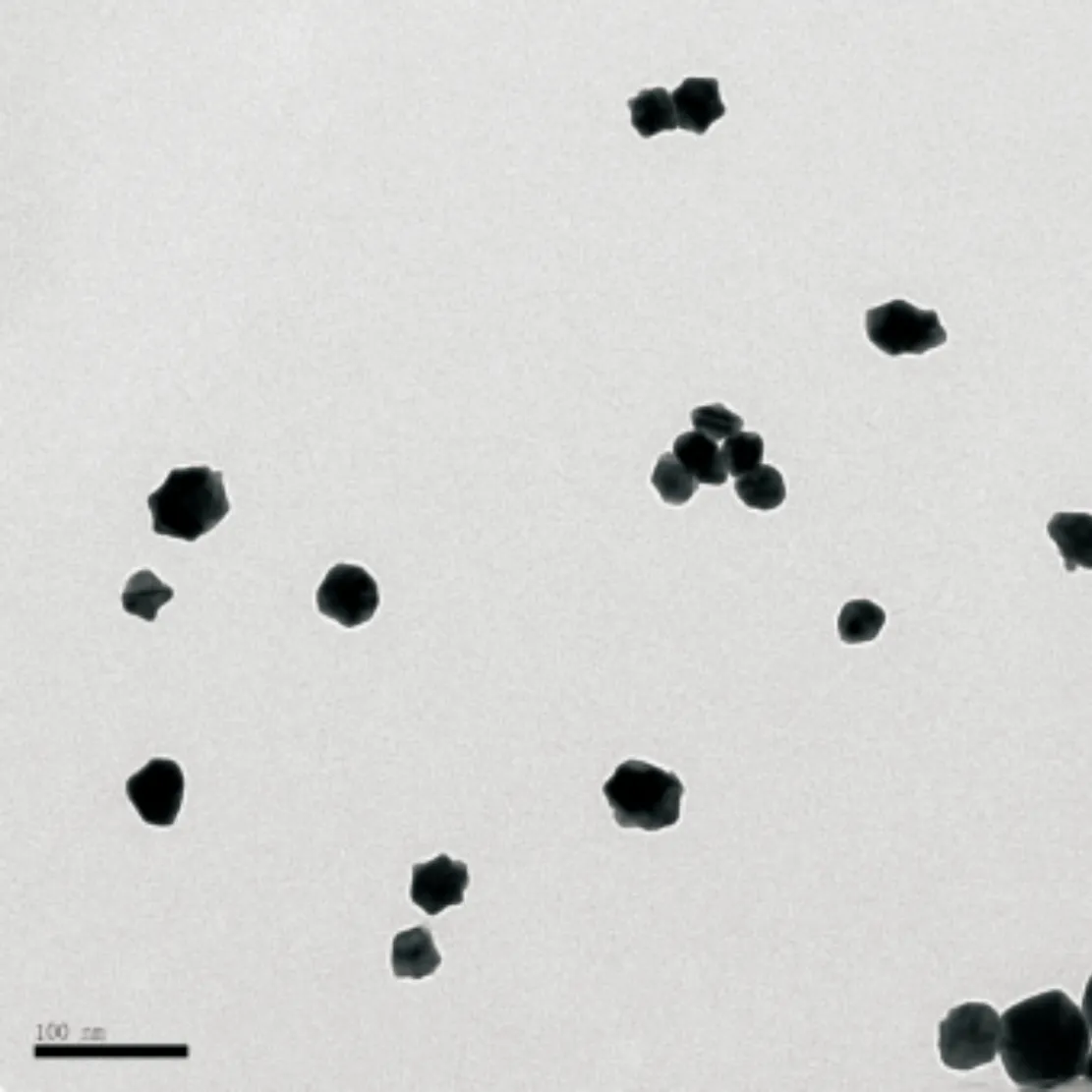
图 2 透射电镜下观察Ch-GNPs,粒子直径10~20 nm
(×25 000)
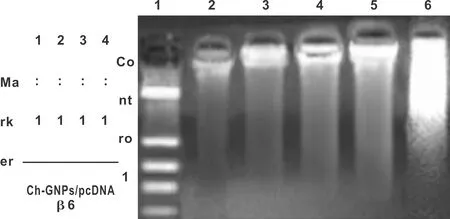
图 3 不同比例的Ch-GNPs/pcDNA在电泳下所见的条带
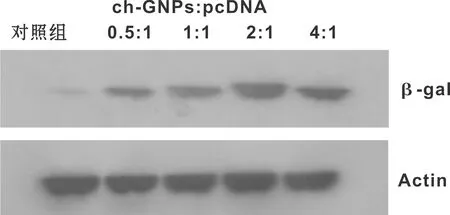
图 4 用免疫印迹检测不同比例的Ch-GNPs/DNA的基因蛋白表达
2.3 WB
WB显示了β-gal的高水平表达(图 4)。 在2∶1比例下的Ch-GNPs/DNA的基因蛋白表达最强, 也说明该比例的复合物能被MC3T3-E1细胞内吞进细胞表达基因蛋白。
2.4 X-gal染色
转染后,一部分细胞在X-gal染色下变蓝可证实基因的表达。Ch-GNPs和DNA比例为2∶1的复合物与比例为1∶1的复合物相比,转染能力有所提高,可达到75%(图 5)。
3 讨 论
本实验中利用壳聚糖的优势还原金离子和稳定金纳米粒子,过程简单,不会引起任何环境毒性或生物危害,在紫外线光谱和TEM实验中进一步证实了Ch-GNPs的形成。 研究证明Ch-GNPs的大小和形态对于细胞的有效吸收是非常重要的。Ch-GNPs表面带正电荷,能与核酸的磷酸根通过静电作用将DNA分子包裹入内,形成Ch-GNPs/DNA复合体。纳米粒子粒径在100 nm以下能够很好的承载DNA基因通过内吞作用进入细胞或胞饮,保证细胞对粒子的内吞[5]。粒径越小,包封率和载药量也越高,同时其副反应也越小[6]。
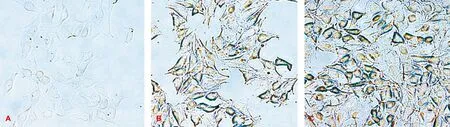
A: 未加入Ch-GNPs/DNA的空白组; B: 比例为1∶1的Ch-GNPs/DNA组; C: 比例为2∶1的Ch-GNPs/DNA组
图 5 X-gal染色检测Ch-GNPs/DNA在MC3T3-E1细胞中的转染
(×40)
琼脂糖凝胶电泳实验确定了Ch-GNPs/pcDNA复合物的结合能力,同时随着Ch-GNPs浓度的增加,DNA的浓度也随之显著减少,表明更高浓度的纳米粒子并不会破坏质粒DNA复合体。WB结果显示在2∶1比例下的Ch-GNPs/pcDNA的基因蛋白表达最强,证实了Ch-GNPs和DNA能够有效的结合,以Ch-GNPs为载体,可广泛的在体内和体外传递有效的DNA,从而达到基因治疗的目的。
X-Gal是β-半乳糖苷酶的显色底物,在其催化下水解产生蓝色产物5-溴-4-淀蓝,通过颜色变化可大致判断出酶活性,快速辨识并进行量化[7]。结果表明Ch-GNPs/DNA复合物进入细胞,引发β-半乳糖苷酶的表达。证实了Ch-GNPs/ cDNA可以携带报告基因进入MC3T3-E1细胞。意味着纳米粒子一方面可能会在基因传递中增加质粒DNA的生物利用度,另一方面,壳聚糖链上的胺组在酸性溶液中带正电荷,与带负电荷的DNA结合,形成带正电的纳米颗粒,也大大保护了DNA免受核酸酶的降解。
因此,Ch-GNPs可以作为基因载体携带质粒进行基因治疗的实验研究,为后期在钛表面涂层研究对成骨细胞的增殖和分化奠定基础。
