PTH加速下颌升支截骨术后正畸牙移动过程中RANKL/OPG的表达
2019-06-22李耀唐正龙陈小燕王冬香高琼
李耀 唐正龙 陈小燕 王冬香 高琼
近年来,“手术优先”(Surgery-first approach,SFA)在快速改善患者面型缩短治疗疗程方面引起学者们关注,SFA可能通过术后激活成骨和破骨细胞相关因子来调节牙槽骨的转换率,加速正畸牙的移动,从而缩短正畸疗程[1-2]。正畸牙移动过程中牙周骨组织的改建受多种因素调节。甲状旁腺激素(parathyroid honmone, PTH)能保持血液中血钙的平衡,并参与骨组织的合成及分解代谢过程[3]。近年研究发现,应用PTH可通过调节牙周组织的转换率来促进正畸牙的移动,然而其调控机制尚不明确[4-5]。
正畸牙的移动过程中,同时受到很多成骨细胞和破骨细胞相关因子的参与,其中破骨细胞核因子κB受体活化因子配体(receptor activator nutear factor kappa-B ligand,RANKL)及骨保护因子(osteoprotegerin,OPG)是细胞外调节骨吸收的关键因子[6-7]。研究发现RANKL和OPG在正畸牙移动期间表达增加,表明它们在牙周组织的重建过程中发挥重要作用[8-9]。
实验通过建立兔下颌升支截骨和下颌第一磨牙正畸移动模型,术后间歇性注射PTH,观测牙移动速度,检测RANKL 和OPG在牙周组织中的表达,探讨PTH在正颌手术后加速正畸牙移动的分子生物学机制。
1 材料与方法
1.1 实验动物及分组
选用48 只6 个月龄的SPF级新西兰大耳白兔(贵州医科大学实验动物中心),雌雄不限,体重(2.5±0.1) kg。随机分成实验组和对照组,每组24只。对照组颈部隔日皮下注射生理盐水1 ml,实验组隔日皮下注射 20 μg/kg rhPTH(Tocris公司, 英国),各组分别于牵牙第5、 7、 14、 21 d时处死6 只实验动物。
1.2 建立兔下颌升支截骨和正畸牙移动模型
全麻下于兔右侧下颌骨下缘作长约2 cm皮肤切口,切开皮肤、皮下组织、肌肉至骨面,切开骨膜,剥离下颌骨外侧骨膜,于下颌角前区沿下颌骨升支至乙状切迹做一弧形截骨线,截骨后在下颌下缘和升支后缘用钛板(宁波慈北医疗器械有限公司)作坚固内固定。在下颌两中切牙和术侧下颌第一磨颈部中下1/3处制备一条固位沟,用0.2 mm的正畸结扎丝将 N-T拉簧(直径 0.1 mm)固定于下颌中切牙和下颌术侧第一磨牙之间,制作成下颌第一磨牙近中移动正畸模型(图 1)。术后第一天牵引第一磨牙近中移动,调拉簧拉力使正畸牵引力值约0.78 N(图 1)。
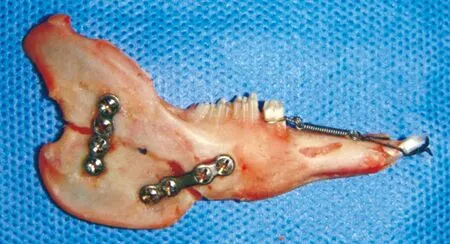
图 1 下颌升支截骨术+正畸牙移动模型
Fig 1 Orthodontic models of mandibular first molar movement after mandibular ramus osteotomy
1.3 正畸牙移动速度测量
用硅橡胶印模材料取术侧下颌牙模型,测量各时期第一磨牙牙冠中点与第二磨牙牙冠中点的距离。并计算出牙齿平均移动速度(mm/d)。
1.4 组织获取及处理
各组实验动物处死后,截取含下颌第一磨牙及周围牙周组织的骨块,其中3 只用4%多聚甲醛固定24 h, 20%乙二胺四乙酸(EDTA)脱钙4周后常规石蜡包埋。标本沿牙体长轴,按施力方向的近远中向连续切取5 μm组织学切片分别行HE染色、破骨细胞染色和免疫组化染色;另3 只用RNAlater液保存,用于实时荧光定量PCR检测。
1.5 免疫组织化学检测RANKL和OPG表达
用免疫组织化学法检测正畸牙压力侧牙周组织中OPG和RANKL蛋白的表达(武汉博士德生物工程有限公司)。每张切片选择5 个视野,经摄像后存于Image-Pro Plus 6.0图像分析系统中,计算并比较各组压力侧OPG和RANKL蛋白平均吸光度值(A值)。
1.6 实时定量PCR检测RANKL mRNA和OPG mRNA表达
截取兔下颌第一磨牙压力侧近牙冠1/3处3 mm×3 mm×3 mm的牙槽骨组织,在液氮的中磨碎后取约1 mm3组织,磁珠法提取总RNA。取总RNA 13 μl,逆转录(Transcript First Strand cDNA Synthesis Kit, Roche, 美国)成cDNA, -20 ℃保存。取上下游引物各1 μl、 cDNA模板1 μl混合于反应管,添加 5 μl荧光染料SYBR Green I Master(Roche, 美国),加双蒸水补成10 μl反应体系。将所有反应管放入热循环仪中(BIO-RAD),设定热循环仪反应条件(95 ℃ 5 min, 95 ℃ 10 s, 58 ℃ 20 s, 72 ℃ 30 s, 45 个循环)。 在60~95 ℃同时对目的基因及内参基因进行溶解曲线分析。以对照组为准,采用2-ΔΔct法进行数据的定量分析,得出各样本RANKL mRNA及OPG mRNA相对表达量。RANKL、 OPG qPCR引物由上海生工生物工程有限公司设计和合成(表 1)。

表 1 引物基因序列
1.7 统计学分析
应用SPSS 23.0软件对数据进行单因素方差分析,以P<0.05作为差异有统计学意义。
2 结 果
2.1 正畸牙移动速度的比较
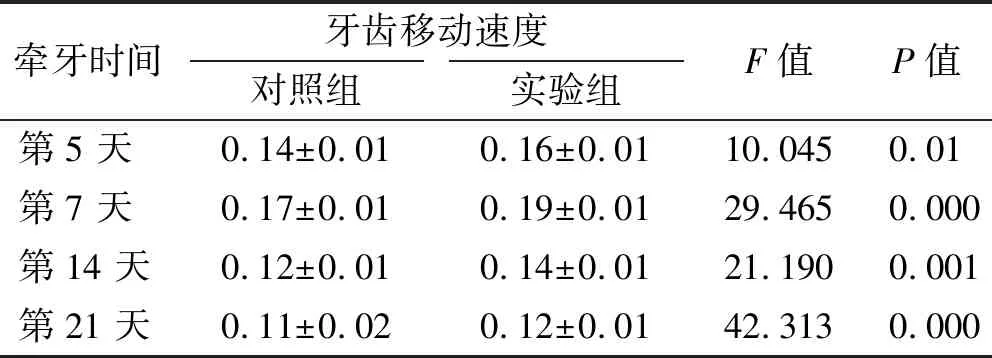
术后21 d内实验组下颌第一磨牙的移动速度均大于对照组,差异有统计学意义(P<0.05)。且2 组在第7 天正畸牙移动速度都达到最快,随后2 组正畸牙移动速度均减慢(表 2)。
表 2 各组移动牙速度 (mm/d)
Tab 2 The speed of tooth movement
(mm/d)
2.2 牙周组织形态学观察和破骨细胞计数结果
在正畸力牵引第5天时实验组和对照组压力侧牙周间隙变窄,胶原纤维排列紊乱,可见多个破骨细胞位于牙槽骨表面的骨吸收陷窝内;张力侧牙周韧带增宽,细胞成分增多。在正畸力牵引第7天时,牙槽骨改建活跃,压力侧骨吸收陷窝进一步增大、增深,破骨细胞数目达到高峰,且实验组较对照组明显(P<0.05)(图 2);张力侧牙周韧带进一步增宽,可见成骨反应。在正畸力牵引第14 天和21 天时,实验组和对照组压力侧骨破骨细胞逐渐减少;张力侧部分骨小梁排列成片状,新骨成骨厚度进一步增加。
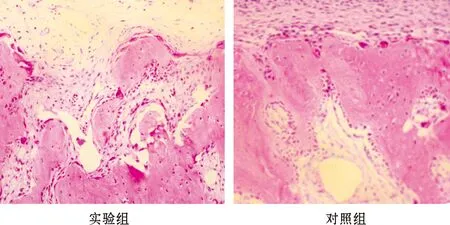
图 2 术后牵牙第7 天时实验牙压力侧组织形态
(HE, ×100)
Fig 2 Morphology of periodontal tissues of the tested tooth on the compression side 7 d after treatment
(HE, ×100)
电镜观察下颌第一磨牙压力侧牙根1/3以上的破骨细胞数目,发现实验组明显多于对照组(P<0.05), 2 组同时在第7天达到峰值(图 3、 表 3)。
2.3 RANKL/OPG在正畸牙压力侧牙槽骨中的表达
RANKL阳性表达定位于牙周组织成骨细胞、破骨细胞的胞浆内。加力5~7 d时,压力侧牙槽骨中RANKL的表达水平随时间的增加而增加,第7 天时平均吸光度值最大,随后逐渐减弱(图 4)。实验组染色强度高于对照组(P<0.05)(表 4)。OPG阳性表达定位于新生骨小梁周围的成骨细胞和成纤维细胞的胞浆内(图 5)。加力21 d内,实验组染色强度均低于对照组,差异有统计学意义(P<0.05)(表 5)。加力7 d时阳性表达达到峰值,随后逐渐下。
2.4 RANKL/OPG mRNA在正畸牙压力侧牙槽骨中的表达

图 3 术后牵牙第7、 14 天时下颌第一磨牙压力侧破骨细胞
(TRAP, ×200)
Fig 3 Osteoclasts on the compression side of periodontal tissues 7 and 14 days after operation
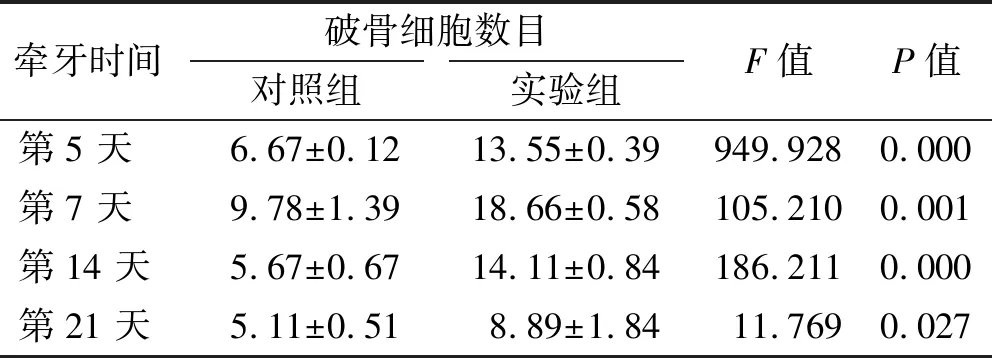
(TRAP, ×200)
图 4 术后牵牙第7 天时 RANKL在下颌第一磨牙压力侧牙周组织区域的表达
(免疫组化染色, ×400)
Fig 4 Comparison of RANKL expression on the compression side 7 days after operation
(Magnification, ×400)
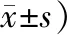
Tab 4 RANKL expression on the compression side
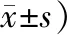
(A值,
图 5 术后牵牙第7 天 OPG在下颌第一磨牙压力侧牙周组织区域的表达
(IHC, ×400)
Fig 5 OPG expression on the compression side on 7 d after operation
(ICH, ×400)
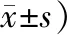
Tab 5 OPG expression on the compression side
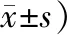
(A值,
压力侧牙槽骨组织中的RANKL和OPG mRNA表达均在术后加力第5~7 天有微弱增加,至第7 天达最高峰,此后逐渐减少。且实验组RANKL mRNA的表达高于对照组(P<0.05)。表明正畸牙压力侧牙周组织中存在较活跃的破骨活性,有利于正畸牙的快速移动(图 6)。而压力侧OPG mRNA的表达结果相反,对照组OPG mRNA表达高于实验组(P<0.05)(图 6)。反应了对照组压力侧成骨活动较实验组强,使对照组正畸牙移动速度低于实验组。
3 讨 论
手术优先正颌外科可使骨性牙颌面畸形患者的面型在早期得到明显的改善,缩短疗程,而且能通过激活相关骨改建因子来调节牙槽骨的代谢,促进正畸牙的移动[10-11]。 长期以来学者们在不断探索加速正畸牙移动的方法和技术,除了一些手术方法和物理辅助方法外[12-14],近来相关研究表明PTH作为一种重要的骨代谢调节激素,主要通过诱导牙槽骨的代谢来影响正畸牙的移动[15],然而PTH对正畸牙移动的机制尚不明确。本研究设想在下颌升支截骨术后间歇性应用PTH可通过加速牙槽骨的代谢及转换水平,从而进一步加速正畸牙的移动。研究结果显示,应用PTH后实验组下颌第一磨牙近中移动速度快于对照组,实验组压力侧牙周组织中破骨细胞数量增加,说明实验组术后给予PTH加速了牙周骨组织改建,从而使正畸牙移动加速。
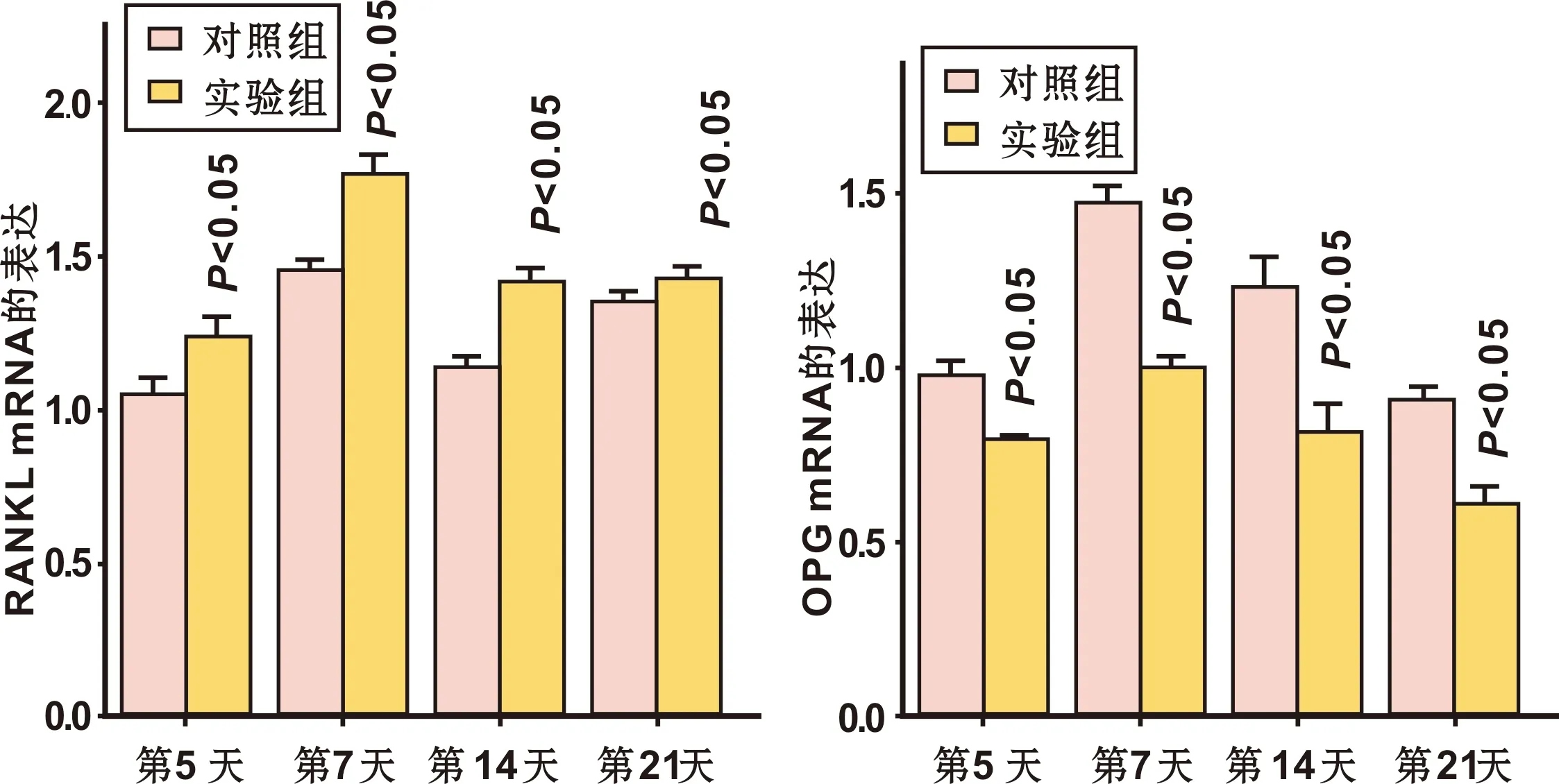
图 6 压力侧RANKL mRNA及OPG mRNA表达
Fig 6 Relative expression of RANKL mRNA and OPG mRNA on the compression side
PTH对骨重建的作用会受到给药方式的影响,连续注射甲状旁腺激素主要产生分解代谢效应,而间断注射则主要导致合成代谢作用[16]。Soma等[4]通过建立鼠上颌正畸牙移动模型,持续应用10 mg PTH,结果显示应用PTH组正畸牙压力侧破骨细胞数目大于对照组,且加快了正畸牙移动,而间隙性应用PTH没有加速正畸牙的移动。Salazar等[17]研究显示,对卵巢切除术后骨质疏松大鼠应用甲状旁腺激素(30 μg/kg·d)皮下注射后,在第7 天时正畸牙移动速度快于未行卵巢切除术的对照组,且各组间正畸牙牙周膜间隙和破骨细胞数量没有统计学差异。本研究模拟下颌升支正颌外科截骨手术,术后间歇性皮下注射20 μg/kg PTH,结果显示实验组正畸牙的移动速度快于对照组。说明在下颌升支截骨术后应用20 μg/kg PTH可加速正畸牙移动,但最适的效量关系任需进步一探索。
正畸牙的移动过程中成骨和破骨细胞因子的相互作用,最终导致压力侧骨吸收和张力侧骨形成。PTH作为体内重要的骨代谢调节激素,既能促进骨形成,又能促进骨吸收,具有双重调节作用。Li 等[5]研究外源性间歇性应用PTH后大鼠上颌正畸牙移动速度快于对照组,PTH通过RANKL结合于破骨细胞前体的表面,经一系列的级联反应和信号传导,刺激破骨细胞形成和骨吸收,同时抑制成骨细胞的活性,而成骨细胞及破骨细胞的相互作用是骨改建的关键,在牙槽骨重建过程中RANKL和OPG为其关键的调控因子。RANKL与破骨细胞核因子κB受体激活蛋白(receptor activator of NF-κB,RANK)结合,诱导破骨细胞的形成和活化。多种骨吸收细胞因子和激素,通过不同的信号机制,都汇合于上调RANKL的表达。同时RANKL具有与OPG结合的能力,OPG竞争性的与细胞膜表面的RANKL结合,抑制RANKL诱导破骨细胞形成,从而减少骨吸收[18-19]。Soma 等[4]研究发现,短期间断性注射PTH可通过提高牙槽骨转换率从而加速正畸牙的移动。本实验通过蛋白水平和分子水平来检测兔下颌升支截骨术后正畸牙压力侧不同时期RANKL及OPG的表达情况。结果发现,实验组压力侧牙槽骨中RANKL表达高于对照组,反应了实验组正畸牙压力侧牙周组织中存在较强的破骨细胞活性,加速了压力侧牙槽骨的分解代谢,有利于正畸牙的快速移动。而压力侧OPG的表达结果则相反,对照组OPG表达高于实验组,反应了对照组压力侧成骨活动较实验组强,一定程度上使对照组正畸牙移动速度低于实验组。
应用外源性PTH可以促进破骨细胞的增生和分化,提高正颌术后正畸牙的移动。其可能的作用机制是在正颌术后PTH可通过增加RANKL表达,抑制OPG的表达,加速骨代谢及骨转换水平,从而促进下颌正畸牙的移动。
