人口腔鳞状细胞癌干细胞中microRNAs差异表达研究
2019-06-22胡雪刚邱在玲曾建钗林诗晗樊丽娜吕红兵傅升
胡雪刚 邱在玲 曾建钗 林诗晗 樊丽娜 吕红兵 傅升
口腔鳞状细胞癌(OSCC)是最常见的头颈部恶性肿瘤,位列全身常见肿瘤的第6 位[1],侵袭性较高、晚期诊断、低治疗反应和转移是造成5 年生存率低的主要原因[2]。肿瘤干细胞(CSCs)是肿瘤组织中一小部分细胞群,是肿瘤对化疗药物耐受性、肿瘤转移和进展的主要调节者[3]。微小RNA(miRNAs)是19-23nt的非编码RNA,通过调节基因表达对许多生物过程至关重要[4],在癌症中其表达的改变可以作为疾病潜在的生物标志物[5]。miRNAs能够介导和调控肿瘤微环境的细胞因子,具有调节肿瘤干细胞信号通路的能力,但是他们的确切机制还待研究和阐明。
本实验主要探讨口腔鳞癌细胞系TCA-8133中CD133+细胞是否具有CSCs的特征,以及筛选口腔鳞癌CSCs相关miRNAs的表达谱,筛选出差异miRNAs,并对其进行生物信息学分析。
1 材料与方法
1.1 主要仪器和试剂
CCK-8试剂盒(同仁化学公司, 日本);胎牛血清(Hyclon,美国)、胰蛋白酶(Gibco,美国); 酶标仪(DU-600型,Beckman公司, 美国);I型胶原酶、 DMEM、dispase II酶(Sigma,美国);鼠抗人CD133单克隆抗体(R&D systems,美国);结晶紫(上海碧云天生物技术有限公司);免疫磁珠(Miltenyi Biotec,德国);TruSeq Small RNA Sample Prep Kit(Illumina,美国);Transwell 小室(BD Biosciences,美国)。
1.2 细胞系及细胞培养
人口腔鳞癌细胞系TCA-8113(购自中国科学院上海生科院细胞资源中心)复苏后用含10%的胎牛血清的DMEM培养液培养,在37 ℃、体积分数5% CO2培养箱培养。 细胞生长达70%~80%融合时以0.25%胰蛋白酶消化传代。
1.3 利用免疫磁珠分选CD133+TCA-8133细胞
取对数生长期的TCA-8113,鼠抗人CD133单克隆抗体2.5 μg/106细胞标记;每107细胞加入20 μl FcR blocking、 50 μl running buffer,充分混匀后4 ℃孵育15 min,加入4 ml buffer清洗细胞;再次将细胞与20 μl免疫磁珠、 80 μl running buffer混合,然后在4 ℃下在黑暗中孵育15 min,清洗细胞后加500 μl buffer重悬,置LS分选柱中,磁性标记的细胞保留在磁性柱中,而未标记的细胞直接通过磁性柱。将 CD133+和CD133-TCA-8133洗下并收集到离心管中进行离心。采用CCK-8法检测 CD133+和 CD133-TCA-8113 细胞的增值能力,绘制细胞增殖曲线,实验重复3 次。
1.4 流式细胞术检测细胞中CD133的表达
取2×106个免疫磁珠法分选前后的口腔鳞癌TCA-8113细胞重悬于160 μl PBS 缓冲液中,分别加入荧光素标记的鼠抗人CD133抗体, 对照组加入同型鼠IgG抗体, 根据制造商的说明书进行操作, 最后将样品上机检测CD133的阳性率。
1.5 平板克隆形成实验
取对数生长期的CD133+和CD133-TCA-8113以1 000 个细胞/孔接种于6 孔板中,每组3 个复孔。置于37 ℃、 5% CO2的饱和湿度培养箱中培养2 周, 用4%多聚甲醛固定细胞15 min,随后用0.1%结晶紫染色30 min,计数可见菌落的数量,以直径>1 mm(50 个细胞/克隆)时计数克隆数,重复试验3 次。
1.6 细胞侵袭能力检测
使用具有8 μm 孔径聚碳酸酯滤膜的Transwell小室进行侵袭测定。在测定之前,将琼脂包被在上室中过夜。用无血清的DMEM 培养基重悬细胞,以1×105个细胞/小室的细胞密度在上室中,用4%多聚甲醛固定侵入的细胞10 min,用0.1%结晶紫染色30 min,在倒置显微镜下观察,实验重复3 次。
1.7 二代测序技术检测miRNAs表达谱
用TruSeq Small RNA Sample Prep Kit根据制造商推荐的流程,构建miRNAs测序文库,待测miRNAs文库在cBot上完成簇类生长,将流通池转移到HiSeq 2000型基因测序仪上,按照标准流程二代测序及分析。
1.8 miRNAs靶基因预测及基因功能生物信息分析
使用TargetScan (http://www.tagetscan.org) 和miRanda (http://www.microrna.org/microrna/home.do) 软件预测差异miRNAs的的靶基因。使用DAVID 6.7功能注释工具(http://david.abcc.ncifcrf.gov/)对差异miRNAs的所有靶基因进行GO和KEGG通路富集分析。利用DAVID将GO注释分成3 个类别,包括生物过程、细胞组分和分子功能。KEGG通路分析使用(http://www.genome.jp/kegg/),其中P<0.05。
1.9 统计学处理
2 结 果
2.1 CD133+和CD133-TCA-8113细胞的分离培养
培养免疫磁珠筛选后CD133表达阳性的TCA-8113细胞,为呈均一的多角形上皮样细胞,镶嵌状排列,少数为圆形,多核巨细胞和巨核细胞,CD133-和CD133+TCA-8113 细胞形态类似,没有显著差异。采用CCK-8法检测 CD133+或CD133-TCA-8113 细胞的增值能力,结果显示, 第4~7 天,CD133-TCA-8113 的A值低于CD133+TCA-8113(P<0.05)(图 1)。
2.2 流式细胞术检测CD133的表达
流式细胞术检测结果表明,CD133蛋白在口腔鳞癌细胞系TCA-8113中低表达,CD133+细胞百分比为(16.57±0.49)%。TCA-8113 细胞系经免疫磁珠分选后进行流式分析,结果显示,纯化后CD133+TCA-8113 细胞的百分比可达(91.10±0.35)%(图 2)。
2.3 CD133+TCA-8113细胞的克隆形成能力明显增强
CD133+TCA-8113细胞在超低吸附板中培养2 周后,大部分细胞形成了细胞克隆;而CD133-TCA-8113细胞细胞克隆数量相对较少, 部分细胞趋于崩解或凋亡。在倒置显微镜下计数,CD133+和 CD133-TCA-8113细胞克隆数分别为246.7±12.02和172.3±2.848(P=0.04)(图 3)。
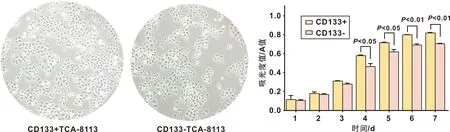
图 1 磁珠分选后CD133+和CD133-TCA-8113细胞光镜下的形态和增殖能力
(×40)
Fig 1 Morphology and proliferation capacity of CD133+ and CD133-TCA-8113 cells
(×40)
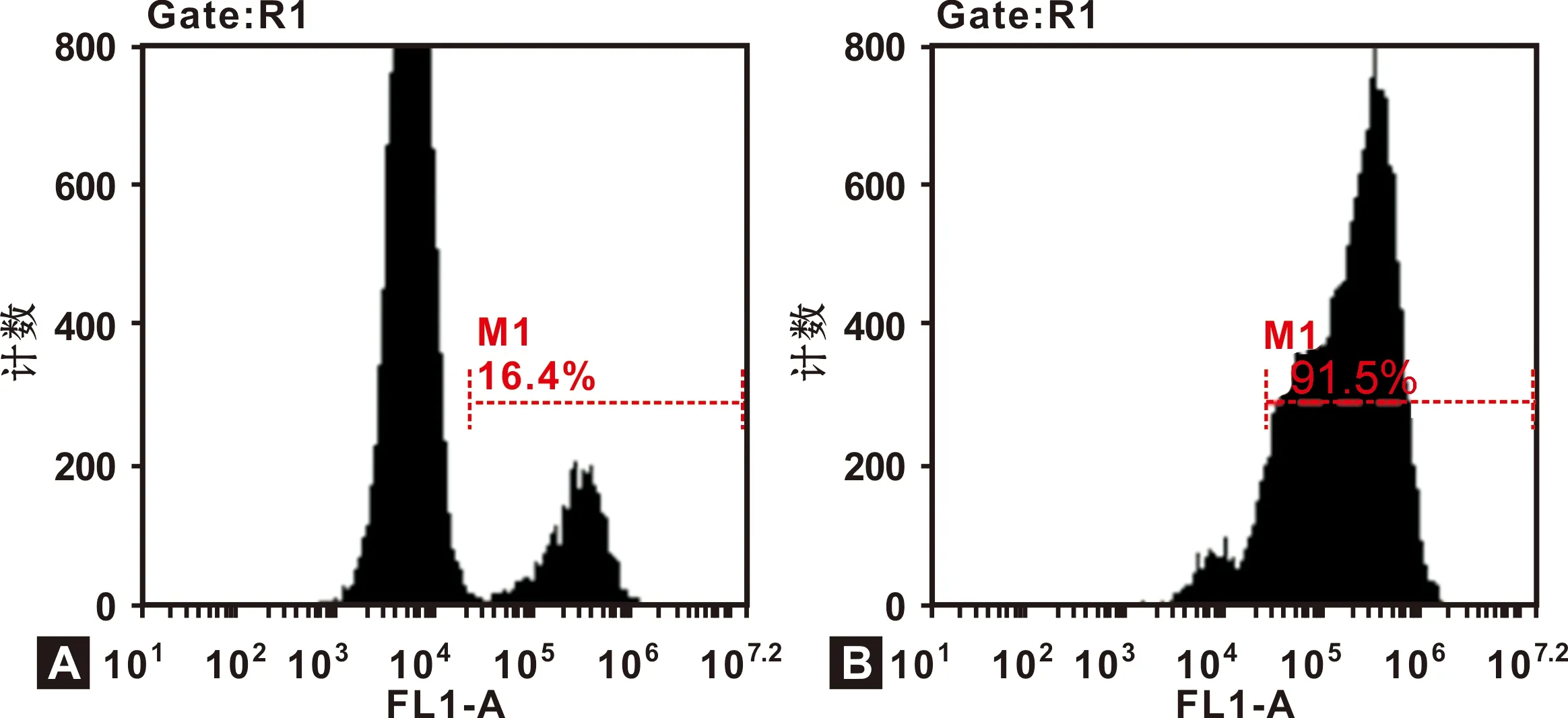
图 2 免疫磁珠分选前(A) 后(B) TCA-8113细胞中CD133+TCA-8113细胞的比例
Fig 2 Percentages of CD133+TCA-8113 in TCA-8113 before (A) and after (B) immunomagnetic bead cell sorting
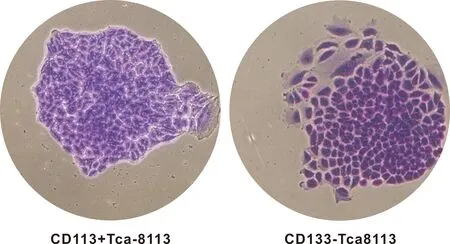
图 3 CD133+和 CD133-TCA-8113细胞的克隆形成能力
(×40)
Fig 3 The colony formation abilities of D133+ and CD133-TCA-8113 cells
(×40)
2.4 细胞侵袭实验结果 利用Transwell小室侵袭实验,研究CD133+和 CD133-TCA-8113细胞的侵袭能力。实验结果显示,CD133+和CD133-TCA-8113细胞侵袭数分别为576.7±33.83和206.3±18.89(P=0.01)(图 4)。
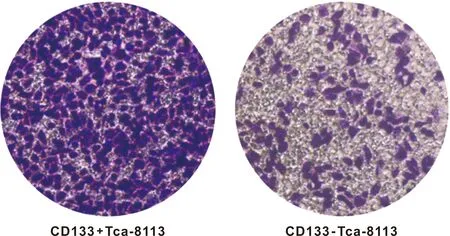
图 4 CD133+和 CD133-TCA-8113细胞的侵袭能力检测
(×40)
Fig 4 Invasion of D133+ and CD133-TCA-8113 cells
(×40)
2.5 CD133+和 CD133-TCA-8113细胞中miRNAs表达谱差异分析
用R package DESeq2(Version 1.6.1)软件,二代测序显示CD133+与 CD133-TCA-8113细胞共有1 505 个 miRNAs 的表达存在差异。其中差异倍数>1.5,P<0.05的miRNAs共有12 个: 2 个miRNAs在CD133+TCA-8113细胞中高表达,分别是has-miR-1248, has-miR-1273g-3p, 10 个miRNAs低表达,分别是has-miR-3651, has-miR-188-5p, has-miR-1285-1, has-miR-6737-3p, has-miR-663a, has-miR-2276-3p, has-miR-4466, has-miR-494-3p, has-miR-1290, has-miR-6889-3p(图 5)。
2.6 差异表达miRNAs靶基因的预测
为提高预测的特异性,本研究采用miRanda和RNAhybrid进行靶基因预测,其中上调的2 个miRNAs: hsa-miR-1248、 hsa-miR-1273g-3p, 分别注释到5 个和1 194 个靶基因, 下调的10 个miRNAs中有2 个没有注释到靶基因,其余8 个分别注释到27~861 个靶基因不等。
2.7 差异表达miRNAs靶基因注释
利用DAVID进行GO功能注释和KEGG通路分析,GO注释富集分析结果(图 6)。细胞组成注释,靶基因显著富集于细胞、细胞膜、细胞器、细胞外基质和细胞间连接等。分子功能注释,靶基因显著改变转录激活因子、RNA聚合酶Ⅱ转录因子、蛋白激酶、跨膜受体蛋白酪氨酸激酶和泛素蛋白连接酶的活性,以及DNA、蛋白质、生长因子的结合。生物过程注释,靶基因与血管形态发生、干细胞分化、上皮细胞的增殖等涉及发育与转录的一系列生物学过程。在KEGG通路富集分析中, 结果主要集中在癌症途径、 Wnt信号途径、FC受体信号途径、TRK信号途径、氧化应激、调节上皮增殖途径等信号通路(P<0.05)(图 6)。
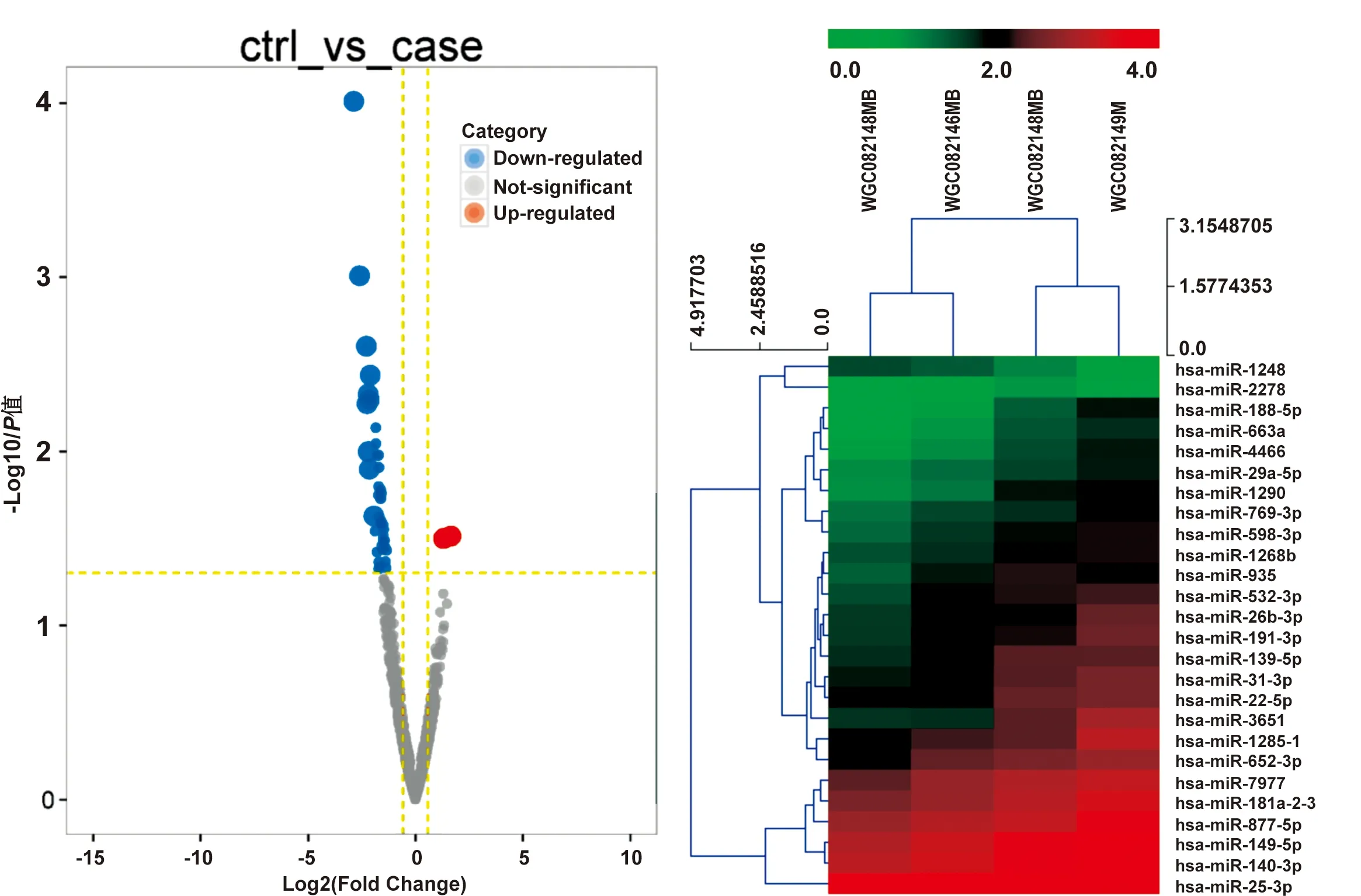
图 5 CD133+和 CD133-TCA-8113差异表达miRNAs火山图(A)、聚类分析图(B)
Fig 5 The volcano plot(A) and cluster analysis(B) of the differential miRNAs in CD133+ and CD133-TCA-8113
3 讨 论
口腔鳞状细胞癌与广泛的危险因素的关联以及不可预测的治疗结果使得其成为治疗最复杂的癌症之一[6]。尽管多种方法联合治疗,OSCC患者的5 年生存率在过去的40 年未超过50%[6-7]。越来越多的证据表明,miRMAs 可以作为癌症诊断和预后标志物[8],CSCs 具有独特性的促进治疗进展和转移的能力[9],从而为CSCs的靶向治疗提供新的途径。

A: 细胞组成; B: 分子功能; C: 生物过程
本研究通过二代测序获得口腔鳞癌CSCs的miRNAs特异性表达谱,发现与口腔鳞癌细胞比较,miRNAs在口腔鳞癌CSCs中的表达存在明显差异。其中,差异在1.5倍以上的miRNAs有12 个, 10 个miRNAs在口腔鳞癌CSCs中低表达,结果提示差异性的miRNAs可能在口腔鳞癌CSCs的分化以及抑制肿瘤的发生中发挥重要作用。
目前已有大量的研究证实了miRNAs在多种肿瘤干细胞中发挥了重要调控作用,且较为深入。Bai等[10]发现miR-142-5p可以通过抑制PTEN来诱导皮肤鳞状细胞癌的干细胞样特性。El Helou 等[11]研究表明miR-600沉默导致乳腺癌干细胞增殖,而其过表达会降低乳腺癌干细胞自我更新,导致体内致瘤性降低。在没有miR-600的情况下,WNT信号是有活性的并且促进自我更新,而miR-600的过表达抑制WNT的活性并促进乳腺癌干细胞分化,可能作为乳腺癌治疗的潜在靶标。Zhou等[12]发现miR-145和宫颈癌干细胞多能性相关,且miR-145在宫颈肿瘤分化后的表达增加。miR-145过表达会抑制干细胞转录因子的表达,以及降低肿瘤侵袭和集落形成能力,同时miR-145低表达的患者预后更好。Liu等[13]发现miR-141的高表达可以抑制前列腺癌干细胞的增殖、侵袭和转移。同时在口腔鳞癌干细胞的研究也证实了miRNAs的调控作用,Yu等[14]发现抑制miR-204可促进口腔鳞状细胞癌干细胞增殖,EMT性状和淋巴结转移。Ghosh等[15]研究表明miRNAs主要通过调节口腔鳞癌中的肿瘤干细胞和EMT在顺铂耐药性中发挥重要作用。
本实验研究结果表明,差异性的miRNAs与干细胞分化、血管生成、癌症途径、Wnt信号途径等信号通路有关。Ries等[16]发现miR-3651水平的改变表达与口腔鳞状细胞癌的复发有关。同样Pellatt等[17]研究表明miR-3651在食管鳞状细胞癌中的表达与肿瘤进展和临床预后的密切相关,在癌症进展中起重要作用,可用作食管鳞状细胞癌患者的独立预后生物标志物。Fang等[18]发现miR-188-5p在肝细胞癌进展中通过靶向FGF5发挥抑制肿瘤的作用,miR-188-5p可作为肝细胞癌的潜在预后生物标志物和治疗靶标。此外Zhang等[19]研究表明miR-188-5p通过靶向LAPTM4B表达从而抑制前列腺癌的肿瘤生长和转移。Huang等[20]发现miR-663a通过靶向HMGA2抑制肝细胞癌细胞增殖和侵袭。这与本研究中的靶基因功能预测分析相符,为OSCC的早期诊断和靶向治疗提供重要基础研究。miRNAs对口腔鳞癌干细胞的调控和作用机制需要更进一步的实验来阐明。
本研究通过对口腔鳞癌CSCs的miRNAs表达谱检测, 发现了多条表达改变的特异性miRNAs,为进一步研究miRNAs在口腔鳞癌CSCs中的功能及表达调控机制、为探索口腔鳞癌生物治疗新的靶点寻找实验参考。
