釉基质衍生物改性后的牙本质表面对人牙周膜干细胞的影响
2019-06-22李雪健王忠山刘茜冯晓珂刘欢宁潇赵铱民
李雪健 王忠山 刘茜 冯晓珂 刘欢 宁潇 赵铱民
成体干细胞用于人类某些疾病的研究进展迅速,如利用人脐带间充质干细胞治疗活动性类风湿性关节炎已被用于临床,其安全性和有效性已得到证实[1],将人牙周膜干细胞(human periodontal ligament stem cells,PDLSCs)应用于牙周缺损的基础和临床研究也越来越多。以往大量研究表明[2],釉基质衍生物在牙齿以矿化发育过程中起到重要作用,且具有较强的促进牙周膜的再生以及诱导无细胞牙骨质形成的能力,而且这种再生形式与组织在胚胎期的原始发育过程类似。在本研究中,首先制备脱矿牙本质支架(treated dentin matrix,TDM),然后加载不同浓度釉基质衍生物(enamel matrix derivative, EMD),研究其对人牙周膜干细胞的黏附、增殖、细胞伸展的影响以及分化诱导作用。
1 材料与方法
1.1 主要材料与设备
α-MEM培养基、双抗、胰蛋白酶(Hyclone, 美国); I型胶原酶(Gibco,美国);EDTA溶液胎牛血清(BI,以色列);CCK-8试剂盒(南京恩晶生物科技有限公司);低速金刚石切割机(沈阳科晶自动化设备有限公司);超净工作台(山东博科生物产业有限公司);CO2细胞孵育箱(Thermo Forma, 美国);釉基质衍生物(Straumann, 瑞士);倒置相差显微镜(Olympus,日本);扫描电子显微镜(日立,日本);离心机、反转录PCR仪(Eppendorf, 德国);实时荧光定量分析仪(Bio-rad, 美国)。
1.2 PDLSCs的分离、培养及鉴定
经患者或其监护人签署知情同意书后,收集18~25 周岁年龄段患者的因正畸需要拔除的前磨牙或埋伏阻生的第三磨牙。无菌环境下,将牙根中1/3处的牙周膜用无菌手术刀片刮下,剪成体积约1 mm3的组织碎片,移至15 ml离心管内,加入浓度为0.2%的I型胶原酶溶液,于37 ℃环境下消化45 min, 其间每隔15 min摇匀1 次,消化后的组织碎片用2 ml α-MEM完全培养基(含10% FBS, 1%双抗)种入六孔板内,移入细胞孵育箱,在37 ℃、 5% CO2环境下培养,采用有限稀释克隆法获取3~5 代PDLSCs用于以下实验备用。
成骨诱导:取第3 代PDLSCs细胞生长至约90%融合时,更换为成骨诱导液(含10% FBS、 1.8 mmol/L KH2PO4、 10 nmol/L地塞米松和50 μg/mL抗坏血酸的α-MEM培养基)继续培养, 3 周后茜素红染色。
成脂诱导:取第3 代PDLSCs细胞生长至约90%融合时,更换为成脂诱导液(含10% FBS、100 nmol/L地塞米松、0.5 mmol/L IBMT、 10 μg/ml胰岛素和50 mmol/L吲哚美辛的α-MEM培养基)进行成脂诱导培养, 2 周后油红O染色。
1.3 脱矿牙本质支架的制备及鉴定
用低速金刚石切割机将所收集离体牙的牙冠部分切割成厚度约1 mm的薄片,利用高速牙科涡轮手机磨除外围牙釉质,然后分别用0.2、 0.25、 0.5 mol/L的EDTA溶液依次脱矿5 min,每换一次脱矿液用无菌PBS超声清洗3 次,每次清洗5 min,超净台中吹风干燥,紫外线照射过夜,扫描电镜观察其表面形态。
1.4 脱矿牙本质支架上釉基质衍生物的加载
首先采用0.1%乙酸溶液溶解一整支EMD-gel,然后将其进一步溶解到α-MEM培养基,配制成0、 50、 100 μg/ml不同EMD浓度的溶液。在无菌操作台中将24 孔板各孔分为3 组,每组5 孔,每组每孔内分别加入1 ml 不同浓度的EMD溶液,将脱矿牙本质支架置于不同分组,并浸泡48 h后取出,冻干,真空干燥后喷金,扫描电镜下观察其表面形态。
1.5 支架上PLDSCs增殖能力检测
将加载不同浓度EMD的TDM支架置于48 孔板,每组浓度设3 孔,将第4 代PDLSCs以3×103个/孔接种在复合支架上,分别加入含0、 50、 100 μg/ml EMD溶液,利用CCK-8试剂盒测量细胞增殖曲线。
1.6 支架上PLDSCs黏附以及细胞伸展能力观察
将第4代PDLSCs以1.5×104个/cm3的密度接种于0、 50、 100 μg/ml EMD溶液复合TDM支架上,将每组细胞分别在接种后第30、 60、 120 min用4%多聚甲醛溶液固定15 min,无菌PBS缓冲液清洗,采用DAPI染色观察不同时间点每组细胞的密度,利用鬼笔环肽染色观察细胞骨架伸展情况。
1.7 支架上PLDSCs成骨及成牙骨质相关基因表达的检测
将第4代PDLSCs接种于0、 50、 100 μg/ml EMD溶液复合TDM支架上,分别在第3 天和第7 天收集细胞,Trizol法提取总RNA,RNA质检合格后反转录成cDNA, RT-qPCR法检测2 组细胞在2 个时间点OCN、ALP、RUNX2、CAP、CEMP-1基因的表达。引物序列见表 1,引物由均北京奥科鼎盛生物科技有限公司合成,以GAPDH为内参,检测目的基因表达量。

表 1 基因引物序列
1.8 统计学分析
所有数据均采用SPSS 16.0软件进行统计学分析, 3 组比较采用方差分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 PDLSCs的培养与鉴定
PDLSCs为长梭型,呈集落样生长(图 1A、1B)。成骨诱导21 d后,茜素红染色后,倒置相差显微镜下可见橘红色钙化结节形成(图 1C);成脂诱导14 d后,油红O染色后可见红色脂滴(图 1D),证明成功培养出具有多向分化潜能的间充质干细胞。
2.2 TDM支架扫面电镜结果
切割后的牙本质片未脱矿前可见明显的玷污层,表面粗糙,遮盖了牙本质小管(图 2),EDTA溶液脱矿后,玷污层被去除,充分暴露牙本质小管,表面相对光滑(图 2)。
2.3 EMD复合TDM支架扫描电镜结果
扫描电镜下观(图 3)TDM支架上有大量不规则球状蛋白聚合物平铺于表面,部分进入牙本质小管内,直径约为1~10 μm,其密度随加载EMD的浓度0、 50、 100 μg/ml依次增加,说明EMD溶液中的各种蛋白能够沉积到牙本质表面并且进入牙本质小管发挥作用。
2.4 TDM支架对PLDSCs增殖的影响
CCK-8测定的细胞增殖曲线(图 4)显示,不同浓度EMD改性的TDM支架对PDLSCs的增殖有不同的促进作用,且存在一定的剂量依赖效应。
2.5 TDM支架上PLDSCs黏附伸展能力
细胞黏附结果(图 5~6)显示,第30、 60、 120 min,不同组复合支架上黏附的细胞的数目不同,且随EMD浓度数值的增加而升高。且在120 min, 相比对照组, 50、 100 μg/ml EMD组的PDLSCs出现了更多的细胞突,伸展程度更明显(图 7),说明EMD改性的TDM支架对PLDSCs的黏附伸展均有促进作用。
图 1 PDLSCs形态与鉴定
(倒置显微镜,×40)
A: Cultured P0 PDLSCs; B: Cultured P3 PDLSCs; C: Alizarin red staining; D: Oil red O staining
Fig 1 Characterization of PDLSCs
(Inverted microscope, ×40)

图 2 牙本质片表面形态(SEM, ×5 000) 图 3 EMD复合TDM支架表面形态
(SEM, ×5 000)
Fig 2 Surface morphology of dentin matrix Fig 3 Surface morphology of EMD treated TDM
(SEM, ×5 000) (SEM, ×5 000)

图 4 PDLSCs增殖曲线
2.6 TDM支架对PLDSCs成骨及成牙骨质相关基因表达的影响
加载EMD后,在第3 天,CAP、CEMP-1成牙骨质相关基因,OCN、ALP、RUNX2成骨相关基因均呈现上调的表达趋势(图 8);在第7 天, 除早期表达的ALP外,其他结果与第3 天相似,提示EMD改性的TDM支架对PLDSCs成骨及成牙骨质相关基因表达有促进作用。

图 5 PDLSCs接种60 min后DAPI染色荧光显微镜下观
(×100)
Fig 5 PDLSCs stained with DAPI under a fluorescence microscope after 60 min of incubation
(×100)
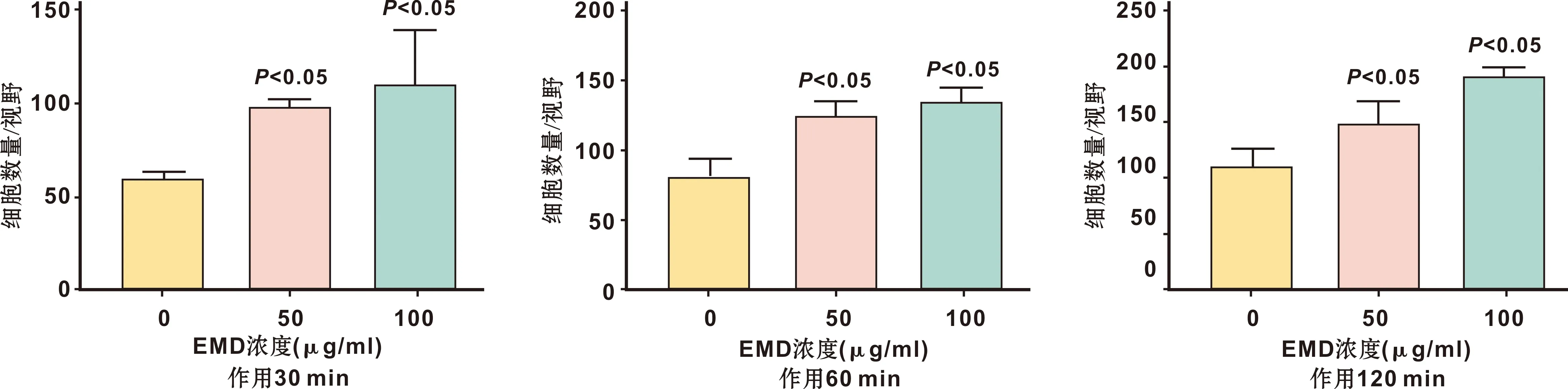
图 6 细胞数量对比

图 7 PDLSCs接种120 min后鬼笔环肽染色荧光显微镜下观
(×100)
Fig 7 PDLSCs stained with phalloidin under a fluorescence microscope after 120 min of incubation
(×100)

图 8 PDLSCs基因表达
3 讨 论
釉基质衍生物的来源为牙齿发育期的成釉上皮细胞以及Hertwig 氏上皮根鞘的内层细胞,其主要成分包括釉原蛋白(amelogenin),釉蛋白(enamelin)、成釉蛋白(ameloblastin)、釉成熟蛋白(amelotin)和硫化釉蛋白(sulfated enamel proteins)以及一些蛋白酶类[3]。其中釉原蛋白占主要蛋白成分的90%以上,它们可以自组装成超分子聚合物,形成不溶的细胞外基质,来控制釉质晶体发生过程中的超微结构的形成[4]。基础研究表明, 釉基质衍生物可以增强T淋巴细胞的增殖和迁移能力[5],减少细菌的数量[6-7],从而减弱机体的炎症状态;应用釉基质衍生物后,微血管细胞的分化及组织再血管化得到促进,表明其在创伤愈合中的软组织再生中可以发挥一定作用[8-9]。以釉基质衍生物为主要成分的商品试剂Emdogain®[10]已在其他国家被广泛应用于牙周缺损治疗的各类牙周手术中,其安全性与有效性已得到证实,对牙周组织创伤愈合以及牙周软硬组织的再生均有促进作用,但釉基质衍生物与人牙周膜干细胞的联合应用尚未见报道。
脱矿牙本质支架来源于人不再行使功能的牙齿,如因正畸需要拔除的前磨牙或埋伏阻生的第三磨牙,然后通过切割、冲洗、脱矿等工序制备而成。TDM内富含骨形态发生蛋白(bone morphogenetic protein,BMP),BMP对血管周的间质干细胞有成骨和成软骨向的诱导分化作用[11],TDM有一定的诱导骨形成作用,是一种很好的骨移植材料。在体外实验中,TDM也是模拟体内牙本质暴露环境的最佳选择。
本研究首次将釉基质衍生物加载于脱矿牙本质支架上,成功制备了EMD改性的牙本质支架,并对其表面形态观察,发现EMD能够沉积于牙本质表面,且进入牙本质小管发挥作用。探究改性后的牙本质支架对牙周膜干细胞的生物学作用结果显示,其对PDLSCs的黏附、伸展、增殖均有促进作用,且存在一定的浓度依赖效应,此结果对于再生医学中,组织形成的基础,种子细胞的生存有着很明显的意义。同时,细胞内转录水平研究表明,EMD改性后的牙本质支架对PDLSCs内成骨及成牙骨质向分化的相关基因的表达均有促进作用。
牙周再生医学领域中,牙槽骨再生[12]、牙周纤维的再生已有大量研究和进展,但牙骨质的再生一直是世界性的难题,导致很多的牙周缺损治疗效果不佳,釉基质衍生物联合人牙周膜干细胞共同作用有望成为实现牙骨质再生,治疗牙周缺损的有效方法。本研究用EMD加载于牙本质支架上,与临床贴近,进一步模拟了临床牙周病患者牙本质暴露的环境,在此基础之上,其对人牙周膜干细胞的生物学作用的意义更加深远。
