顺铂与奈达铂同步放化疗治疗宫颈癌的疗效与安全性比较▲
2019-06-19李金砖陈绍俊
李金砖 陈绍俊
(广西医科大学第四附属医院暨柳州市工人医院肿瘤科,柳州市 545005,电子邮箱:373043410@qq.com)
宫颈癌是常见的妇科恶性肿瘤之一,其发病率位居女性恶性肿瘤的第二位,而死亡率居首位,严重威胁妇女的健康和生命[1]。据统计,全球每年有50万左右的宫颈癌新发病例,其中80%以上发生在发展中国家[2]。宫颈癌的治疗方法有手术、放疗及化疗等,原则上手术治疗适用于Ⅰ~ⅡA期宫颈癌,放疗适用于各期宫颈癌。对于ⅠB2、ⅡA2及ⅡB~ⅣA期宫颈癌患者,以放疗联合铂类为基础的同步化疗可提高患者生存率,美国国立综合癌症网络指南推荐顺铂作为同步化疗药物,但临床上常选用奈达铂进行同步化疗。本研究比较采用顺铂和奈达铂进行同步放化疗序贯后装放疗治疗宫颈癌的临床疗效及不良反应,以期为临床医师选择治疗方式提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2013年1月至2015年12月在我院就诊的115例宫颈癌患者的临床资料,均接受同步放化疗序贯后装放疗。纳入标准:(1)病理诊断为宫颈癌;(2)年龄为20~65岁;(3)按国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2009临床分期标准,分期为ⅠB2期、ⅡA2期或ⅡB~ⅣA期。排除标准:(1)不同意同步放化疗序贯后装放疗;(2)有化疗史、盆腔放疗史或合并有其他恶性肿瘤;(3)有放化疗禁忌证。115例患者的发病年龄为34~65岁,中位年龄为55岁,其中40~60岁占73.9%(85/115);病理类型以鳞癌为主,占93.0%(107/115);高危型人乳头瘤病毒(human papilloma virus,HPV)感染阳性率为60.0%(69/115)。将所有患者分为顺铂组54例和奈达铂组61例,两组患者的年龄、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、病理类型、FIGO分期、高危型HPV感染情况、化疗周期数等资料比较,差异均无统计学意义(均P>0.05),具有可比性。见表1。
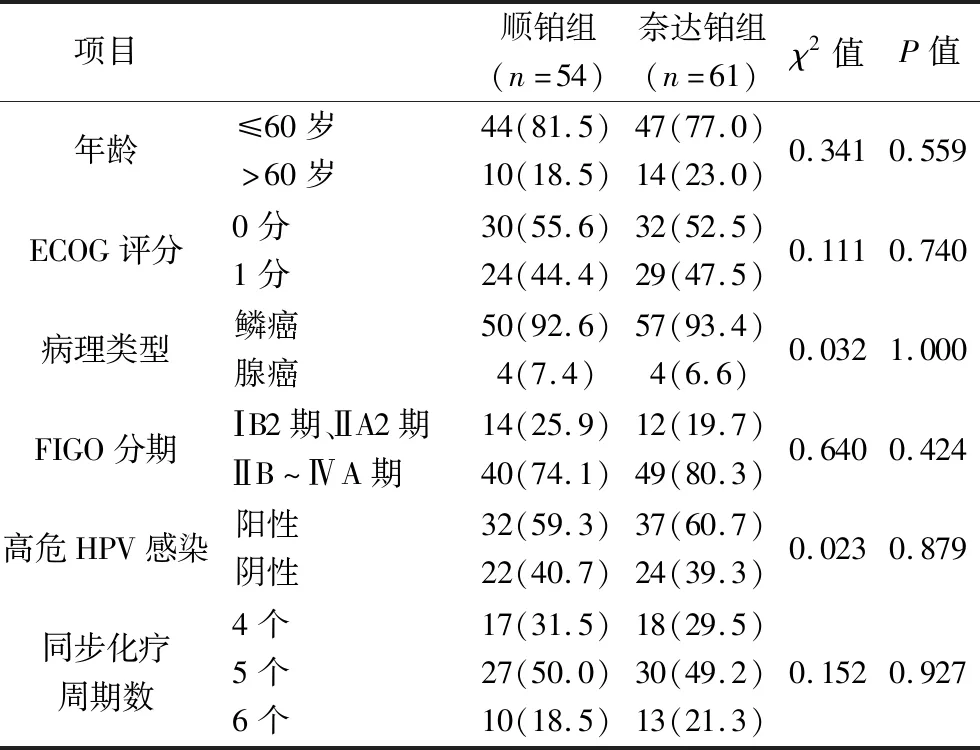
表1 两组患者的临床特征比较[n(%)]
1.2 治疗方法 (1)放疗:采用盆腔三维适形放疗序贯后装放疗,盆腔外照射45 Gy,1.8 Gy/次,1次/d,5次/周,连续5周。在外照射结束后针对宫颈局部病灶进行后装放疗,沿宫颈管纵轴方向,阴道侧穹隆黏膜顶端向宫底方向2 cm处,并从中轴左右各旁开2 cm的点为处方剂量点,该点总剂量85 Gy。(2)同步化疗:顺铂组采用顺铂(齐鲁制药有限公司,国药准字H20023460)40 mg/m2静脉滴注,奈达铂组采用奈达铂(齐鲁制药有限公司,国药准字H20050563)40 mg/m2静脉滴注,两组均为每周1次,共治疗4~6个周期(1周为1个周期)。
1.3 观察指标 (1)近期疗效:完全缓解为所有靶病灶完全消失;部分缓解为靶病变直径之和比基线水平减少≥30%,但未达到完全缓解;进展为靶病变直径之和增大≥20%,或出现新的病变;稳定为介于进展与部分缓解之间。放疗结束时评价客观疗效,包括客观缓解率及疾病控制率,其中客观缓解率=(完全缓解+部分缓解)例数/可评价病例数×100%,疾病控制率=(完全缓解 +部分缓解+稳定)例数/可评价病例数×100%。(2)远期疗效:随访方式包括门诊或住院复查、电话询问,随访截止日期为2017年12月,随访时间11~58个月,中位时间为38.5个月。记录1、3、5年总生存期和无进展生存期。(3)不良反应发生率:参照美国国家癌症研究所制定的常见毒性分级标准,对两组患者在同步放化疗期间发生的骨髓抑制、胃肠道反应及肾功能损害等不良反应进行分级,统计不良反应发生率。
1.4 统计学分析 应用SPSS 20.0软件进行统计学分析。计数资料以例数或百分比表示,比较采用χ2检验;采用Kaplan-Meier法描绘生存曲线,采用log-rank检验比较生存率;采用Cox比例风险回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组近期客观疗效比较 放疗结束时,顺铂组客观缓解率、疾病控制率均为100%,奈达铂组客观缓解率、疾病控制率均为96.7%(59/61),两组客观缓解率、疾病控制率比较,差异均无统计学意义(均χ2=1.625,P=0.682),见表2。

表2 两组近期客观疗效比较(n)
2.2 两组远期疗效比较 顺铂组放疗结束后1、3、5年的生存率依次为98.0%、81.0%、62.0%,奈达铂组依次为100.0%、86.0%、65.0%。两组的总生存率比较,差异无统计学意义(χ2=0.659,P=0.417),见图1。顺铂组放疗结束后第1、3、5年无进展生存率依次为98.0%、81.0%、62.0%,奈达铂组依次为97.0%、85.0%、64.0%。两组放疗结束后的无进展生存率比较,差异无统计学意义(χ2=0.213,P=0.645),见图2。

图1 两组患者的总生存率比较 图2 两组患者的无进展生存率比较
2.3 两组不良反应发生率比较 两组患者的胃肠道反应发生率、骨髓抑制发生率、肾功能损害发生率比较,差异均有统计学意义(均P<0.05)。其中顺铂组的Ⅱ度胃肠道反应发生率高于奈达铂组,两组患者均未发生Ⅲ、Ⅳ度胃肠道反应,对治疗耐受性良好;奈达铂组Ⅲ~Ⅳ度骨髓抑制的发生率高于顺铂组;顺铂组Ⅰ度肾功能损害发生率高于奈达铂组,两组患者在治疗过程中均未发生Ⅱ~Ⅳ度肾功能损害。见表3。
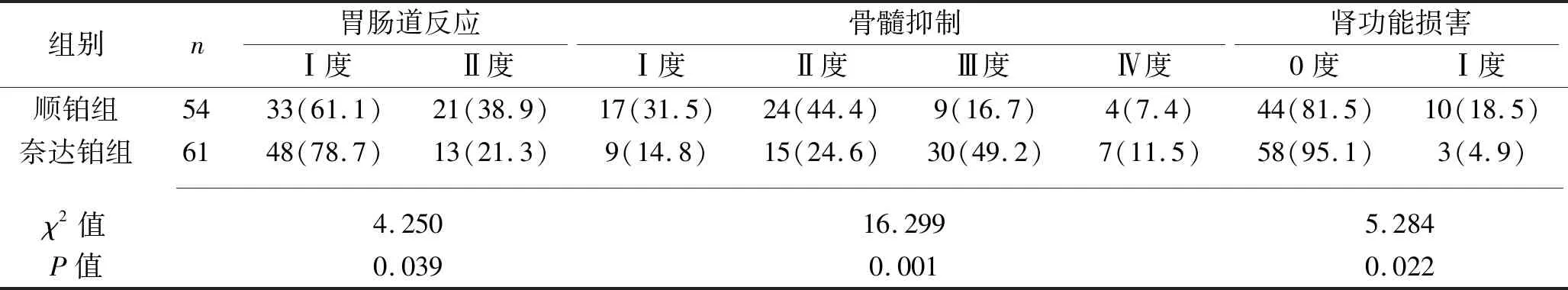
表3 两组患者不良反应发生情况比较[n(%)]
2.4 宫颈癌患者总生存期及无进展生存期的影响因素 分别以患者的总生存期(0=生存,1=死亡)、无进展生存期(0=生存,1=死亡)为因变量,以年龄(连续变量)、病理类型(1=鳞癌,2=腺癌)、FIGO分期(1=ⅠB2期、ⅡA2期,2=ⅡB~ⅣA期)、ECOG评分(0=0分,1=1分)、高危型HPV感染(1=阳性,2=阴性)、化疗药物(1=顺铂,2=奈达铂)、化疗周期数(1=4个周期,2=5个周期,3=6个周期)、胃肠道反应(1=Ⅰ度,2=Ⅱ度)、骨髓抑制(1=Ⅰ度,2=Ⅱ度,3=Ⅲ度,4=Ⅳ度)、肾功能损害(0=0度,1=Ⅰ度)为自变量,采用Cox模型进行多因素分析。结果显示以上各项因素对患者的总生存期、无进展生存期均无影响(均P>0.05)。
3 讨 论
宫颈癌的患病高峰年龄为40~60岁,20岁以前的发生率很低[3],病理类型包括鳞癌、腺癌及腺鳞癌等,其中以鳞癌为主[3-4]。宫颈癌的发生与多种因素有关,其中HPV持续感染是导致宫颈癌发生的重要因素之一,特别是高危型HPV感染[5-6]。本研究中,115例患者的中位发病年龄为55岁,其中40~60岁者占73.9%,病理类型以鳞癌为主,高危型HPV感染阳性率较高,为60%,均与上述文献结果相似。
宫颈癌的治疗方法有手术、放疗、化疗等,其中放疗适用于各期宫颈癌。对于FIGO分期为ⅠB2期、ⅡA2期或ⅡB~ⅣA期的宫颈癌患者,相较于单纯放疗,放疗期间给予顺铂同步化疗可以提高疗效[7-8]。目前美国国立综合癌症网络指南以Ⅰ类证据推荐顺铂用于宫颈癌的同步放化疗,但在临床上治疗宫颈癌时选用的同步化疗药物既有顺铂,也有奈达铂。奈达铂为顺铂类似物,抗瘤谱广,以与顺铂相同的方式结合DNA,并抑制DNA复制,从而产生抗肿瘤活性。有研究显示奈达铂治疗宫颈癌的疗效优于顺铂[9],但也有学者发现两者疗效无明显差异[10]。本研究结果显示,顺铂组与奈达铂组患者的总生存期及无进展生存期比较差异均无统计学意义(均P>0.05),多因素分析结果显示,同步化疗选择顺铂或者奈达铂不影响患者总生存期及无进展生存期。但顺铂组的Ⅱ度胃肠道反应及Ⅰ度肾功能损害发生率均高于奈达铂组(均P<0.05),而奈达铂组Ⅲ~Ⅳ度骨髓抑制的发生率更高,所有患者均未出现Ⅲ~Ⅳ度的血红蛋白减少。在发生Ⅳ度骨髓抑制的11名患者中,顺铂组有4例为白细胞计数和(或)中性粒细胞绝对值下降,奈达铂组有5例为白细胞计数和(或)中性粒细胞绝对值下降,有2例同时出现白细胞计数、中性粒细胞绝对值及血小板减少,但所有患者在使用重组人粒细胞刺激因子升白细胞和(或)重组人白细胞介素-11升血小板治疗后均能逐渐好转,不影响原有的治疗计划。陈雨等[11]的研究也证实,在宫颈癌的化疗中应用奈达铂或顺铂联合紫杉醇的方案,顺铂的胃肠道毒性发生率高于奈达铂,但后者的骨髓抑制发生率高于前者,与本研究结果相似。
综上所述,对于ⅠB2、ⅡA2期及ⅡB~ⅣA期宫颈癌患者,应用奈达铂行同步放化疗的近远期疗效与顺铂相似,胃肠道毒性反应较小,但Ⅲ~Ⅳ度骨髓抑制的发生率更高。由于本研究为回顾性的临床分析,得出的结论可能存在一定的偏倚,尚需增大样本量进行随机对照研究以进一步证实。
