靶向CCL2-CCR2轴的肿瘤治疗研究进展
2019-06-04卢小妹付杰军
卢小妹,付杰军
0 引言
趋化因子(chemokine)是一类能够趋化细胞定向移动的小分子(分子量多为8~10 kD)蛋白。按照一级结构N端半胱氨酸残基数目和位置不同可将趋化因子分为4类:C、CC、CXC和CX3C。趋化因子受体属于G蛋白偶联受体,趋化因子与靶细胞上的XCR、CCR、CXCR、CX3CR特异性受体结合发挥生物学作用[1]。1989年Yoshimura等首次纯化鉴定了单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1/CCL2)[2]。
1 CCL2-CCR2轴在肿瘤发生发展的作用
1.1 CCL2基因的表达调控
CCL2是趋化因子中CC亚族的重要成员之一。人类CCL2基因位于17号染色体,包含3个外显子和2个内含子。CCL2以前体蛋白形式分泌,完整的CCL2由76个氨基酸残基组成。CCL2可以趋化单核细胞、巨噬细胞和T淋巴细胞[3]。已知CCL2可以结合CCR2和趋化因子受体CC族受体4(chemokine receptor 4, CCR4),但CCL2可能主要与CCR2结合[1,4]。CCR2位于3号染色体上,编码355个氨基酸残基蛋白,包括CCR2A和CCR2B两个亚型。CCR2属于G蛋白耦联受体,在各种细胞类型上都有发现,包括嗜碱性粒细胞,单核细胞,自然杀伤细胞和T细胞[3]。CCL2和CCR2结合虽然不具有专一性,从CCL2-/-、CCR2-/-基因敲除小鼠具有相似的功能表型可以推测CCL2主要通过与CCR2结合发挥其生物学效应[3-4]。
趋化因子CCL2有自分泌或旁分泌两种形式。在正常组织细胞中,CCL2可由多种活化的细胞产生,如成纤维细胞、内皮细胞、淋巴细胞以及巨噬细胞。研究表明乳腺癌、肺癌、前列腺癌以及结直肠癌等多种肿瘤细胞也能产生CCL2。NF-κB、Sp1、AP-1和p53等转录因子参与CCL2的基础表达或炎症刺激表达调控。肿瘤微环境中的细胞因子TNFα、LPS、IL-1、IL-6和TGF-β等可刺激肿瘤细胞显著促进CCL2的表达[1]。最近的研究[5-6]表明CCL2的表达调控除了这些已知经典的转录因子和激活通路,还有一些重要的非经典通路。哺乳动物雷帕霉素复合体I(mammalian target of rapamycin complex 1, mTORC1)是一类蛋白激酶,能够被胰岛素激活应答。叉头框家族转录因子K1(forkhead box K1, FOXK1)属于叉头框(Fox)转录因子家族。Notch信号通路进化上高度保守,调节细胞、组织和器官的发育。胞内段NICD是Notch受体蛋白的活化形式。有研究报道两条非经典通路mTORC1-FOXK1[5]和Notch1-NICD1[6]参与了CCL2的调控,从而促进了肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)的募集和浸润。大多数研究认为TAM类似于M2型巨噬细胞, 在肿瘤微环境的作用下分化成熟,促进肿瘤细胞生长、侵袭和转移。日本研究人员发现mTORC1通过下游转录因子FOXK1去磷酸化激活应答,促进CCL2的表达。裸鼠动物模型实验也证明了抗肿瘤药物雷帕霉素减弱肿瘤相关巨噬细胞的浸润[5]。F-Box和WD40蛋白7(F-Box and WD40 domain protein 7, FBXW7)是Cul1泛素连接酶复合物结合的F-box之一,介导c-myc、Notch、cyclin E、c-Jun和KLF5的降解。研究人员在鼠源骨髓间充质干细胞中敲除Fbxw7,发现可以诱导Notch蛋白的积累并随后转录激活CCL2基因,导致巨噬细胞的募集,对Fbxw7缺陷小鼠给予CCL2受体拮抗剂可以阻断肿瘤转移[6]。
1.2 CCL2-CCR2轴促进肿瘤转移
肿瘤转移是恶性肿瘤的主要特征,大多数肿瘤患者因为发生肿瘤转移死亡。1889年英国医生Paget通过分析乳腺癌患者的数据后提出了著名的“种子与土壤学说”[7]。近年的研究也提供了新的证据,肿瘤细胞转移过程中不仅可以适应新的微环境,还可以改变微环境为转移前微环境。肿瘤微环境是指肿瘤生长及转移肿瘤细胞所处的内外环境,其中包括肿瘤细胞周围的成纤维细胞、免疫和炎性细胞、胶质细胞等。目前肿瘤微环境与肿瘤细胞相互作用是肿瘤发展和转移领域的研究热点之一。CCL2作为在肿瘤微环境中重要并且研究广泛深入的趋化因子之一,通过自分泌或旁分泌促进肿瘤细胞生长与存活,参与肿瘤免疫耐受调节,诱导肿瘤血管生成,促进肿瘤侵袭和转移[8]。许多研究表明在乳腺癌、前列腺癌、肝癌、结肠癌、胰腺癌、胃癌和肺癌等肿瘤患者组织或血清中发现CCL2水平升高,且与肿瘤进展分级分期、侵袭转移和患者的预后密切相关[4]。目前已知CCL2促进肿瘤转移的机制主要为以下三种作用机制。
1.2.1 CCL2-CCR2轴直接作用或通过募集肿瘤相关巨噬细胞(TAM)促进肿瘤转移
CCL2直接作用于血管内皮细胞膜上的CCR2受体,趋化内皮定向细胞运动。趋化因子CCL2及其受体CCR2在募集TAMs参与肿瘤侵袭转移发挥重要作用,CCL2通过募集TAM浸润肿瘤组织,分泌VEGF、TGF-β、TNF-α等细胞因子,促进肿瘤细胞生长与血管生成,同时还分泌基质金属蛋白酶MMP2、MMP9,参与细胞外基质破坏与重构,促进肿瘤细胞侵袭和转移。有研究报道,抗CCL2抗体阻断CCL2的作用如减少骨髓来源抑制细胞(MDSC)、增加CD4+和CD8+T细胞侵润,促进IFNγ分泌等,能增强抗程序性死亡受体-1(PD1)治疗小鼠肺癌的肿瘤免疫效果[9]。
1.2.2 CCL2-CCR2轴通过激活肿瘤相信号通路促进肿瘤转移
CCL2-CCR2轴通过激活肿瘤细胞内的信号通路如磷脂酰肌醇-3-激酶(PI3K)/Akt信号通路、Smad3、p42/p44MAPK、ERK1/2-MMP2/9等信号通路,或通过蛋白激酶C依赖性蛋白酪氨酸磷酸化等途径而直接影响肿瘤细胞的生长、迁移及浸润[1,4]。有研究[10]报道CCL2-CCR2轴激活ERK1/2-MMP2/9促进鼻咽癌转移。CCL2在鼻咽癌患者血清中水平显著升高,而CCL2或CCR2在鼻咽癌组织高表达与鼻咽癌远处转移和总生存率密切相关。在鼻咽癌细胞系CNE2细胞和SUNE1细胞高转移株(S18和58-F)CCL2或CCR2表达显著高于低转移的细胞株(S26和SUNE1)。在低转移的细胞株过表达CCL2或CCR2能促进细胞浸润和迁移,而外源性的CCL2处理不能逆转干扰CCR2细胞的浸润和迁移能力。在裸鼠移植瘤实验中,过表达CCL2或CCR2,肿瘤更容易发生远处转移,而且过表达CCR2的结果更明显。说明CCL2-CCR2轴能促进鼻咽癌侵袭和转移。同时过表达CCL2和CCR2可以激活ERK1/2细胞通路,诱导基质金属蛋白酶MMP2和MMP9表达,这可能是CCL2-CCR2促进鼻咽癌转移的机制之一[10]。
1.2.3 CCL2-CCR2轴通过诱导肿瘤细胞发生EMT促进肿瘤转移
上皮间质转化(epithelial-mesenchymal transition, EMT)可能也是CCL2-CCR2轴促进肿瘤侵袭和转移的关键步骤之一。上皮来源的恶性肿瘤细胞可发生EMT获得迁移和侵袭能力。有研究报道CCL2-CCR2轴通过激活ERK/GSK3β[11],PI3K/AKT/NFκB[12],P38MAPK[13],STAT3[14]和Hedgehog[15]等信号通路诱导肿瘤细胞发生EMT。
2 靶向CCL2-CCR2轴的临床前研究
目前,通过使用CCL2中和抗体或CCR2抑制剂靶向CCL2-CCR2轴的乳腺癌[16-17]、前列腺癌[18]、肝癌[19]、肺癌[20]和结直肠癌[21]等恶性肿瘤临床前动物实验研究均取得了较好的抑制肿瘤生长和转移的作用。值得注意的是,有研究报道在小鼠乳腺癌实验中用CCL2中和抗体抑制CCL2水平,一旦实验终止抗CCL2药物处理,小鼠血清CCL2水平会迅速代偿性反弹,并加速小鼠乳腺癌肺部转移及死亡[16]。靶向CCL2-CCR2轴的肿瘤临床前研究的相关试验情况,见表1。
2.1 前列腺癌
美国密歇根大学Loberg教授等报道了在SCID小鼠(T细胞和B细胞免疫缺陷)皮下注射前列腺癌细胞VCap,靶向人源CCL2中和抗体CNTO888或小鼠CCL2中和抗体C1142都能显著抑制皮下移植瘤的生长,并减少CD68+巨噬细胞浸润以及肿瘤微血管的形成[18]。他们进一步研究了SCID小鼠心脏注射PC3前列腺癌细胞构建的肿瘤转移模型。每2周腹膜腔内注射CNTO888或JEC1142,5周后注射CNTO888肿瘤转移减少了47%,而注射JEC1142肿瘤转移减少了87%。说明阻断宿主来源的CCL2在实验中抑制肿瘤转移更显著。前列腺癌常发生胫骨(Tibia)转移,注射CNTO888发生胫骨肿瘤转移降低了96%,注射JEC1142则降低了95%。虽然CNTO888单独使用抗肿瘤生长的作用不如多西紫杉醇(40 mg/kg, 3周),但与多西紫杉醇联合使用可增强其抗肿瘤的活性。由于人源CCL2中和抗体CNTO888或小鼠CCL2中和抗体JEC1142都有显著的抗肿瘤作用,说明肿瘤细胞来源或宿主基质细胞来源的CCL2在促进前列腺癌细胞生长存活以及骨转移过程中都发挥重要作用[22]。
2.2 肝癌
肝细胞癌是我国高发且侵袭转移程度高的恶性肿瘤。Li等研究发现,阻断CCL2-CCR2信号可以抑制肿瘤组织内部TAMs的浸润和M2极化,激活CD8+T细胞。通过建立小鼠肝癌细胞Hepa1-6、LPC-H12、H22的多种肝癌模型(同源小鼠原位肝癌模型、术后复发模型、皮下接种模型),使用GlaxoSmithKline公司的CCR2拮抗剂RDC018(30 mg/kg)处理或者通过利用CCR2基因敲除小鼠阻断CCL2-CCR2信号,能够显著抑制肿瘤生长和转移、降低手术后复发、延长生存期[19]。Yao等从长苞冷杉提取筛选了一个天然CCR2拮抗剂(747),通过体内外实验证实了其具有良好的选择性和安全性,可以通过阻止肿瘤巨噬细胞浸润,增加CD8+T细胞的数量并增强CD8+T细胞的杀伤能力来抑制肝癌发展,并且作为免疫调节剂联合低剂量的肝癌靶向治疗药物索拉菲尼,可增强索拉菲尼的治疗效果。实验中止CCR2抑制剂治疗后,没有观察到小鼠肝癌恶化的进展,并且CCR2抑制剂治疗可以使肝癌小鼠存活时间更长[23]。
2.3 乳腺癌
Qian等[16]报道了CCL2募集CCR2+的炎性单核细胞促进小鼠乳腺癌细胞Met-1(PyMT诱导)播散和转移。人源或小鼠来源的CCL2抗体都能显著阻断Met-1细胞的肺转移。Bonapace等[17]也报道了CCL2的抗体(R&D公司)阻断小鼠乳腺癌细胞4T1.2的CCL2而抑制单核细胞从骨髓处释放以及巨噬细胞浸润和血管渗透,从而减少肺部转移灶的形成。然而中止抗CCL2治疗,会加速乳腺癌肺转移、血管的形成以及小鼠的死亡。CCL2抗体治疗中止10天后,CCL2水平迅速反弹显著增加,骨髓大量释放单核细胞进入血液,CCL2募集单核细胞进一步分化为巨噬细胞。巨噬细胞产生的血管生长因子(VEGF-A)和白介素-6(IL-6)可能参与介导了此过程。当继续用抗CCL2抗体时,仍可观察到其抗转移作用。在停止抗CCL2治疗后,通过抗VEGF-A处理能逆转肿瘤的快速转移,可以使肿瘤进展处于正常速度。Bonapace等的研究结果提示,靶向肿瘤微环境是成功抑制肿瘤细胞转移的一个重要因素,需要谨慎考虑抗CCL2在肿瘤转移中作为单一药物治疗。
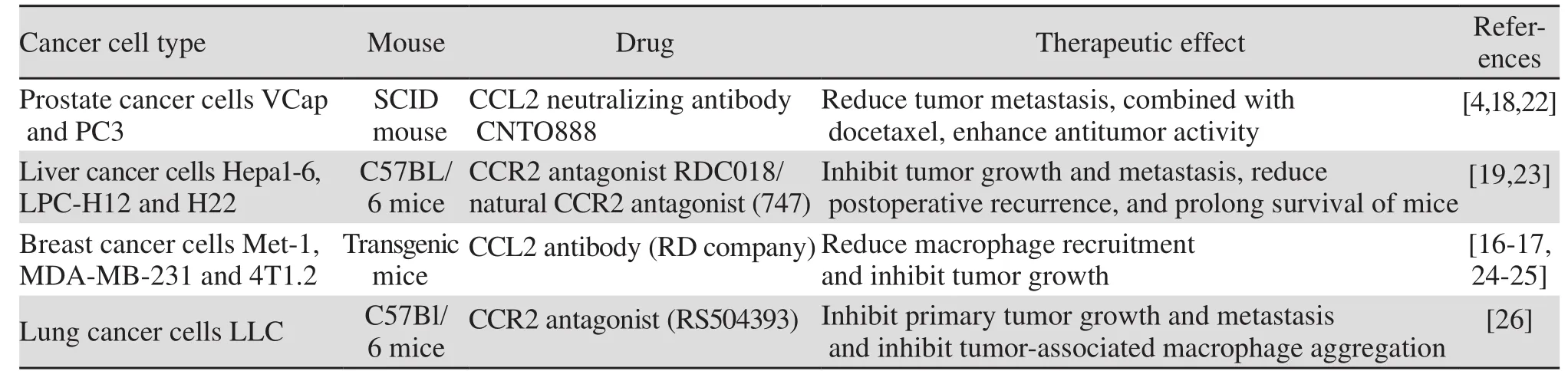
表1 靶向CCL2 -CCR2轴的动物模型研究Table1 Animal model research targeting CCL2-CCR2 axis
3 靶向CCL2/CCR2轴的临床试验研究
鉴于靶向CCL2-CCR2轴的多个临床前肿瘤动物实验已经取得较好的效果。目前已开展了多项靶向阻断前列腺癌和胰腺癌等实体瘤患者CCL2-CCR2轴的Ⅰ期或Ⅱ期临床试验研究,评价阻断CCL2-CRR2药物的安全性、药效以及药代动力学。使用CCL2中和抗体和CCR2抑制剂靶向CCL2-CCR2轴的多个临床试验情况,见表2。
3.1 CCL2中和抗体CNTO888
由Centocor公司开发的首个靶向人CCL2的药物carlumab,也称为CNTO888,是IgG1k单克隆抗体,其以高亲和力(解离常数15 pM)结合CCL2,与CCR2受体结合位点直接竞争。一项临床试验(NCT00537368)对CNTO888单独或与其他常用化疗药物组合在实体瘤中使用的安全性、药效和药代动力学参数进行了评估。CNTO888在44名患有常规治疗难治的晚期实体瘤患者给药处理试验中耐受性良好。试验中,患者静脉注射接受从0.3至15 mg/kg逐步提高浓度的CNTO888。经第1,28天后每两周给药。试验没有观察到最大毒性剂量,试验结果提示CNTO888 Ⅱ期临床试验的注射剂量可以是每两周15 mg/kg。与临床前CCL2中和抗体动物模型实验取得阻断CCL2并有效抑制肿瘤生长和侵袭转移不同,CNTO888给药后游离CCL2水平暂时受到了抑制,随后游离CCL2浓度增加甚至超过治疗前基线值的水平,治疗后总的CCL2(包括CNTO888-CCL2复合物)可增加1 000倍以上[27]。因此,试验总体上实体瘤患者并没有从使用CNTO888治疗中受益。
Centocor公司也报道了CNTO888另一个Ⅰ期临床试验(NCT01204996)结果。试验评估了53例实体瘤患者给予CNTO888联合4种标准化疗方案的安全性药效和药代动力学。这些患者分成接受CNTO888与多西紫杉醇、吉西他滨、紫杉醇-卡铂以及聚乙二醇化脂质体阿霉素盐酸盐的4个联合用药治疗组。但是,CNTO888与4种化疗药物联合使用,既没有增强这些常用化疗药物的药效,同时与化疗药物联合使用也没有能延长CNTO888有效阻断CCL2的持续时间[28]。因此,CNTO888抑制CCL2的效率和持续时间都没有取得类似临床前动物实验的结果。
在CNTO888治疗前列腺癌的Ⅱ期临床试验研究(NTC00992186)中,46例已接受过激素治疗或手术、多西紫杉醇联合化疗的转移性耐药性前列腺癌患者接受CNTO888单一药物治疗。试验结果显示CNTO888总体上耐受良好,少量患者有轻度至中度不良反应。经CNTO888给药处理后,游离的CCL2水平迅速降低,然而给药后不久游离的CCL2浓度迅速回升并很快超过给药处理前的血清浓度[27]。因此,在这项临床试验中CNTO888给药没有取得具有临床意义的结果,一个重要的原因可能是CNTO888不能在足够的持续时间抑制患者游离的CCL2。虽然使用CNTO888抑制CCL2在临床前小鼠前列腺癌模型中显示出良好的抗肿瘤生长和肿瘤转移的效果。从目前的临床试验结果来看,虽然肿瘤患者对CNTO888耐受性好,但CNTO888不能持续有效抑制游离CCL2,目前的试验手段无法达到具有临床治疗意义的目标。

表2 靶向CCL2 -CCR2信号轴的临床试验Table2 Clinical trials targeting CCL2-CCR2 signal axis
3.2 CCR2抑制剂
3.2.1 CCR2抑制剂MLN1202 MLN1202是一种由美国Millennium Pharmaceuticals公司开发的对CCR2受体具有特异性的人源化IgG1抗体。在一项MLN1202对实体瘤骨转移患者的疗效的Ⅱ期临床试验(NCT01015560)中,44例实体瘤发生骨转移的患者分别在第1、15、29天静脉注射MLN1202(8 mg/kg)后,评估患者包括尿液中尿I型胶原氨基末端肽(urinary type Ⅰ collagen amino terminal peptide, U-NTX)、抗肿瘤活性和免疫应答反应等指标。与CCL2中和抗体CNTO888类似,MLN1202的治疗在患者中具有良好的耐受性。经过43天MLN1202给药处理后,约14%的患者uNTX(测量骨细胞更新代谢率的生物标志物)降低,提示MLN1202在这些患者有积极的疗效[29]。
3.2.2 CCR2抑制剂CCX872 据估计,全球每年确诊的胰腺癌病例超过33.7万,五年存活率仅7%。ChemoCentryx公司公布了其进行的CCR2抑制剂CCX872的胰腺癌Ⅰb期临床试验的患者生存数据。CCX872在健康志愿者的Ⅰ期临床试验结果表明,CCX872耐受性好,适用于慢性或长期给药。此次公布的Ⅰb期临床试验是一项多中心开放标签试验,入组的50位患者都患有晚期不可切除的胰腺癌(76%患者的胰腺癌已经发生转移)。该研究将CCR2抑制剂CCX872与化疗方案FOLFIRINOX(5-氟尿嘧啶、亚叶酸、伊立替康和奥沙利铂)联合使用,所有患者每两周接受FOLFIRINOX治疗一次(最多12次),加上每日剂量的CCX872,共12周。第18个月观察到患者总体生存率为29%。相比于FOLFIRINOX治疗试验的18.2%的生存率,患者生存率已有明显的提高[30]。
4 结论与展望
综上所述,肿瘤细胞来源或基质细胞来源的CCL2促进肿瘤生长、侵袭和转移。临床前动物实验研究表明靶向CCL2-CCR2轴具有显著抗肿瘤生长及抑制转移的作用。CCL2中和抗体CNTO888和CCR2抑制剂MLN1202、CCX872总体上患者耐受性良好,但目前临床试验所取得结果并不理想,其主要原因可能是CCL2中和抗体或CCR2抑制剂均未能在足够长的时间有效阻断CCL2-CCR2轴。另一种可能的原因与抗CCL2抗体的作用模式有关,中和CCL2并未破坏骨髓产生单核细胞的功能,而只是阻断单核细胞募集。我们相信随着靶向CCL2-CCR2轴的癌症治疗策略相关机制的阐明,将为抗肿瘤相关巨噬细胞治疗和抑制肿瘤转移提供新的思路,让更多肿瘤患者受益。
