下调Skp2表达抑制骨肉瘤U2OS细胞恶性表型的实验
2019-06-04丁路孙荣鑫白靖平
丁路,孙荣鑫,白靖平
0 引言
骨肉瘤(Osteosarcoma, OS)是骨中常见的原发性侵袭性肿瘤,好发于儿童和青少年[1-2]。像其他肉瘤一样,OS是一种间质细胞来源的恶性肿瘤[3],它通常是局部侵袭性的,早期有全身转移倾向[4]。目前的治疗策略包括术前化疗(新辅助化疗)、手术切除和术后(辅助)化疗。化疗后在无转移的局部性骨肉瘤患者中5年无瘤生存率达到60%~70%,但是中晚期骨肉瘤患者的5年生存率则低于50%[5]。研究表明,遗传变异在骨肉瘤发生与发展的不同阶段起着重要作用,肿瘤抑制基因突变与致癌基因活化与骨肉瘤密切相关[6]。因此,了解骨肿瘤发生的分子机制,以及验证骨肉瘤的新治疗靶点对于制定骨肉瘤的治疗有着重要意义。
本研究通过转染siRNA的方法敲低U2OS细胞中Skp2的表达,研究骨肉瘤中Skp2对细胞生长、凋亡以及细胞周期的影响;同时探讨Skp2对骨肉瘤细胞迁移和侵袭的调控作用。进一步检测沉默Skp2是否影响E-cadherin、Akt及周期蛋白p21和p27。初步探讨Skp2对骨肉瘤细胞生物学行为的影响,阐明Skp2作为骨肉瘤治疗靶点的意义。
1 材料与方法
1.1 细胞及试剂
人骨肉瘤U2OS购自中国科学院上海生科院细胞资源中心。细胞培养在含10%胎牛血清的DMEM培养液中,将其置于37℃、5%CO2细胞培养箱中培养。MTT(3-(4,5-二甲苯并噻唑-2-基)-2,5-二苯基四唑溴化物)为美国Sigma公司产品。抗-p21、抗p27、抗-E-cadherin、抗-Akt和抗-pAkt多克隆抗体购自美国Cell Signaling Technology公司。Tubulin及Skp2多克隆抗体均购自美国Santa Cruz Biotechnology公司。Lipofectamine 2000购自美国Thermo Fisher Scientific公司。Annexin V/PI双染试剂盒购自北京碧云天试剂有限公司,钙黄绿素乙酰甲酯(Calcein-AM)染色试剂盒购自美国Invitrogen公司。
1.2 细胞转染
将生长状态良好的U2OS细胞接种于6孔板中,培养大约24 h,待细胞融合度达到70%~80%后,用Lipofectamine 2000分别转染Skp2 siRNAs及对照siRNA。Skp2 siRNA由上海吉玛制药技术有限公司合成。转染5~8 h后弃培养液,再加入2 ml新鲜的完全培养基,继续培养48~72 h。收集细胞检测基因沉默效率用于后续实验。
1.3 RT-qPCR检测
按照TRIzol试剂使用说明提取转染细胞的RNA并反转录合成cDNA。Skp2引物序列为:上游:5'-GCT GCT AAA GGT CTC TGG TGT-3',下游:5'-AGG CTT AGA TTC TGC AAC TTG-3;GAPDH引物序列为:上游:5'-ACC CAG AAG ACT GTG GAT GG-3',下游:5'-CAG TGA GCT TCC CGT TCA G-3',以GAPDH表达作内部参照。通过SDS软件分析Skp2基因表达,溶解曲线全部为单峰表明为特异性扩增,用2-ΔΔCt方法分析Skp2基因表达变化。
1.4 蛋白质印迹分析
收集处理的细胞,加入适量的含蛋白酶抑制剂的细胞裂解液提取总蛋白, 用Bradford法检测蛋白质浓度并制样。以相同的量将蛋白样品加载到每个泳道中,用SDS-PAGE凝胶电泳。将经SDSPAGE分离的蛋白质转移到NC膜上。室温下用5%牛奶封闭NC膜1 h。洗NC膜3~5次,分别用Skp2、p-Akt(ser473)、p21、p27、E-cadherin和Tubulin等第一抗体进行孵育,4℃过夜。洗膜,然后再与辣根过氧化物酶标记的二级抗体进行室温孵育90 min左右。用ECL显影液将目的蛋白表达条带显影于X光片上。用Quantity One软件扫描目的蛋白表达条带进行灰度分析,对比Tubulin蛋白表达量获得目的蛋白的相对表达量,最后对结果进行统计分析。
1.5 MTT测定
收集对数期U2OS细胞将细胞制成细胞悬液,以5×103个/孔接种到96孔板中,培养过夜。转染siRNA,每组设5个复孔,继续培养48和72 h。每孔加0.5%MTT溶液,继续培养4 h。加入150 µl DMSO,置摇床上室温低速振荡10 min,使结晶物充分溶解,利用酶标仪检测OD490 nm处各孔的吸光度。分别在48 h和72 h通过MTT测定细胞活力,确定Skp2对骨肉瘤细胞中细胞增殖的调节作用,从而评估Skp2 siRNA转染骨肉瘤细胞增殖的状况。
1.6 细胞凋亡测定
将转染细胞培养至6孔板中,48 h后收集细胞并用PBS洗涤,加入500 μl结合缓冲液悬浮细胞,再先后加入5 μl Annexin V-FITC和5 μl(PI),避光反应15 min,用FACScan流式细胞仪检测细胞凋亡。
1.7 细胞周期分析
将转染siRNA的U2OS细胞及对照细胞接种到培养皿中培养48 h。收集细胞在磷酸盐缓冲液中洗涤一遍,再用70%冷乙醇固定12 h。次日,用冷PBS洗涤细胞,以1×106个/毫升重悬于PBS中。用核糖核酸酶A(RNase A, 0.1 mg/ ml)于37℃下处理固定的细胞20~30 min。1 000 r/min离心5 min收集细胞,将细胞重新悬浮于荧光染料PI(50 μg/ml)中,使用FACScan流式细胞仪评估细胞周期分布并进行分析。
1.8 Transwell侵袭和迁移实验
细胞侵袭实验:将转染细胞按5×105个/毫升悬浮于无血清DMEM培养基中,取0.2 ml细胞悬液加入到事先辅有Matrigel的Transwell上室中;下室中加入0.5 ml含有10%胎牛血清的DMEM培养基;将Transwell板放到培养箱内,培养24 h。用镊子取出Transwell小室,留在膜上层未穿膜的细胞用棉签轻轻擦去。将膜取出,底面朝上放到24孔板小孔内,加入适量Hanks缓冲液,再加入4 μg/ml Calcein-AM,将侵入Matrigel基质膜及侵入未铺Matrigel的Transwell小室膜的细胞在37℃下染色1 h。在荧光显微镜下进行拍照,各组细胞随机选取6个不同的视野,对穿过膜的侵袭细胞进行计数。
细胞迁移实验:将转染细胞铺在不加Matrigel的Transwell小室膜上,其余操作步骤与细胞侵袭实验相同。
1.9 统计学方法
实验结果采用SPSS17.0统计软件进行处理,计量资料主要采用均数±标准差进行描述,用t-test分析比较Skp2 siRNA转染组和NC siRNA转染组之间的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 骨肉瘤细胞U2OS中转染Skp2 siRNA后对Skp2表达的影响
RT-qPCR结果显示,Skp2 siRNA转染U2OS细胞48 h后,三条siRNA序列都显著下调Skp2 mRNA水平,其中siRNA3序列下调效果最为显著(0.21±0.03, P=0.0001),与对照组相比,Skp2在U2OS细胞中的敲除效率均达到70%左右,见图1A。Western blot结果表明三条siRNA均能有效的敲低Skp2蛋白表达,而siRNA3在U2OS细胞中沉默效果为79%,强于siRNA1的59%和siRNA2的74%,见图1B。因此,后续实验沉默Skp2的表达时均转染siRNA3。
2.2 沉默Skp2后对骨肉瘤细胞增殖的影响
研究表明,通过降低Skp2水平可抑制多种癌细胞增殖。MTT结果表明,在转染Skp2 siRNA 48 h,U2OS细胞生长受到一定程度的抑制,抑制率为34%(P=0.0065),见图2A;而72 h后U2OS细胞生长则被显著抑制,抑制率为64%(P=0.0003),见图2B。
2.3 沉默Skp2对骨肉瘤细胞凋亡的影响
Annexin V-FITC/PI细胞凋亡检测结果显示,沉默Skp2表达可触发U2OS细胞凋亡。与对照组的凋亡率5.45%及转染NC siRNA对照组的5.50%相比,转染Skp2 siRNA的细胞凋亡率增加到18.56%,见图3。
2.4 沉默Skp2对骨肉瘤细胞周期的影响
流式细胞术结果显示,Skp2 siRNA转染组细胞出现典型的G0/G1阻滞。沉默Skp2后,G0/G1期细胞比例从阴性对照组的44.54%,增加到U2OS细胞的76.35%,见图4。结果表明沉默Skp2表达可诱导骨肉瘤阻滞在G0/G1期。
2.5 下调Skp2表达对骨肉瘤细胞迁移和侵袭的影响
将转染Skp2 siRNA的细胞铺在含Matrigel胶的小室膜上,培养大约16 h后,将侵入Matrigel基质膜的细胞用4 μg/ml Calcein-AM在37℃下染色1 h。荧光显微镜拍照,对随机选择的6个视野进行统计,Transwell实验结果表明沉默Skp2显著削弱了U2OS细胞的侵袭能力(23.33±4.71, P=0.0002);将转染Skp2 siRNA的细胞铺在不含Matrigel胶的Transwell小室膜上时,迁移到膜背面的细胞明显减少,表明沉默Skp2同样会抑制U2OS细胞的迁移能力(74.71±8.82, P=0.0021)。结果表明,沉默Skp2的表达显著削弱了U2OS细胞的体外迁移和侵袭能力,见图5。2.6 骨肉瘤细胞沉默Skp2对其下游分子的影响
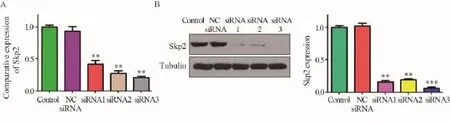
图1 骨肉瘤细胞U2OS中转染Skp2 siRNA后RT-qPCR和Western blot检测Skp2的表达Figure1 Skp2 expression in U2OS cells transfected with Skp2 siRNA measured by RT-qPCR and Western blot
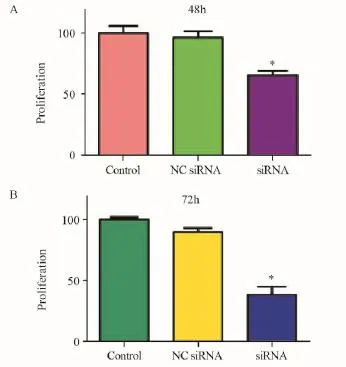
图2 沉默Skp2表达抑制骨肉瘤细胞增殖Figure2 Downregulation of Skp2 expression inhibited proliferation of OS cells
Western blot分析显示,沉默Skp2可增加骨肉瘤细胞中E-cadherin的表达,升高约2.86倍(2.86±0.07, P=0004)。而沉默Skp2后周期相关蛋白p21和p27的表达也显著升高,分别升高约1.79倍和2.16倍(1.79±0.06, P=0.0192; 2.16±0.05,P=0.0124),见图6。表明Skp2在一定程度上可通过靶向p21与p27参与细胞周期调控。沉默Skp2降低了骨肉瘤细胞中p-Akt活性形式分子,p-Akt的表达下降约50%(0.5±0.04, P=0.0027),见图6。
3 讨论

图3 沉默Skp2对骨肉瘤细胞凋亡的影响Figure3 Depletion of Skp2 induced apoptosis of OS cells

图4 沉默Skp2对骨肉瘤细胞周期的影响Figure4 Depletion of Skp2 induced cell cycle arrest of OS cells

图5 沉默Skp2表达抑制骨肉瘤细胞侵袭与迁移能力Figure5 Depletion of Skp2 inhibited migration and invasion of OS cells
Skp2在多种肿瘤中都有高表达,如淋巴瘤、前列腺癌、胰腺癌、乳腺癌、鼻咽癌、胃癌等[7]。国内外大量研究发现,Skp2在多种人类肿瘤发生中主要发挥癌基因作用,Inuzuka等发现Skp2通过泛素化破坏E-钙黏素而增强细胞迁移[8]。Skp2蛋白促进泛素介导的Foxo1水解,在肿瘤发生中发挥关键作用[9]。而通过敲除小鼠肿瘤细胞中Skp2的表达则可逆转由p19 Arf或PTEN蛋白损失引起的肿瘤[10-11]。条件性敲除小鼠Skp2的下调可抑制T细胞谱系和B细胞谱系的淋巴瘤,还可以抑制骨髓、肝脏、乳腺和前列腺中肿瘤的生长[12-14]。鼻咽癌中Skp2高表达与预后不良相关,并且失活Skp2蛋白可通过p21cip/WAF和p27kip促进鼻咽癌细胞衰老[15]。抑制Skp2的表达有助于抑制肿瘤细胞的生长等癌细胞特性[16-17],但Skp2在骨肉瘤细胞中的作用仍相对模糊。有报道表明骨肉瘤U2OS细胞中Skp2与Cks1紊乱可导致FoxM1表达下调,从而抑制骨肉瘤U2OS细胞生长,进一步导致细胞生长周期阻滞与p21、p27表达水平增加[18]。同时,FoxM1可调节SCF/SKP2-CKS1泛素链接酶复合物等调节细胞周期基因的转录。此外,GLI2是Hedgehog信号通路中的一个关键驱动因子,通过siRNA敲低该分子可以抑制骨肉瘤细胞生长,并伴随细胞周期负调节分子p21的增加及细胞周期促进分子cyclin D1、Skp2和磷酸化Rb的减少而将细胞阻滞在G1期。相反,过表达GLI2则可通过上调骨肉瘤细胞中Skp2的表达,而促进细胞增殖、加速细胞周期进程。裸鼠移植瘤模型结果表明,敲低GLI2抑制了骨肉瘤在体内的生长[19]。使用环巴胺(Cyclopamine)特异性的抑制Hedgehog信号途径中另一关键分子Smoothened(SMO),可减缓骨肉瘤细胞生长,上调p21,下调cyclin D1、Skp2等细胞周期促进分子[20],并且使用SMO shRNA持续沉默SMO的表达,可抑制骨肉瘤细胞在体内和体外的生长[20]。当用γ-分泌酶抑制剂及阻断Notch信号通路后,由于cyclin D1、Skp2等细胞周期促进分子表达降低,从而抑制了骨肉瘤细胞体外及体内生长[21]。这些研究表明Skp2在调节骨肉瘤细胞生长中起关键作用。
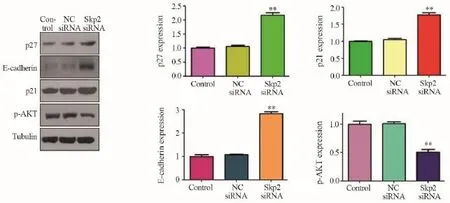
图6 沉默Skp2可升高p21、p27、E-cadherin的表达及降低p-Akt的表达Figure6 Depletion of Skp2 increased expression of p27, p27, E-cadherin while decreased p-Akt expression
本研究中我们观察到Skp2沉默后抑制了骨肉瘤细胞生长、促进凋亡、诱导周期阻滞,并抑制细胞侵袭和迁移能力。Skp2需要通过靶向其底物如p27、p21、p57与FOXO1等来体现其致癌功能,本研究还检测到Skp2沉默后显著上调了p21、p27和E-cadherin的表达。相关研究表明,Akt可直接结合Skp2,促进Skp2由细胞核向细胞质迁移,进而激活Skp2功能[22],并且研究发现Skp2可刺激人乳腺癌细胞中Akt活化[23]。本研究中,沉默Skp2降低了骨肉瘤细胞中活性形式分子p-Akt的表达,进一步地深入研究将有助于确定Skp2对骨肉瘤细胞中Akt活化的调节作用。本研究直接证实了Skp2在骨肉瘤细胞中的生物学功能,因此,失活Skp2基因将成为潜在的治疗骨肉瘤患者的有效方法。
