绿原酸对人胶质瘤细胞U251的抗肿瘤活性及其促凋亡机制
2019-06-04周佳彬陈俊刘臣靳峰
周佳彬,陈俊,刘臣,靳峰
0 引言
恶性原发性脑肿瘤是现今最难治的肿瘤类型之一,其5年生存率不到35%[1],而脑胶质瘤是原发性脑肿瘤最常见的肿瘤类型,约占40%以上,具有高侵袭性、高复发性、高死亡率和预后差的特点[2],恶性胶质瘤的中位生存期仅15~23月,5年生存率不足6%[3]。尽管目前显微神经外科手术技术已经得到广泛普及,手术联合放化疗的综合治疗方式以及基因治疗、免疫治疗等多种治疗手段得到广泛应用,但临床上胶质瘤的预后仍较差。
绿原酸(Chlorogenic acid, CGA),又称咖啡鞣酸,其分子式为C16H18O9,是一种广泛存在于金银花、杜仲等天然植物中的多酚类物质,具有抗炎、抗氧化、抗肿瘤、保肝、调节免疫等多种生物学活性[4]。随着萃取、提纯技术的发展和研究的深入,绿原酸的抗肿瘤作用越来越受到重视。多项研究表明,绿原酸对肺癌[5]、肝癌[6]、鼻咽癌[7]以及结肠癌[8]等多种肿瘤都具有良好的防治效果。然而,目前国内外关于绿原酸诱导胶质瘤细胞凋亡及其相关机制的研究鲜有报道。本研究以胶质瘤细胞系U251为研究对象,探讨绿原酸诱导U251细胞凋亡的作用及其分子机制,为胶质瘤治疗的新药开发提供理论依据和新思路。
1 材料与方法
1.1 材料
1.1.1 细胞 人源胶质瘤细胞U251、人源肝细胞系LO2、小鼠源小胶质细胞BV2均购自中国典型培养物保藏中心。
1.1.2 试剂 绿原酸(Aladdin,上海,CAS号:327-97-9,纯度>98%),DMSO(Sigma,美国),DMEM/F12培养基、PBS缓冲液(Hyclone,美国),胎牛血清(四季青,杭州);胰蛋白酶(吉诺,杭州);青、链霉素(Solarbio,北京);RNAiso plus、SYBR Premix Ex Taq Ⅱ、ROX Reference Dye(TaKaRa,日本);CCK-8试剂盒(同仁,日本);Annexin V-FITC/PI细胞凋亡检测试剂盒(BD,美国);Hoechst 33342染色液(碧云天,上海);p53、Bax、Bcl-2、Caspase-3抗体、HRP标记山羊抗兔IgG(ABclonal,武汉),Livin、GAPDH抗体(CST,美国);ECL化学发光试剂盒(碧云天,上海);PCR引物合成(擎科,武汉)。
1.1.3 仪器 CO2恒温细胞培养箱(Thermo Scientific,美国);Step one荧光定量PCR仪(ABI,美国);倒置相差显微镜(Oplympus,日本);流式细胞仪(BD,美国)。
1.2 方法
1.2.1 细胞培养 人胶质瘤细胞U251细胞用含10%胎牛血清、100 u/ml青霉素和100 μg/ml链霉素的DMEM/F12培养基, 于37℃、5%CO2恒温培养中培养。细胞生长达到对数生长期(70%~80%)后,用0.25%胰酶消化贴壁细胞,按照1:2~1:3的比例传代培养。
1.2.2 CCK-8法检测细胞毒性和细胞增殖 将处于对数生长期的U251细胞消化后,用无血清培养基重悬计数,调整细胞密度以5 000个/孔的密度接种于96孔板中,37℃过夜培养。次日吸弃培养基后,加入含有不同浓度绿原酸(20、40、80、160 μg/ml)的培养基0.1 ml,每组设置5个复孔,对照组加入0.1% DMSO培养基0.1 ml,另设空白组(不含细胞只加培养基)。分别培养24、48和72 h后,每孔加入10 ml CCK-8试剂,于37℃培养箱避光孵育2 h,酶标仪上检测45 nm波长处吸光度值(A值),计算细胞存活率。另外,不同浓度绿原酸干预LO2和BV2细胞48 h后,CCK-8检测细胞毒性,具体方法同上。细胞存活率(%)=(A药物组-A空白组)/(A对照组-A空白组)×100%。改良寇氏法(公式为lgIC50=Xm-I [P-(3-Pm-Pn)/4],Xm为lg最大剂量,P为阳性反应率之和,Pm为最大阳性反应率,Pn为最小阳性反应率)计算不同时间绿原酸作用的IC50。重复3次独立实验,方法同上。
1.2.3 倒置相差显微镜观察细胞形态学变化 选择处于对数生长期的U251细胞消化后,以(3~5)×105个/孔接种至6孔板,每孔加入2 ml培养基培养,细胞贴壁后,0、20、40、80、160 μg/ml绿原酸分别干预细胞48 h后,倒置相差显微镜下观察细胞形态学变化。
1.2.4 Annexin V-FITC/PI染色检测细胞凋亡 收集对数生长期的U251细胞,以5×105个/孔的密度接种于6孔板,37℃、5%CO2培养箱过夜。次日吸弃培养基,加入含有不同浓度绿原酸(20、40、80、160 μg/ml)的培养基2 ml,对照组加入含0.1%DMSO的培养基,处理48 h后,收集细胞和培养上清液,按照Annexin V-FITC/PI凋亡检测试剂盒说明书操作,流式细胞仪检测细胞凋亡,重复3次独立实验。
1.2.5 Hoechst 33342染色检测细胞凋亡 收集对数生长期的U251细胞,以2×105个/孔的密度接种于6孔板,细胞贴壁后吸弃培养基,加入含有不同浓度绿原酸(20、40、80、160 μg/ml)的培养基2 ml,对照组加入含0.1%DMSO的培养基,处理48 h后弃上清液,PBS洗3次后加入Hoechst 33342染色液,染色15 min后弃上清液,PBS洗3次,荧光显微镜观察细胞凋亡情况。
1.2.6 RT-PCR检测p53、Livin、Bax和Bcl-2 mRNA表达水平 收集对数生长期U251细胞,以1×106个/孔接种于6孔板过夜培养,次日加入含有不同浓度绿原酸(0、20、40、80、160 μg/ml)的培养基2 ml,处理48 h后,每孔加入0.5 ml RNAiso plus提取总RNA,分光光度仪检测RNA的浓度与质量,OD260/OD280在1.8~2.0左右的RNA进行反转录成cDNA,-20℃保存备用。采用RT-PCR试剂盒按照说明书操作,检测基因mRNA的表达水平。RT-PCR引物序列,见表1。RT-PCR 10 μl反应体系包括:4 μl体系(0.2 μl上游引物、0.2 μl下游引物、0.2 μl Rox、3.4 ml DEPC水)加6 μl体系(0.1 μl cDNA模板、0.2 μl Mix、0.7 μl DEPC水、5 μl TB Green)。两步法PCR扩增条件:保温阶段:95℃ 30 s;循环阶段:95℃ 5 s,60℃ 30 s,共40个循环。
1.2.7 Western blot检测p53、Livin、Bax、Bcl-2和Caspase-3的表达 不同浓度绿原酸(0、20、40、80、160 μg/ml)干预U251细胞48 h后,加RIPA提取细胞总蛋白,BCA试剂盒检测蛋白样本浓度。取50 μg总蛋白裂解上清液,进行SDS-PAGE凝胶电泳、切胶、转膜、封闭后,加入一抗,4℃过夜孵育,TBST洗膜3次,每次10 min,加入二抗孵育1 h,TBST洗膜3次,每次10 min,条带浸于超敏ECL化学发光反应液(A液:B液=1:1)中3 min,室温下置于化学发光成像仪上曝光,以GAPDH作为内参。1.3 统计学方法

表1 RT-PCR引物列表Table1 List of Real-time PCR primer
采用SPSS25.0统计软件进行分析,所得数据以(x±s)表示,组间两两比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 倒置相差显微镜下观察U251细胞形态学变化
对照组U251细胞贴壁生长,胞体饱满,大小均一,细胞间接触紧密,有突出向周围伸展。80 μg/ml CGA浓度组U251细胞生长状态差,部分细胞变圆,大小不一,细胞间接触明显变少,胞体皱缩明显,突触萎缩,且悬浮细胞碎片较多,见图1。
2.2 绿原酸对LO2和BV2细胞的细胞毒性

图1 80μg/ml绿原酸干预U251细胞48h后光学显微镜下细胞形态学变化Figure1 Morphology changes of U251 cells intervened with 80 μg/ml chlorogenic acid (CGA) for 48h observed under light microscope
不同浓度绿原酸(0、20、40、80、160 μg/ml)干预LO2和BV2细胞48 h后,细胞存活率无明显变化(均P>0.05),见图2。
2.3 绿原酸对U251细胞增殖的抑制作用
不同浓度绿原酸(0、20、40、80、160 μg/ml)干预U251细胞24、48和72 h后,U251细胞存活率随药物作用浓度的升高及作用时间的延长而明显降低(24 h: t20=2.3457, P<0.05, t40=6.7037, P<0.01,t80=15.0227, P<0.01, t160=22.9172, P<0.01; 48 h:t20=7.1296, P<0.01, t40=16.7032, P<0.01, t80=28.7043,P<0.01, t160=26.7849, P<0.01; 72 h: t20=14.3316,P<0.01,t40=26.8094, P<0.01, t80=32.5768, P<0.01,t160=48.2500, P<0.01),且绿原酸对胶质瘤U251细胞增殖的抑制作用表现为浓度依赖性和时间依赖性,见表2。改良寇氏法测得24、48和72 h的IC50分别为41.67、32.97和26.94 μg/ml。
2.4 不同浓度绿原酸促进U251细胞凋亡
随着绿原酸作用浓度的升高,与对照组(Control)相比,U251细胞的早期凋亡比例、晚期凋亡比例和总凋亡率逐渐增加(Q2: t40=16.1942, P<0.01,t80=15.8495, P<0.01, t160=36.1062, P<0.01;Q3:t40=1.2948, P>0.05, t80=61.6755, P<0.01, t160=40.5892,P<0.01; Q4: t40=87.8441, P<0.01, t80=52.4510, P<0.01,t160=64.4245, P<0.01;Q2+Q3: t40=8.6292, P<0.01,t80=31.9058, P<0.01, t160=60.8099, P<0.01),见表3、图3。Hoechst 33342染色表明:随绿原酸浓度的增加,U251细胞凋亡明显增多。Control组细胞核呈规则的圆形,淡蓝色着色均匀;药物组细胞核固缩、碎裂,形状不一,染色质着色明亮,有典型的凋亡小体,见图4。
2.5 绿原酸在mRNA水平上调p53和Bax的表达,下调Livin和Bcl-2的表达
不同浓度(40、80、160 μg/ml)CGA干预U251细胞48 h后,RT-PCR结果表明,与Control组相比,随着CGA浓度的增加,Livin和Bcl-2表达下调,p53和Bax表达上调,(Livin: t40=2.7998,P>0.05, t80=5.6715, P<0.01, t160=7.8133, P<0.01; p53:t40=0.1232, P>0.05, t80=3.5666, P<0.05, t160=17.7536,P<0.01; Bax: t40=2.8826, P<0.05, t80=6.7625, P<0.01,t160=13.7818, P<0.01; Bcl-2: t40=3.4279, P<0.05,t80=24.3339, P<0.01, t160=12.8588, P<0.01),见图5。2.6 绿原酸在蛋白水平上调p53、Bax和Caspase-3的表达,下调Livin和Bcl-2的表达
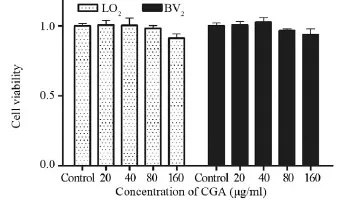
图2 不同浓度CGA干预LO2、BV2细胞48h的细胞毒性Figure2 Cytotoxicity of LO2 and BV2 cells intervened with different concentration of CGA for 48h
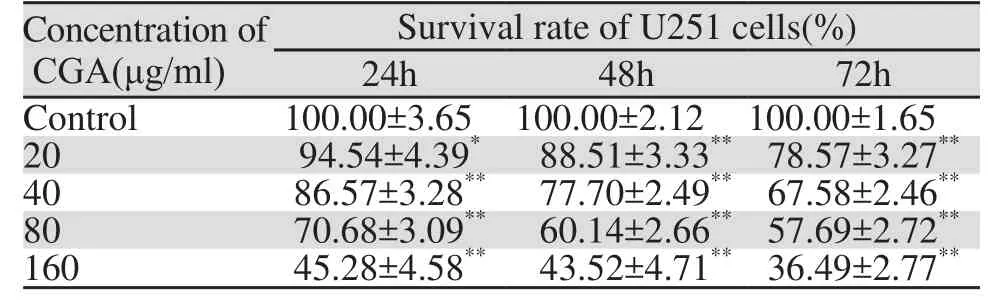
表2 不同浓度CGA作用不同时间对U251细胞增殖的影响 (n=5)Table2 Effects of different concentration of CGA on proliferation of U251 cells (n=5)
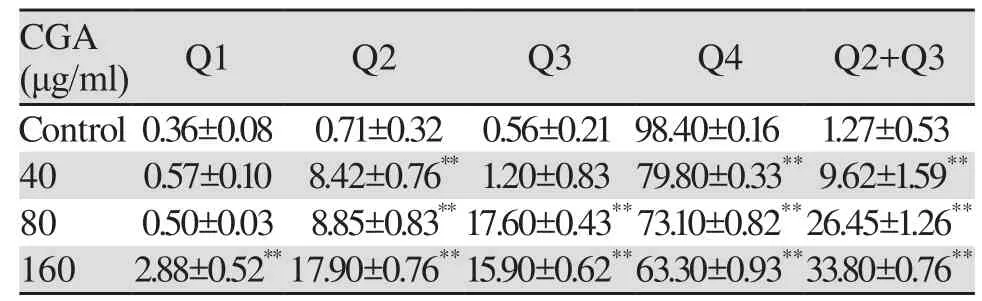
表3 不同浓度CGA干预U251细胞48h后的凋亡率Table3 Apoptosis of U251 cells treated with different concentration of CGA for 48h
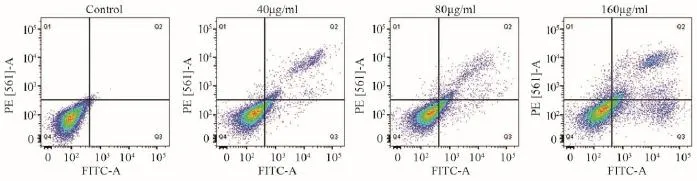
图3 流式细胞术检测CGA干预U251细胞48h后的细胞凋亡Figure3 Apoptosis of U251 cells intervened with CGA for 48h detected by flow cytometry

40、80、160 μg/ml CGA干预U251细胞48 h后,与Control组相比,随着CGA浓度的增加,Livin和Bcl-2表达下调(Livin: t40=6.4160, P<0.01,t80=11.3185, P<0.01,t160=23.0744, P<0.01;Bcl-2:t40=5.9407, P<0.01,t80=7.7944, P<0.01,t160=12.2478,P<0.01);p53和Bax表达明显上调(p53: t40=8.2217,P<0.01, t80=11.2683, P<0.01, t160=17.7536, P<0.01; Bax:t40=3.3779, P<0.05, t80=9.0943, P<0.01, t160=24.5234,P<0.01),并且表达水平呈浓度依赖性。80、160 μg/ml CGA干预后Caspase-3的表达明显增加(Caspase-3: t40=1.3042, P>0.05, t80=4.7828, P<0.01,t160=8.5720, P<0.01),见图 6。
3 讨论

图5 CGA干预U251细胞48h后相关基因mRNA表达水平的改变Figure5 Related genes mRNA expression in U251 cells treated with CGA for 48h

图6 CGA干预U251细胞48h后相关基因蛋白表达水平的改变Figure6 Related genes protein expression in U251 cells treated with CGA for 48h
近年来,中草药因在抗炎、抗氧化、抗肿瘤等方面具有较好的疗效成为医学研究的热点之一。传统中草药在肿瘤治疗上具有一定的优势,但由于技术限制等原因,传统中草药有效成分尚不明确,导致其抗肿瘤的治疗应用受限。
随着萃取技术的发展,目前已经证实很多中草药有效提取成分有显著的抗胶质瘤作用。刘海鹏等[9]发现,灵芝酸A能够诱导U251细胞凋亡,抑制其增殖和侵袭能力,并能抑制KDR mRNA和蛋白的表达。黄鎏等[10]发现,牛蒡子苷元能够抑制人胶质瘤U251细胞的增殖并促进细胞凋亡,其作用机制与调控Bcl-2、Bax的表达水平有关。郭培中等[11]研究表明,白藜芦醇诱导U251细胞增殖抑制和凋亡与抑制Wnt/β-catenin/p53信号通路激活相关。周广洲等[12]研究发现,柯里拉京能够有效促进U251细胞凋亡,抑制U251细胞迁移,其具体机制尚不明确。
绿原酸是一种天然提取物,对多种恶性肿瘤都具有抗肿瘤作用。本研究发现绿原酸对U251细胞的增殖有显著抑制作用,而且表现为浓度和时间依赖性,这种抑制作用很可能是通过诱导细胞凋亡来实现的。
细胞凋亡是一种由基因调控、细胞内自主激活死亡程序的死亡方式。细胞凋亡的途径主要有死亡受体介导的凋亡途径[13](外源性凋亡途径)、线粒体凋亡途径[14](内源性凋亡途径)和内质网应激介导的凋亡[15],参与细胞凋亡的蛋白家族主要有4种:胱天蛋白酶Caspases家族、衔接蛋白家族、Bcl-2家族和凋亡抑制蛋白IAPs家族。各种途径的细胞凋亡最终多是以活化Caspases蛋白从而引发后续相关蛋白降解的级联反应发生的,在这个过程中,Caspase-3的活化起核心作用[16],是细胞凋亡发生的关键蛋白。Bcl-2蛋白家族成员通常分为两类:抗凋亡蛋白分子(Bcl-2、Bcl-xL、Mcl-1等)和促凋亡蛋白分子(Bax、Bad、Bak、Bid等),其中Bcl-2作为重要的调控细胞凋亡的负向分子,能够与促凋亡蛋白结合导致凋亡失调,促使细胞逃避凋亡[17]。重要的促凋亡蛋白Bax的激活与线粒体凋亡密切相关,活化的Bax导致线粒体通透性转运孔开放,线粒体通透性增加引起细胞色素C(Cyt C)释放,最终引起细胞凋亡。本研究证实了绿原酸是通过上调Bax表达、下调Bcl-2表达,最终激活Caspase-3蛋白促进胶质瘤U251细胞凋亡。
作为重要的抑癌基因,p53在调控细胞凋亡和细胞周期、介导DNA损伤修复及调节细胞自噬等多种生物学过程中有着广泛的作用[18-19]。细胞处于应激状态时,p53能够直接或间接激活内源性细胞凋亡途径中Bax的表达、抑制Bcl-2的表达,反式激活内质网凋亡途径中Scotin、CDIP的表达,诱导细胞凋亡[20]。p53也能促进死亡受体超家族成员Fas-L、TRAIL等与相应配体结合形成死亡诱导信号复合体(deathinducing signaling complex, DISC),激活外源性细胞凋亡途径[21],进而激活Caspase-8促进细胞凋亡。此外,p53还能够直接激活Caspase-6诱导细胞凋亡。根据本研究结果,我们推断绿原酸处理后的U251细胞凋亡与p53的表达明显上调有关(P<0.05)。
Livin(ML-IAP、KIAP、BIRC7)是2000年发现的IAPs成员之一,它的抗凋亡作用是通过直接抑制Caspases实现的,目前研究发现,Livin的BIR结构区对Caspase-3具有强大的抑制作用,并且还能够直接抑制Caspase-7,9活性而抑制细胞凋亡[22]。本研究结果提示,绿原酸诱导的U251细胞凋亡可能与Livin的表达下调有关(P<0.05)。
绿原酸在抗胶质瘤治疗中具有良好的应用前景,不仅可以诱导细胞凋亡,还能通过其他方面发挥抗肿瘤作用:(1)调节肿瘤微环境免疫功能:绿原酸能够通过活化STAT1增加M1型巨噬细胞的比例,抑制STAT6减少M2型巨噬细胞的比例,抑制胶质瘤细胞的生长[23];(2)抑制肿瘤新生血管生成:绿原酸能够抑制血管内皮生长因子表达,进而下调AKT和HIF-1的表达,抑制血管生成;(3)调节细胞代谢:绿原酸能够通过抑制葡萄糖-6-磷酸脱氢酶的活性干扰细胞糖酵解途径[24],进而抑制肿瘤生长。此外,由于绿原酸具有较好的保肝作用[25],与抗肿瘤化疗药联合应用,不仅能够减少化疗药物的肝毒性,还可能发挥协同抗肿瘤作用。
综上所述,绿原酸诱导U251细胞凋亡的分子机制可能是通过上调p53和Bax的表达、下调Livin和Bcl-2表达,增强Caspase-3蛋白活性,从而诱导细胞凋亡。本实验为绿原酸诱导胶质瘤细胞凋亡的机制研究提供了初步的理论指导,为绿原酸的开发和临床应用提供了重要的依据,发现绿原酸抗胶质瘤作用的靶点和探索绿原酸在体内抗胶质瘤活性也将是下一步的研究重点。
