种植时间对西藏地区青贮玉米发酵品质和微生物多样性的影响
2019-05-31商振达谭占坤李家奎王宏辉谢国平刘锁珠
商振达,谭占坤,李家奎,卓 嘎,王宏辉,谢国平,刘锁珠*
(1. 西藏农牧学院动物科学学院,西藏 林芝860000; 2. 西藏高原饲料加工工程研究中心,西藏 林芝 860000;3. 华中农业大学动物医学院,湖北 武汉 430070)
西藏地区位于中国青藏高原西南部,畜牧业是其农业经济的主导产业,具有不可替代的社会、经济作用[1]。但由于西藏高海拔、高寒的恶劣自然环境,导致草地生产能力极低,牧草生长期短,优质饲料资源严重缺乏,难以为家畜提供充足的饲草资源,当前饲料的短缺已成为制约西藏畜牧业发展的重要问题[2]。因此,开发扩大饲料来源,是解决西藏地区家畜饲粮短缺的有效措施。
青饲玉米作为一种优质的饲料作物,具有再生能力强、生长速度快、营养价值高、适口性好等优点[3-4],近年来在西藏拉萨、林芝、山南、昌都等地广泛种植。青贮作为一种青饲料的贮存技术或方法,具有减少饲草养分损失,有利于动物消化吸收,增高饲草的利用价值、扩大饲料来源、调整饲草供应时期等作用。青贮是一个非常复杂的生化物质转化和微生物活动的过程,青贮过程中饲草的营养成分和微生物菌群的变化都会对青贮饲料的发酵品质产生很多影响。因此,深入了解玉米的营养成分和青贮过程中微生物菌群结构的变化情况,可以更好的分析影响青贮玉米发酵品质的因素,进而提高玉米青贮的成功率[5-8]。
大量的研究表明,青饲料的不同种植季节和收割时间会影响其营养成分[9-10]。近年来,随着高通量测序技术的不断发展,该技术在微生物研究领域已被广泛使用,高通量测序技术能够更深入、直观、准确地检测到青贮饲料微生物群落的多样性,可以测定微生物从门、纲、目、科、属各个水平上的构成及丰度[11-14]。因此,本研究对西藏林芝地区不同种植时间玉米的营养成分和青贮玉米的发酵品质进行测定分析,并利用高通量技术检测不同种植时间对玉米青贮后微生物菌群结构的影响,为提高西藏地区青贮玉米的发酵品质提供理论依据。
1 材料与方法
1.1 试验材料
将种植于西藏林芝西藏农牧学院实习牧场试验地完熟期的春玉米和夏玉米于2017年10月15日刈割。其中,春玉米种植时间为2017年3月20日,夏玉米种植时间为2017年6月10日。全株春玉米和全株夏玉米的化学成分见表1。
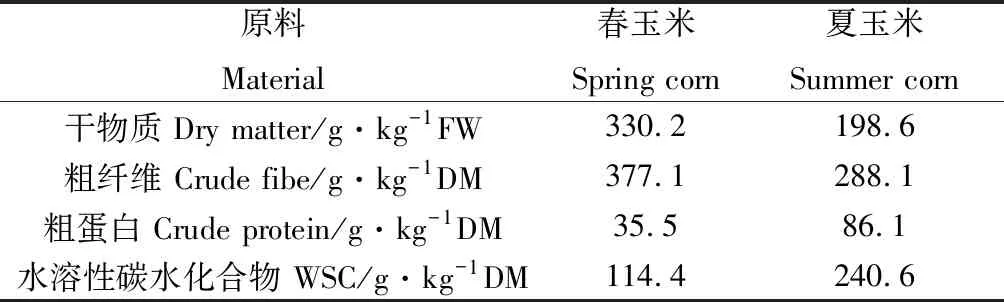
表1 青贮材料营养成分Table 1 The nutritional ingredients of silage materials
1.2 试验设计
试验采用完全随机设计,设置8个处理,分别为全株春玉米青贮组(分别为A1青贮7天、B1青贮14天、C1青贮30天、D1青贮60天)、全株夏玉米青贮组(分别为A2青贮7天、B2青贮14天、C2青贮30天、D2青贮60天),每组青贮结束后打开小型实验用青贮窖取样进行分析,每个处理取3袋作为3个重复,共24袋。
1.3 试验方法
1.3.1青贮饲料的制作 将全株春玉米和夏玉米均切成1~3 cm后称取55 g,快速装填并压实于110 ml的小型实验用青贮窖中密封后,置于室温条件下保存,分别在青贮第7,14,30和60 d后打开,取样进行分析。
1.3.2样品预处理 青贮窖打开后,取出全部青贮饲料将其混匀,称35 g放入100 m1的广口三角瓶,加入105 g的去离子水(青贮饲料:水=1:3),在4℃的冰箱内浸提24小时。然后对青贮饲料进行榨汁和过滤,将上清液用过滤漏斗通过二层沙布和滤纸过滤,保存滤液(—20℃冷冻箱保存)待测。滤液用来测定pH值、乳酸、氨态氮和挥发性脂肪酸。将剩余的部分青贮饲料收集起来烘干,称重粉碎,测定干物质、总氮、粗蛋白以及水溶性碳水化合物含量。部分剩余的,未烘干青贮饲料装入无菌的50 ml冻存试管中,保存于—20℃冰箱中,用于测定青贮饲料中微生物菌群的多样性。
1.4 试验方法
1.4.1青贮饲料发酵营养成分测定 干物质(Dry matter,DM)采用将青贮饲料放置于105℃的烘箱中烘2 h,然后将烘箱调至65℃的恒温继续烘60 h直至恒重的方法测定[15];用HANNA pH211精密pH计(意大利HANNA公司)对青贮样品处理后的过滤液直接测定pH;使用日立高效液相色谱仪测定青贮饲料中挥发性脂肪酸(Volatile fatty acids,VFAs)含量;采用苯酚-次氯酸钠比色法[16]和硫酸-蒽酮比色法[17]分别测定氨态氮(Ammonia nitrogen,AN)和水溶性碳水化合物(Water soluble carbohydrate,WSC)含量;总氮(Total nitrogen)通过凯氏定氮法测定[18]。
1.4.2青贮饲料微生物多样性的测定 将以每个青贮组中的3个重复样品均匀的混合在一起。使用试剂盒提取青贮饲料中的微生物组总DNA,利用前引物和后引物获得细菌16S rRNA基因V3-V4高变异区。扩增产物回收纯化,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。使用MiSeq测序仪进行2×300 bp的双端测序并对结果进行分析。Illumina HiSeq测序及结果分析均由上海派森诺生物科技股份有限公司协助完成。
1.5 数据处理
使用QIIME软件,调用UCLUST这一序列比对工具[19],对前述获得的序列按97%的序列相似度进行归并和OTU(Operational Taxonomic Unit)[20]划分,将OTU序列与Greengenes数据库[21]的模板序列相比对,获取每个OTU所对应的分类学信息。通过不同生物信息学算法计算Alpha多样性,使用QIIME软件进行各分类水平的分类学组成分析,并用R软件(R package)将数据绘制成柱状图,通过主成分分析(Principal component analysis,PCA)方法,对群落数据结构进行自然分解,从而观测样本之间的差异[22]。通过IBM SPSS Statistics软件对试验数据进行单因素方差分析。
2 结果与分析
2.1 西藏地区春玉米与夏玉米青贮发酵品质及营养成分变化
整个青贮过程中,春玉米青贮组中干物质含量和pH值始终显著(P<0.05)高于夏玉米青贮组,而夏玉米青贮组中乳酸和乙酸含量始终显著(P<0.05)高于春玉米青贮组。随着青贮天数的逐渐增加,春玉米与夏玉米青贮组中,干物质含量都显著下降(P<0.05)或下降(P>0.05),青贮第7 d干物质含量最高,分别为311.63 g·kg-1和182.61 g·kg-1;pH值都有先下降后上升的趋势,青贮第30 d时pH值最低,分别为4.15和3.77;相应的,乳酸含量都呈现先上升后下降的趋势,青贮第30 d时乳酸含量最高,分别为37.61 g·kg-1和70.30 g·kg-1。乙酸含量都呈现先上升后下降的趋势,春玉米青贮组在青贮第30 d时,乙酸含量最高(16.33 g·kg-1),而夏玉米青贮组在青贮第14 d时,乙酸含量最高(34.83 g·kg-1)。整个青贮过程中,各青贮组中丁酸含量均低于10 g·kg-1,且同一青贮时间下,夏玉米组中丁酸含量均低于春玉米组(表2)。
如表3所示,春玉米青贮组中氨态氮/总氮的值均显著高于(P<0.05)或高于(P>0.05)夏玉米青贮组,而各春玉米青贮组中水溶性碳水化物含量均显著低于(P<0.05)或低于(P>0.05)各夏玉米青贮组。随着青贮天数的逐渐增加,各青贮试验组中氨态氮/总氮的值逐渐升高,在青贮第7 d时,青贮组中氨态氮/总氮的值最低,分别为45.15 g·kg-1和35.80 g·kg-1,而青贮第60 d时,青贮组中氨态氮/总氮的值最高,分别为55.36 g·kg-1和54.92 g·kg-1,但都低于100 g·kg-1,且同一青贮天数下,各夏玉米青贮组中氨态氮/总氮的值均低于春玉米青贮组;各青贮试验组中水溶性碳水化合物含量逐渐下降,在青贮第7 d时,青贮组中水溶性碳水化合物含量最高,分别为38.73 g·kg-1和53.58 g·kg-1,而青贮第60 d时,青贮组中水溶性碳水化合物含量最低,分别为21.51 g·kg-1和25.46 g·kg-1,且同一青贮天数下,各夏玉米青贮组中水溶性碳水化合物含量均高于春玉米青贮组。
2.2 西藏地区春玉米与夏玉米青贮发酵微生物多样性(细菌)研究
2.2.1测序结果及Alpha多样性分析 本研究利用高通量测序技术对8个实验组,共8份青贮饲料样品的菌群V3-V4区进行测序,共计获得有效序列288 470条,样品平均有效序列为36 058条。按照97%的相似度对OTUs进行精简,并对获得的OTUs在门、纲、目、科、属、种六个分类水平上进行鉴定,结果如图1所示。
从图2可见,物种观察指数稀释曲线随着测试深度的不断加深逐渐增加,其斜率逐渐减小,趋于平台期,说明样本测序量已经饱和,大多数菌群被覆盖,足够反映样本中绝大部分细菌物种的信息。由各青贮试验组的Alpha多样性指数可知(表4),随着青贮天数的逐渐增加,春玉米青贮组中Chao1和ACE指数[23-24]呈现先上升后下降的趋势,表明春玉米青贮组中微生物群落的丰富度先升高后下降,而在夏玉米青贮中,两种指数呈现先下降后上升的趋势,表明夏玉米青贮组中微生物群落的丰富度先下降后升高。除此之外,Simpson指数[25]和Shannon指数[26]在春玉米和夏玉米青贮组中的变化规律也不一样。综合分析四种Alpha多样性指数可知,青贮原料的营养成分不同,会影响青贮过程中微生物菌群的结构的变化规律。
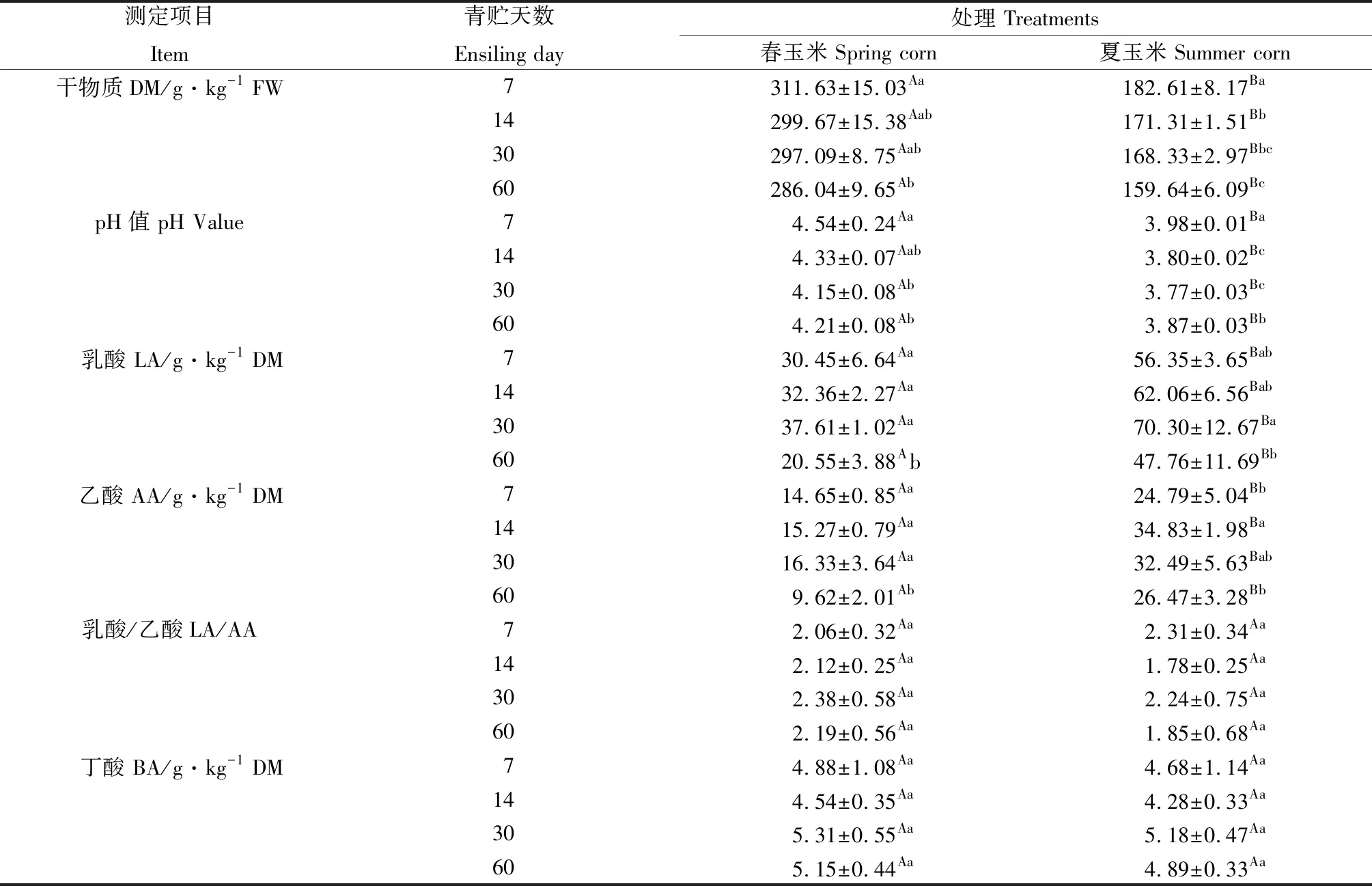
表2 西藏地区春玉米和夏玉米青贮过程中pH值、干物质和挥发性脂肪酸含量的变化Table 2 Changes of pH,DM and Volatile fatty acid contents of spring corn silages and summer corn silages during ensilage in Tibet
注:不同小写字母表示相同处理不同青贮天数间差异显著;不同大写字母表示相同青贮天数不同处理间差异显著(P<0.05)下同。±是指标准差
Note:Values with different lowercase letters indicate significant differences among ensiling days in the same treatment,values with different uppercase letters indicate significant difference among treatments in the same ensiling day at the 0.05 level,the same as below.± is the standard deviation.
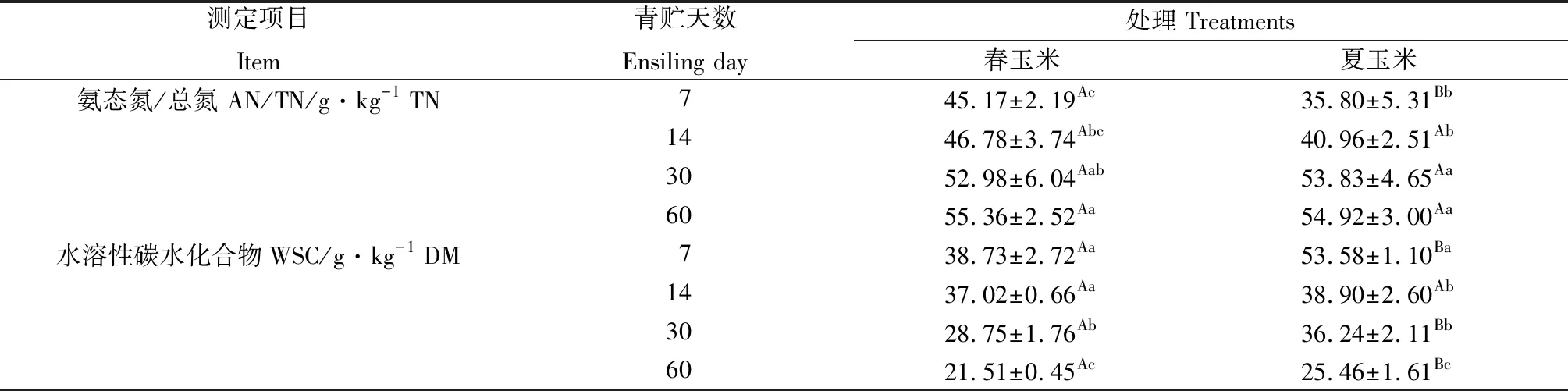
表3 西藏地区春玉米和夏玉米青贮过程中氨态氮/总氮和水溶性碳水化合物含量的变化Table 3 Changes of AT/TN and WSC content of spring corn silages and summer corn silages during ensilage in Tibet
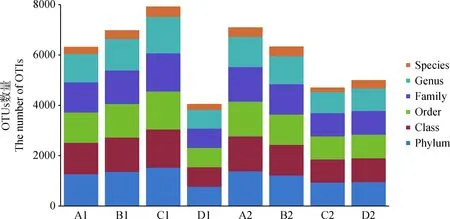
图1 OTU分类地位鉴定图Fig.1 The classification of OTUs in di□erent silage samples
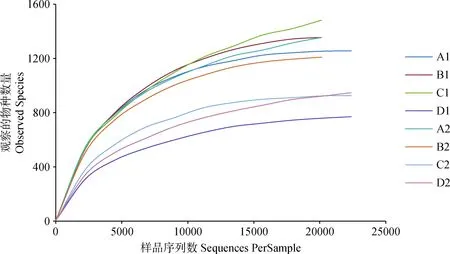
图2 各青贮组稀疏曲线图Fig.2 Rarefaction analysis of experimental group
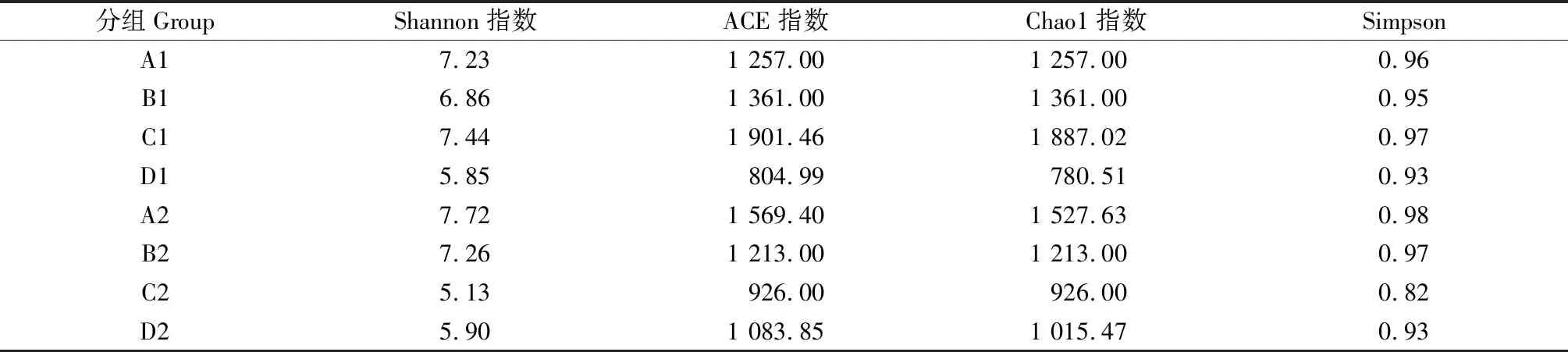
表4 各青贮组中菌群微生物多样性指数Table 4 Diversity index of experimental group
2.2.2各青贮实验组微生物群落主成分分析 基于OTUs水平的主成分分析(PCA)结果见图3,两点之间的距离越近,表明两个样本之间的微生物群落结构相似度越高。由图可知,8个青贮试验组的8个样品能够较明显的区分开,说明不同青贮组中微生物群落的组成差异较明显。其中春玉米青贮组中,随着青贮天数的逐渐增加,各组中微生物菌群组成的差异逐渐增大。夏玉米青贮组中,青贮第7 d和第14 d时,微生物菌群组成几乎相同,而青贮14 d后,随着青贮天数的逐渐增加,各组中微生物菌群组成的差异逐渐增大。同一青贮天数时,夏玉米与春玉米青贮组中微生物菌群组成也存在一定的差异。
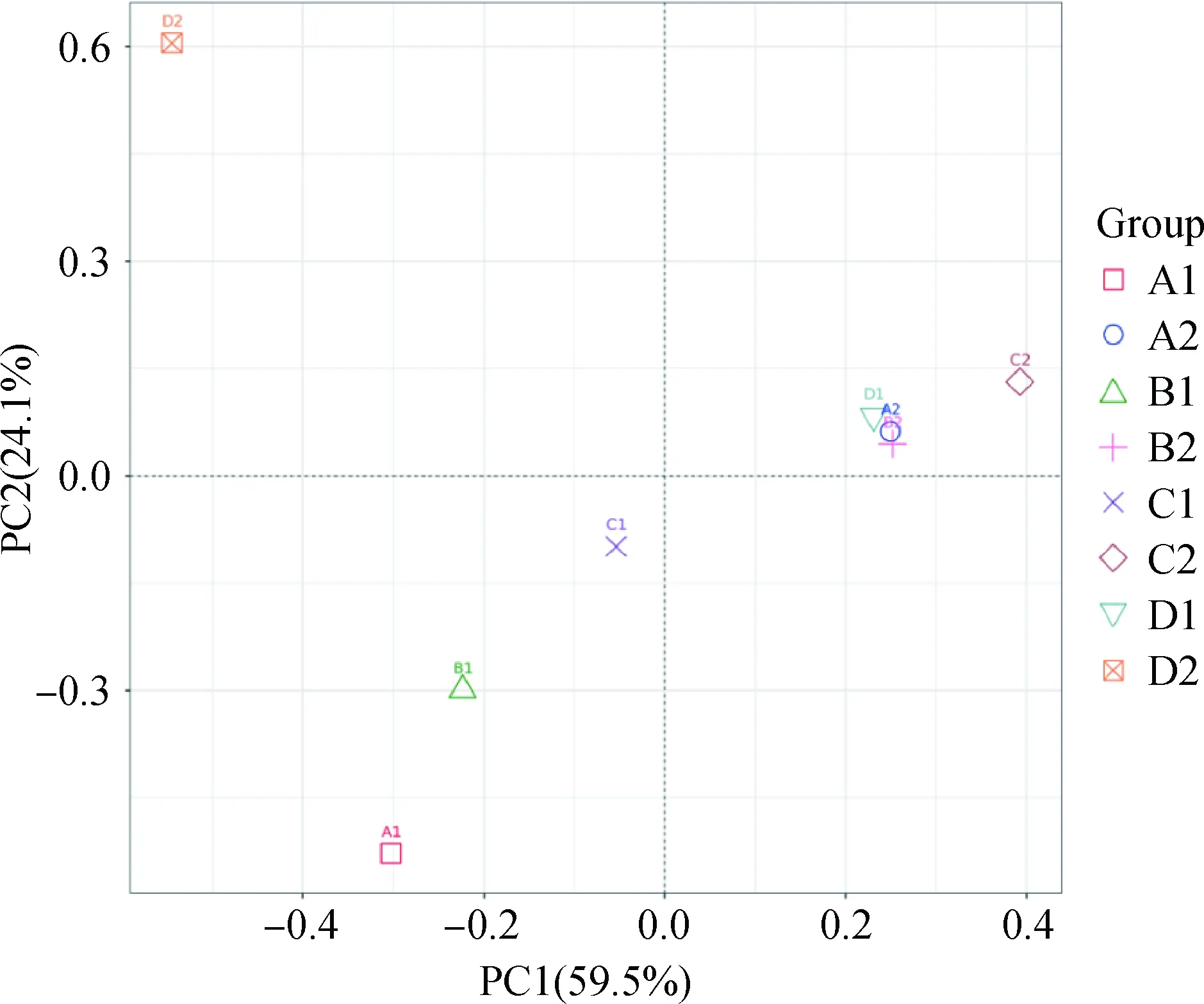
图3 PCA分析的样本三维排序图Fig.3 3D Sorting Chart of PCA Analysis
2.2.3基于门水平的微生物群落结构分析 图4显示了在门水平上春玉米和夏玉米不同青贮天数试验组中微生物菌群结构的变化(丰度>1%),8个样品中共鉴定出21个门,其中丰度大于1%的门有5个,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes),其丰度值依次为50.7%,38.5%,6.1%,2.1%和2.0%,占菌群分类的99.4%以上,0.6%左右的为其他菌门。
比较不同青贮试验组样品可知,青贮前30 d时,春玉米青贮组中变形菌门的丰度均高于夏玉米青贮组,而青贮60 d时,略低于夏玉米青贮组;青贮前30 d时,春玉米青贮组中厚壁菌门的丰度均低于夏玉米青贮组,而青贮60 d时,高于夏玉米青贮组;青贮第7和14 d时,春玉米青贮组中蓝细菌门的丰度高于夏玉米青贮组,而青贮第30和60 d时,低于夏玉米青贮组;整个青贮过程中,春玉米青贮组中拟杆菌门的丰度均低于夏玉米青贮组;春玉米青贮组中放线菌门的丰度只要在青贮第60 d时低于夏玉米青贮组,其他青贮天数时均高于夏玉米青贮组。
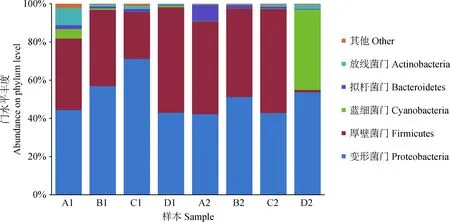
图4 基于门水平上各青贮组中微生物丰度柱状图Fig.4 The histograms of abundances of microbes at phylum level in each silage group
2.2.4基于属水平的微生物群落结构分析 图5显示了在属水平上不同青贮组中微生物菌群结构的变化(丰度>1%),8个样品中共鉴定出402个属。如图所示,丰度大于1%的属有11个,总丰度占到78.1%,分别为假单细胞菌属(Pseudomonas),丰度为29.5%,乳酸杆菌属(Lactobacillus),丰度为24.2%,两种菌属为优势菌属;随后依次为贪铜菌属(Cupriavidus),丰度为4.0%;魏斯氏菌属(Weissella),丰度为3.8%;明串珠菌属(Leuconostoc),丰度为3.3%;鞘氨醇单胞菌属(Sphingomonas),丰度为3.3%;乳球菌属(Lactococcus),丰度为3.2%;泛菌属(Pantoea),丰度为2.4%;沙雷菌属(Serratia),丰度为2.1%;真杆菌属(Eubacterium),丰度为1.1%;志贺氏菌属(Escherichia-Shigella),丰度为1.1%。其他的菌属虽然丰度较低,但也存在一定的数量。
比较不同青贮试验组样品可知,随着青贮的进行,假单细胞菌属在春玉米和夏玉米青贮组中丰度都先升高后下降。春玉米青贮组中乳杆菌属的丰度随青贮天数增加而升高,在夏玉米青贮组中乳酸杆菌属在青贮30 d后,丰度明显下降,且除青贮第60 d外,夏玉米青贮组中乳酸杆菌属丰度都要高春玉米青贮组。除此之外,在春玉米和夏玉米青贮组中均检测到了其他LAB菌种,如魏斯氏菌属、明串珠菌属和乳球菌属,但春玉米青贮组中三种LAB菌种的丰度都要高于夏玉米青贮组;春玉米青贮组中鞘氨醇单胞菌属、泛菌属、沙雷菌属的丰度均高于夏玉米青贮组;各青贮组中均未检测出革兰氏阳性芽孢杆菌属和梭菌属。
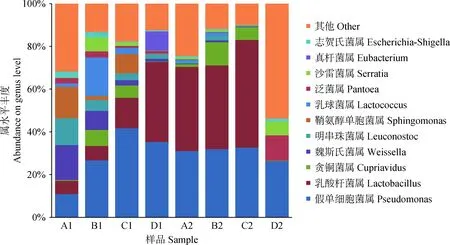
图5 基于属水平上各青贮组中微生物丰度柱状图Fig.5 The histograms of abundances of microbes at genus level in each silage groups
3 讨论
本试验结果显示,春玉米与夏玉米由于种植时间不同,导致其营养成分有明显差异,春玉米中干物质和粗纤维含量高于夏玉米,而夏玉米中水溶性碳水化合物和粗蛋白含量高于春玉米,这与Neylon[27]、Weiss[28]和Johnson[29]对饲用玉米的研究结果相似。从春玉米和夏玉米青贮过程中营养成分变化可见,春玉米青贮组中干物质含量、pH值和氨态氮/总氮的值始终高于夏玉米青贮组,相应的乳酸含量始终低于夏玉米青贮组,这与夏玉米中水溶性碳水化合物含量高,而较高的水溶性碳水化合物,可以为乳酸菌提供更多的发酵底物有效的降低青贮饲料的pH值和氨态氮含量,提高乳酸产量有关[30-32]。随着青贮天数的逐渐增加,春玉米和夏玉米青贮中干物质含量逐渐降低,pH值先下降后上升,相应的乳酸含量先上升后下降,青贮30 d时,pH最低而乳酸含量最高,青贮条件最佳。整个青贮过程中,春玉米青贮组中除青贮30 d外,pH值都没有降至常规成功青贮要求的pH值,而夏玉米青贮组中pH值均降至常规成功青贮要求的pH值[33](4.2以下),说明夏玉米青贮的条件要优于春玉米青贮。
本研究中,整个青贮过程中,乳酸含量的变化规律和乙酸含量的变化规律一致。表明在整个青贮过程中异性乳酸发酵占主导地位。丁酸和氨态氮/总氮是衡量青贮饲料优劣的重要标准,优质青贮饲料中丁酸含量和氨态氮/总氮值应低于10 g·kg-1DM和100 g·kg-1TN[34],本试验中,虽然各组丁酸含量和氨态氮/总氮均低于这一标准,但夏玉米青贮组中丁酸含量和氨态氮/总氮的值均低于春玉米青贮组。随着青贮天数的增加,各青贮组中的氨态氮/总氮值逐渐升高。表明青贮后期较多的蛋白质可能被好氧性微生物降解为氨态氮。
青饲玉米青贮发酵过程中微生物菌群的丰度和结构的变化影响着青贮饲料的发酵品质和营养成分[35-36]。因此本研究基于高通量测序技术对玉米青贮饲料的微生物菌群进行检测,由实验结果得到,样本测序量已经饱和,大多数菌群被覆盖,足够反映样本中绝大部分细菌物种的信息。由四种Alpha多样性指数可知,青贮原料的营养成分不同,会影响青贮过程中微生物菌群的结构的变化规律。且随着青贮天数的逐渐增加,各组中微生物菌群组成的差异逐渐增大。本研究检测到的菌群共分21个门,优势菌门依次为变形菌门、厚壁菌门、蓝细菌门、放线菌门、拟杆菌门,共分402个属,优势菌属为假单细胞菌属和乳酸杆菌属。本研究中,夏玉米青贮组中厚壁菌门和拟杆菌门丰度高于春玉米青贮组,且春玉米青贮组中的变形菌门高于夏玉米青贮组,说明夏玉米青贮组对粗纤维的降解效果[37]和碳水化合物的利用效果[38]均好于春玉米青贮,且其抑制变形菌门的效果较好。
本研究中,假单细胞菌属的丰度在春玉米和夏玉米青贮过程中的变化规律不同,其原因有待进一步研究。在春玉米青贮中乳杆菌属的丰度始终低于假单细胞菌属,说明在春玉米中,乳杆菌属作为一种产乳酸菌,其抑制好氧性的假单细胞菌的效果较差。而在夏玉米青贮中,除青贮60 d外,其他青贮组中乳杆菌属的丰度均高于假单细胞菌属,说明夏玉米中,乳杆菌属抑制好氧性细菌的效果较好[39]。在本研究中,除乳酸杆菌外,还存在其他丰度较低的LAB菌种,如魏斯氏菌属、明串珠菌属、乳球菌属,且夏玉米青贮组中各种LAB菌种(乳酸杆菌属、魏斯氏菌属、明串珠菌属、乳球菌属)的丰度和要高于春玉米青贮组;各青贮组中均未检测到青贮饲料的重要腐败菌(革兰氏阳性芽孢杆菌属和梭菌属)。除此之外,鞘氨醇单胞菌属、泛菌属、沙雷菌属等菌属也存在于青贮玉米中,玉米营养成分不同也会使其丰度出现变化,这几种菌属的功能还有待进一步研究。
4 结论
不同种植时间会影响西藏地区玉米的营养成分,而不同的营养成分会导致青贮玉米发酵品质不同以及微生物菌群结构的变化规律不同。相比春玉米青贮,夏玉米青贮后降低了青贮饲料的pH值,提高了乳酸含量,降低了丁酸含量和氨态氮/总氮的值。除此之外,夏玉米青贮后还提高了厚壁菌门和拟杆菌门的丰度,降低了变形菌门的丰度;提高了LAB菌种的丰度,有效的抑制了腐败菌的生长。因此,夏玉米的青贮效果优于春玉米。
