利用CRISPR/Cas9技术创制大豆高油酸突变系
2019-05-31侯智红董利东芦思佳南海洋甘卓然刘宝辉
侯智红 吴 艳 程 群 董利东 芦思佳 南海洋 甘卓然 刘宝辉
广州大学生命科学学院, 广东广州 510006
大豆(Glycine maxL. Merrill)起源于中国, 是世界上重要的油料和经济作物之一, 也是人类植物油和植物性蛋白的主要来源。随着生活水平的提高以及饮食结构的改善, 人们对优质大豆油的需求日益增长, 培育高品质大豆成为大豆育种的重要目标之一。大豆油约占我国植物食用油消费的 40%, 大豆脂肪酸的组分及其配比决定大豆油脂的品质[1], 其主要由棕榈酸(16:0)、硬脂酸(18:0)、油酸(18:1Δ9)、亚油酸(18:2Δ9,12)和亚麻酸(18:3Δ9,12,15) 5 种脂肪酸组成, 分别约占大豆脂肪酸总量的 10%、4%、18%、55%和13%[2-3]。其中, 硬脂酸、棕榈酸为饱和脂肪酸; 油酸、亚油酸、亚麻酸为不饱和脂肪酸[4]。饱和脂肪酸不容易被人体消化吸收, 易引起肥胖症及脑血管疾病[5]。亚油酸、亚麻酸是多不饱和脂肪酸, 稳定性差, 在高温加工时易氧化, 使营养价值降低,影响油的品质, 在工业上的加氢反应也易产生对人体有害的反式脂肪酸[6]。而油酸作为一种单不饱和脂肪酸, 性质稳定, 抗氧化作用强, 在人体的脂类代谢中能降低有害胆固醇, 保持有益胆固醇, 从而减缓动脉粥样硬化, 有效预防心血管疾病发生的几率[7-8]。因此, 提高油酸的相对含量, 增加油酸/亚油酸的比值, 已成为大豆品质改良育种的重要目标之一。
所有生物的脂肪酸合成途径基本类似, 但是,动物和酵母的脂肪酸合成主要在细胞质中进行, 而植物脂肪酸合成主要发生在质体中和内质网上[9]。在脂肪酸合成途径中, Δ12-脂肪酸脱饱和酶(deltatwelve fatty acid desaturase 2 enzyme, FAD2)是催化油酸转化为亚油酸的关键酶[10]。目前, 拟南芥[11]、棉花[12]、向日葵[13]、大豆[14]等植物中的FAD2基因已经被克隆。大豆中存在 2个FAD2基因, 分别为FAD2-1和FAD2-2, 是2个非等位基因。其中,FAD2-1基因在种子中特异性表达, 是决定种子油酸含量的主要基因[15]。基于稳定性及磷酸化作用不同,FAD2-1基因又分为FAD2-1A和FAD2-1B两种[14]。抑制或过表达FAD2-1A和FAD2-1B基因, 可以显著提高或降低油酸/亚油酸比例[16-18]。Li等[16]研究发现,酵母细胞中不含有亚油酸, 而通过在酵母细胞中过表达GmFAD2-1B基因后, 亚油酸的含量显著提高,说明GmFAD2-1B基因是亚油酸代谢途径中的关键基因。Pham 等[17-18]分别获得FAD2-1A突变体与FAD2-1B突变体, 以及FAD2-1A/FAD2-1B双突变体材料, 并发现无论是单突变还是双突变体中, 大豆的油酸含量均显著提高。Wang等[19]利用RNAi技术,获得干涉FAD2基因转基因植株, 并发现转基因大豆油酸含量高达71.5%~81.9%。Zhang等[20]和Yang等[21]分别通过RNAi技术, 获得油酸含量为51.71%和 27.38%~80.42%的干涉FAD2-1B基因转基因大豆。Haun等[22]利用人工核酶技术定点突变大豆FAD2-1A和FAD2-1B基因, 获得油酸含量高达80%的转基因大豆。因此,FAD2-1A与FAD2-1B在决定大豆种子油酸含量中起着重要作用, 是调控油酸含量的2个主要基因[15]。
CRISPR/Cas9系统是近几年开发的一种准确、便捷、高效率的生物基因组编辑方法。通过向导RNA的介导和Cas9蛋白的切割来实现对靶基因的定点编辑[23]。目前, CRISPR/Cas9系统已经成功应用在拟南芥[24]、玉米[25]、小麦[26]、水稻[27-28]、大豆[29]等植物中。Jacobs等[29]第一次利用 CRISPR/Cas9技术在大豆中实现了定点突变。Cai等[30]利用CRISPR/Cas9技术原理选取3个不同靶位点, 首次应用农杆菌介导的大豆子叶节遗传转化体系, 成功创制出稳定遗传的大豆突变体材料。该技术应用在大豆基因功能研究中起到重要作用, 然而, 应用在大豆育种上的报道较少。本研究利用CRISPR/Cas9技术, 定点编辑了控制油酸含量的关键基因FAD2-1A(Glyma10g42470), 并获得纯合FAD2-1A突变体, 对大豆分子育种和提高大豆品质具有重要意义, 为进一步提高大豆品质奠定了重要的材料基础。
1 材料与方法
1.1 大豆材料、CRISPR/Cas9及gRNA载体
大豆材料华夏3号(简称H3)由华南农业大学和广西壮族自治区农业科学院合作选育, 以桂早 1号为母本, 巴西13号为父本经有性杂交和系谱选育而成。该品种田间抗病性较强, 抗倒性强, 耐旱性好,对酸性低磷土壤有很好的耐性且高产、优质、抗大豆病毒病, 适宜在广东、广西、海南、福建中南部、江西和湖南南部地区夏播种植。
pYLgRNA载体是由pUC18载体为骨架改造而成, 大小约3 kb (图1-A)。pYLCRISPR/Cas9-DB载体大小约15.5 kb, 含有一个35S启动子驱动的Bar基因、35S启动子驱动的Cas9基因、终止子、ccdB大肠杆菌致死基因(图1-B)。Cas9载体pYLCRISPR/Cas9-DB及gRNA载体pYLgRNA-AtU3d/AtU3b/AtU6-1由华南农业大学刘耀光研究院馈赠[31]。
1.2 gRNA靶点选择及其寡核苷酸链引物的设计
根据大豆基因组中GmFAD2-1A基因的外显子序列, 利用 CRISPRdirect网站(http://crispr.dbcls.jp/)设计3个长度为20 bp的靶位点序列(图2), 分别为FAD-AtU3d-T1-F1/FAD-AtU3d-T1-R1、FAD-AtU3b-T2-F2/FAD-AtU3b-T2-R2、FAD-AtU6-1-T3-F3/FADAtU6-1-T3-R3 (表 1)。同时设计 CRISPR鉴定引物FAD2-1A-CasF-Test/FAD2-1A-CasR-Test (表 1), 所有寡核苷酸链引物均由睿博测序公司合成。
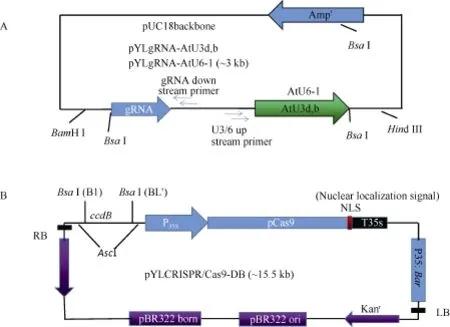
图1 pYLgRNA及pYLCRISPR/Cas9-DB质粒图Fig. 1 Maps of pYLgRNA and pYLCRISPR/Cas9-DB vectors
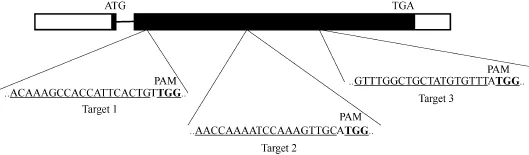
图2 3个靶点分别在GmFAD2-1A基因内的位置Fig. 2 Positions of three targets in the GmFAD2-1A gene locus

表1 引物序列Table 1 Primer sequence
1.3 三靶点 pYLCRISPR/Cas9-FAD2-1A-gRNA载体的构建
参照刘耀光研究员提供的实验指南, 方法如下:(1)靶点接头制备。将接头正反向引物用 TE buffer稀释到1 µmol L-1, 90℃ 30 s后移至室温冷却完成退火。(2) gRNA载体酶切与连接反应。配制10 μL反应体系, 包括1 μL接头、10 ng gRNA质粒、5 UBsaI、35 U T4 DNA ligase、1 μL 10×buffer for T4 DNA ligase, PCR反应程序为37 ℃ 5 min, 20 ℃ 5 min, 5个循环。(3)扩增 gDNA表达盒。第一轮扩增取 1 μL连接产物为模板, 适量高保真 PCR酶, 通用引物U-F/gRNA-R (表 1)各 0.2 µmol L-1。PCR 反应程序为95 ℃ 1 5 s, 55 ℃ 1 5 s, 68 ℃ 1 0 s, 10个循环; 95 ℃ 15 s,60 ℃ 1 5 s, 68℃ 1 0 s, 17~20个循环。各取4 μL电泳检查。第二轮扩增取第一轮PCR产物1 μL稀释20倍, 取 1 μL 为模板, 各表达盒 20~50 μL PCR, 分别利用引物 B1’/B2、B2’/B3、B3’/BL (表 1)对 gDNA进行扩增。95 ℃ 1 0 s, 60 ℃ 1 5 s, 68 ℃ 3 0 s, 18~25个循环。各取2 μL电泳检查产物长度是否符合。(4)产物纯化、酶切和连接。将所有靶点gDNA PCR产物参照全式金公司胶回收试剂盒混合后回收, 取约20~70 ng胶回收产物, 加入约 40~60 ng未切割的pYLCRISPR/Cas9 质粒, 在 15 μL 反应用 5~10 UBsaI 37℃酶切 10 min, 然后加 1.5 μL 10×buffer for T4 DNA ligase和35 U T4 DNA ligase, 用变温循环 酶切连接, 37 ℃ 5 min, 10 ℃ 5 min, 20 ℃ 5 min, 10~15个循环。(5)转化及质粒测序。连接产物转化大肠杆菌 DH5α感受态细胞后, 挑取单克隆接种培养, 抽提质粒后利用AscI酶切鉴定, 并挑取酶切验证正确的克隆送睿博公司测序。将验证正确的重组质粒转化农杆菌EHA101以备大豆遗传转化。pYLCRISPR/Cas9-FAD2-1A-gRNA载体构建如图3所示。
1.4 农杆菌介导大豆遗传转化
采用农杆菌介导的大豆子叶节遗传转化法构建大豆转基因材料[32], 选用大豆品种 H3为受体材料,实验中用到的培养基见表2。利用氯气对大豆表面灭菌, 在无菌超净工作台中, 将大豆种子接种于萌发培养基上, 16 h/8 h (光/暗), 温度为25℃, 湿度为60%的培养室培养1~3 d后, 在子叶节处用手术刀片创造伤口, 用农杆菌侵染液(OD650nm≈ 0.6), 在28℃的摇床中, 侵染30 min。随后, 将子叶放于表面附有灭菌滤纸的共培养培养基中, 25 ℃ , 16 h/8 h 光暗条件下共培养4 d, 转移B5芽诱导培养基诱导不定芽。4周后, 不定芽经芽伸长培养基培养, 培养条件为25℃ , 16 h/8 h光暗周期。待其伸长大约达到5~7 cm时, 再将其转入生根培养基生根, 根系健壮后移到土里, 获得转基因植株。

图3 pYLCRISPR/Cas9-FAD2-1A-gRNA载体构建示意图Fig. 3 Schematic diagram of the pYLCRISPR/Cas9-FAD2-1A-gRNA vector construction
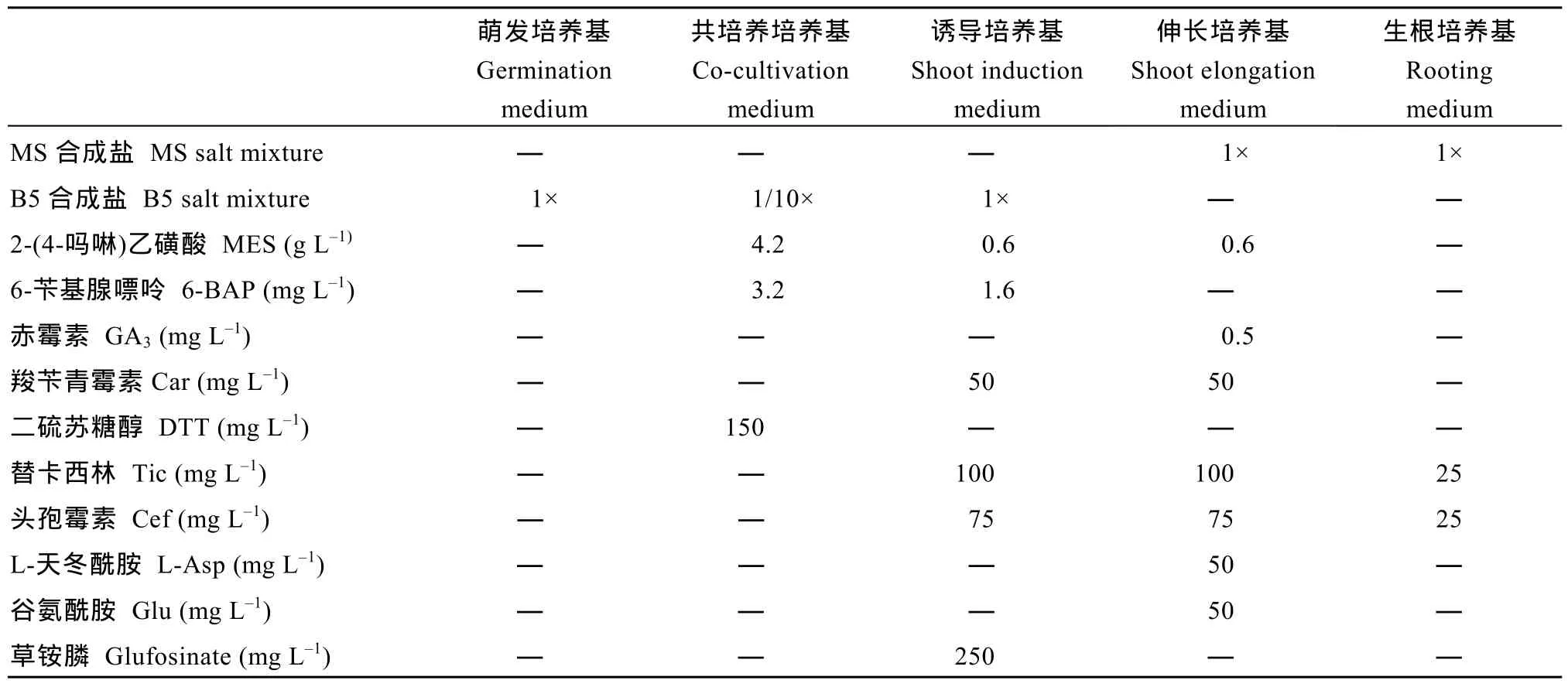
表2 大豆遗传转化中使用的培养基及成分Table 2 Mediums and compositions in soybean transformation
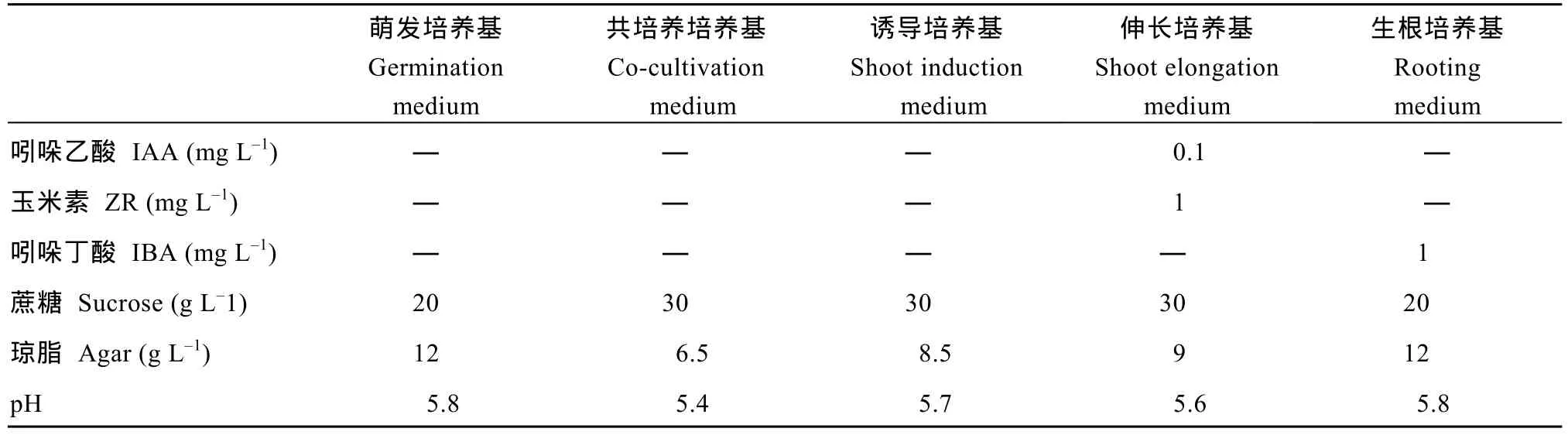
(续表 2)
1.5 转基因大豆 T1代植株抗草铵膦筛选、PCR鉴定及测序
将获得的转基因植株T0代种子以及对照H3种子, 种植于16 h/8 h (光照/黑暗)、湿度为60%的温室中, 当 T1代植株长出第 1片三出复叶时, 选择长势一致的嫩叶, 用毛笔蘸取浓度为150 mg L-1的草铵膦溶液, 对其中1/3叶片进行均匀的涂抹, 初步筛选抗草铵膦的植株。参照康为世纪公司的新型植物基因组DNA提取试剂盒(NuClean Plant Genomic DNA Kit)说明书, 提取转基因大豆和对照 H3的基因组DNA, 并以DNA为模板, 用Bar-F/R引物(表1)进行PCR扩增, 检测出阳性植株。以筛选出的阳性植株DNA为模板, 用 FAD2-1A-CasF-Test/FAD2-1ACasR-Test靶点鉴定引物(表 1)进行 PCR扩增, 并将PCR产物送至测序公司测序。
1.6 品质分析及农艺性状调查
分别选取100粒T3代纯合GmFAD2-1A突变体大豆种子和对照大豆品种华夏 3号, 委托东北农业大学农学院, 采用气相色谱法检测脂肪酸各组分的含量[33], 福斯谷物分析仪(INFRATEC1241)检测总脂肪(%)及总蛋白含量(%), 试验进行3次生物学重复。农艺性状包括株高、主茎节数、单枝分枝数、叶形、花色、种皮色、种脐色和生育期。
2 结果与分析
2.1 pYLCRISPR/Cas9-FAD2-1A-gRNA载体的构建
根据 CRISPR/Cas9技术的原理, 构建pYLCRISPR/Cas9-FAD2-1A-gRNA表达载体, 将pYLCRISPR/Cas9-FAD2-1A-gRNA转化大肠杆菌后,经菌落PCR鉴定(图4-A) 3~7号为阳性单克隆, 挑取3号单克隆接种培养, 抽提质粒后利用AscI进行酶切鉴定, 如图 4-B所示, 切出的目的片段大小约为1.5 kb左右, 表明FAD2-1A的3个靶点gRNA表达盒顺利插入到pYLCRISPR/Cas9载体上。为进一步确定靶位点的准确性, 通过设计特异性引物对构建载体上的各靶点测序, 得到完全一致的序列, 表明表达载体构建成功, 可用于后续试验。
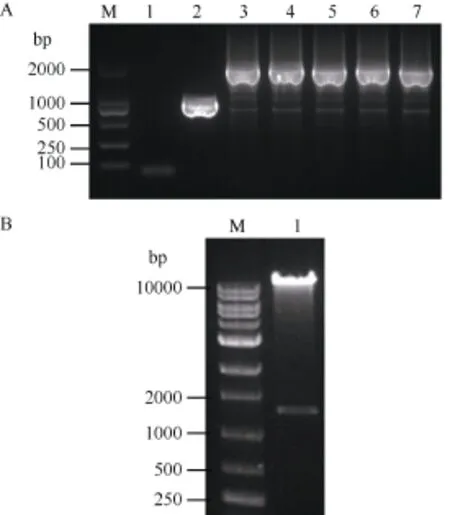
图4 重组质粒鉴定Fig. 4 Identification of recombinant plasmids
2.2 转基因植株的获得
用制备好的含有 pYLCRISPR/Cas9-FAD2-1A-gRNA载体的农杆菌侵染液侵染大豆的子叶节, 经萌发、暗培养、恢复、筛选培养、伸长培养和生根培养后移入无菌土中保温保湿培养(图 5-A)。涂抹草铵膦后, T0代转基因大豆对草铵膦产生抗性, 叶片表面无明显变化(图5-B-a), 而未转化成功的大豆, 则叶片表面发黄, 干枯(图5-B-b)。选取T0代涂抹草铵膦后无明显反应的3棵植株, 扩繁种子, 共获得5粒T0代种子。
2.3 GmFAD2-1A大豆突变体的鉴定

图5 转化过程及叶片涂抹草铵膦筛选结果Fig. 5 Conversion process and the results of leaf painting
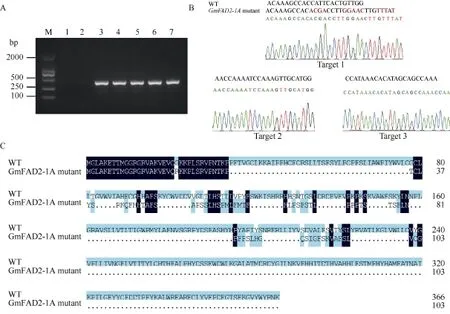
图6 GmFAD2-1A突变体鉴定Fig. 6 Identification of GmFAD2-1A mutant
提取 T1代转基因大豆叶片的总 DNA, 以CRISPR/Cas9载体上含有的外源标记Bar基因引物对转基因大豆植株进行PCR扩增, 检测结果显示, T1代5株转基因植株均为阳性植株(图6-A)。利用靶点筛选引物 FAD2-1A-CasF-Test/FAD2-1A-CasR-Test (表 1),对T1代阳性植株进行PCR扩增, 连接T载体后测序发现, 仅编号为4的植株发生编辑(以下称GmFAD2-1Amutant), 该突变体仅在靶点1发生编辑(图6-B):在靶点位置由碱基CATT替换成ACGA, AC替换成CT, 插入 4个碱基 GAAC; 并且在靶点位置后由碱基GCC替换成TTT, 插入1个T碱基。该靶点碱基突变导致FAD2-1A的蛋白移码突变(图6-C)。
2.4 GmFAD2-1A大豆突变体品质分析及农艺性状调查
GmFAD2-1A突变体大豆株系在株高、主茎节数、单枝分枝数、叶形、花色、种皮色、种脐色、生育期等方面与对照品种H3没有明显差异(表3和图 7-A), 表明GmFAD2-1A基因的突变对转基因大豆的农艺性状表型没有影响。GmFAD2-1A突变体的油酸含量为 23%, 极显著高于对照品种 H3 (20%),而亚油酸、棕榈酸和硬脂酸极显著降低, 亚麻酸没有显著变化(图7-B), 表明GmFAD2-1A基因是调控大豆种子油酸含量的关键基因。转基因大豆的蛋白和脂肪含量分别为 40.61%和 20.50%, 与对照品种H3无显著差异(表3), 表明利用CRISPR/Cas9技术对控制油酸含量的GmFAD2-1A基因定点编辑没有显著影响转基因大豆种子中总蛋白和总脂肪的积累。
3 讨论
随着人口的增长和生活水平的提高, 中国对大豆产品的品质需求不断增加, 因此改善大豆品质,提高大豆营养成分是大豆育种的主要目标之一。油酸含量高的油非常有益于健康, 油酸可以降低人体血液中有害的低密度脂蛋白, 而对有益的高密度脂蛋白没有影响[34-35]。油酸含量高的油中多不饱和脂肪酸含量低, 在加工过程不需要加氢除去多不饱和脂肪酸, 从而有效避免产生对人体有害的反式脂肪酸[36]。油酸具有强的氧化稳定性与热稳定性, 适于煎炸烹炒。橄榄油(油酸 73%)因其油酸含量高而被认为是一种有益人体健康的食用油。但由于国内不能生产橄榄, 橄榄油全部进口于地中海国家, 价格昂贵, 普通百姓难以消费。因此高油酸大豆油国产化, 具有价格竞争优势, 可替代橄榄油。

图7 GmFAD2-1A突变体表型及其脂肪酸组分含量Fig. 7 GmFAD2-1A mutants phenotype and the fatty acids content
大量研究表明, 抑制大豆种子中控制油酸转化为亚油酸的关键酶基因FAD2-1的表达, 可以有效提高大豆种子中的油酸含量[16-22]。但目前却没有可以大量推广到市场上的高油酸大豆。本研究利用CRISPR/Cas9技术定点编辑大豆FAD2-1A基因, 获得了油酸含量达 23%的纯合突变体大豆, 其油酸含量极显著高于对照 H3, 该结果与前人研究基本相同。不同的是, 本研究利用 CRISPR/Cas9技术获得稳定遗传, 且无外源基因骨架的FAD2-1A突变体大豆植株。本实验选择的大豆受体品种H3为广东、广西、海南、福建中南部等低纬度地区大面积推广种植的大豆品种, 前景广阔。同时本研究所获得的大豆突变体材料与受体材料有着相同的分枝性好, 株型健壮, 具有丰产性突出、综合抗性好的优点。
近年来, CRISPR/Cas9基因编辑系统的发展越来越完善, 与前两代基因编辑技术ZFNs和TALENs相比, 用RNA替代组装蛋白, 实现与靶基因的特异性识别与结合, 使得该技术构建简单灵活[23]。因此,CRISPR/Cas9系统作为一种新兴的快速、稳定、廉价的基因编辑技术, 未来将会更加广泛应用于育种。
目前农杆菌介导大豆遗传转化体系中的外植体有很多, 但子叶节再生体系应用最为广泛和成熟[37]。自从该系统首次由Cheng等[38]报道以后的几十年间,众多科研工作者对该系统进行了改良和优化[37,39]。这个体系具有取材不受时间限制、周期短、再生植株遗传稳定等优点, 其缺点也很明显, 如再生苗嵌合体多, 筛选困难, 对培养条件和操作技术要求较高。虽然大豆的遗传转化效率已经提高了很多, 但相对于水稻、玉米等其他作物, 大豆的转化效率仍然较低, 因此建立高效、稳定的遗传转化技术仍然是大豆研究者亟需解决的问题。
4 结论
利用CRISPR/Cas9技术, 获得适合低纬度种植的高油酸大豆新种质GmFAD2-1A突变体。与受体品种华夏3号(H3)相比,GmFAD2-1A突变体的油酸含量由20%提高到23%, 达到极显著水平, 同时,GmFAD2-1A突变体农艺性状与华夏3号没有显著差异。
