8种水旱环境下2个玉米群体穗部性状QTL间的上位性及环境互作效应分析
2019-05-31赵小强彭云玲徐明霞庄泽龙张金文曾文静高巧红丁永福陈奋奇
赵小强 任 斌 彭云玲 徐明霞 方 鹏 庄泽龙 张金文 曾文静 高巧红 丁永福 陈奋奇
甘肃省干旱生境作物学重点实验室 / 甘肃农业大学农学院, 甘肃兰州 730070
玉米(Zea mays)是高效的 C4粮食作物, 蕴藏着巨大的产量潜力, 并在维护粮食安全、促进畜牧业和工业发展中具有举足轻重的作用。玉米对干旱比较敏感, 干旱缺水不仅影响玉米正常生长发育, 干扰其生理生化代谢, 而且严重影响产量和品质[1-2]。因此, 提高玉米的抗旱能力进而增加其产量已成为玉米育种者努力的方向[3]。玉米的穗部性状是典型的数量遗传性状, 受多个微效基因的调控, 由于其遗传力较高, 并在产量形成中具有重要作用, 因而穗部性状作为抗旱性改良指标在抗旱分子育种研究中得到了极大关注[4-5]。近年来, 借助分子标记技术鉴定干旱胁迫下调控玉米穗部性状的基因组区域为进一步深入剖析其遗传机制提供了可行的手段。
目前, 已有相关研究对干旱胁迫下玉米穗部性状进行了遗传剖析。谭巍巍等[3]以掖 478×黄早四和齐 319×黄早四构建了 2套 F2:3群体, 在干旱胁迫和正常水分条件下检测到75个调控穗长、穗粗、轴粗、穗行数、行粒数、穗粒重和单穗重的QTL。Guo等[6]利用 5003×P138组合的重组自交系(recombinant inbred lines, RILs)群体在干旱胁迫条件下定位到 3个调控穗行数的QTL。Lu等[7]采用综3×87-1的RILs群体在干旱和正常灌溉条件下挖掘到 5个调控穗长、行粒数和单穗重的“一致性”QTL。Sabadin等[8]通过 L-08-05F×L-14-4B组合的 F2:3群体在 5种水分环境下检测到29个调控雌穗个数、单穗重、穗长、穗粗、穗行数和行粒数的 QTL。甚至, 随着学者对玉米穗部性状QTL定位的不断推进, 部分相关功能基因已被克隆。Calderón 等[9]以 W22×CIMMYT8759构建的重组染色体近等基因系(recombinant chromosome nearly isogenic lines, RCNILs)在第1染色体上对1个调控行粒数的QTL (KRN1.4)精细定位, 并找到了 1个调控玉米花序及行粒数发育的indeterminate spikelet1(ids1)基因。Liu 等[10]以H12×H12NX531组合的 F2群体, 在第 4染色体Unbranched3(UB3)基因的下游发现了一段约 3 kb的区间调控UB3的表达进而调控玉米穗行数的变异。李雪华等[11]采用 meta-QTL (mQTL)分析, 干旱胁迫条件下在玉米第6染色体的Bin 6.05-6.06处检测到1个调控10株穗数的mQTL, 并发现此区间存在1个参与渗透调节的pmg1(phosphoglycerate mutase1)基因。通过整合比较以往研究结果不难发现,虽然这些QTL解析了不同水旱环境下穗部性状的部分遗传特征并成功克隆到一些功能基因, 但仍不足以全面剖析不同水分环境下玉米穗部性状的遗传机制和基因调控网络。因此, 在更为丰富的遗传背景及水旱环境下检测更多调控玉米穗部性状的 QTL,并分析QTL与环境互作(QTL by environment interaction, QTL×E)及上位性互作位点, 可为深入剖析干旱胁迫下玉米穗部性状的遗传机制、相应候选基因的确定与分离、开展抗旱高产分子育种提供更多有益参考。本研究构建了2套F2:3群体, 在多种干旱胁迫和正常供水环境下对单穗重、穗轴重、穗粒重、百粒重、出籽率、穗长6个穗部性状进行QTL定位,并分析QTL×E及上位性互作位点, 以期全面剖析其遗传机制, 为玉米抗旱高产分子育种提供参考。
1 材料与方法
1.1 试验材料
参照课题组前期的试验结果[12-15], 以大穗型旱敏感玉米自交系 TS141为同一父本, 小穗型强抗旱自交系廊黄和昌7-2为母本, 组配杂交种廊黄×TS141 (F1LT)和昌7-2×TS141 (F1CT)。通过自交构建2套F2作图群体并自交衍生获得 2套相应的F2:3定位群体, 分别含202 (LTPOP)和218 (CTPOP)个家系。其中自交系TS141属于Reid系, 廊黄和昌7-2属于四平头系[16-19]。
1.2 田间试验及数据处理
2014年4月中旬将亲本廊黄和TS141, 及其相应的 F1杂交种(F1LT)和 F2:3群体(LTPOP)种植于甘肃武威(37.97°N, 102.63°E, 海拔 1508 m)和甘肃张掖(38.83°N, 106.93°E, 海拔 1536 m)。2015 年 4 月中旬将亲本昌7-2和TS141, 及其相应的F1杂交种(F1CT)和 F2:3群体(CTPOP)种植于甘肃古浪(37.67°N,102.63°E, 海 拔 1785 m)和 甘 肃 景 泰 (37.18°N,104.03°E, 海拔 1640 m)。在 4 个试验点(武威、张掖、古浪和景泰)均设置干旱胁迫(玉米大喇叭口前期至花期结束不供水, 其他生育时期每隔20 d供水一次)和正常供水(玉米全生育期内只要降水不足时就及时补水)处理[2], 对每一处理均采用完全随机区组设计, 3次重复, 单行区, 行长6 m, 株距30 cm, 行距60 cm, 每行20株, 种植密度为55,580株 hm-2。4个试验点玉米生育期内气象数据见图1, 由于4个试验点年蒸发量较大而降水较低, 为了便于供水, 因此, 采用平膜覆盖地表及滴灌供水, 其他管理同一般大田。

图1 4个试验点(武威、张掖、古浪和景泰)气象数据Fig. 1 Meteorological data in four experimental sites (Wuwei, Zhangye, Gulang, and Jingtai)
参考石云素等[20]制定的《玉米种质资源描述规范与数据标准》, 在玉米成熟期(9月底)从每行选择长势整齐一致的亲本、F1杂交种及F2:3家系各10株考察单穗重(ear weight, EW)、穗轴重(cob weight,CW)、穗粒重(grain weight per ear, GW)、百粒重(100-kernel weight, KW)、出籽率(kernel ratio, KR;KR=穗粒重/单穗重×100%[12])和穗长(ear length,EL)。参照 Zhao等[19]的方法, 计算每一穗部性状在干旱胁迫环境下的变化率(rate of change of each trait under water-stressed environment, RC)。
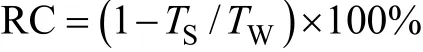
式中,TS表示干旱胁迫环境下相应性状的测定值,TW表示正常供水环境下相应性状的测定值。采用IBM SPSS19.0 (SPSS Inc., Chicago, IL, USA)软件中GLM-Univariate模型对 2套 F2:3群体 6个穗部性状进行方差分析, 并分析其Pearson表型相关系数(rp)。参照 Zhao等[18]的方法估算相应穗部性状间的遗传相关系数(rg), 即:式中, COVgxy表示x与y性状间的协方差,和分别表示x和y性状的遗传方差。参照 Knapp等[21]的方法估算相应穗部性状的广义遗传力(broadsense heritability,H2)。

F1杂种优势指数(F1heterosis index) HI = F1/MP× 100%
相对杂种优势(relative heterosis) RH = (F1-MP)/F1× 100%
中亲优势(mid-parent heterosis) MH = (F1- MP)/MP × 100%
超亲优势(over-parent heterosis) OH = (F1- PH)/PH× 100%
F2:3优势降低率(F2:3advantage reduction rate)ARR = (F2:3- F1)/F1× 100%
式中, MP为双亲平均值, PH为高值亲本。
1.3 穗部性状QTLs检测
本课题组前期已经构建了2套相应F2群体的遗传连锁图谱[18-19]。采用Windows QTLs Cartographer 2.5 软件(http://ststgen.ncsu.edu/qtlcart/WQTLcart.htm)的复合区间作图法(composite interval mapping, CIM)对单个水分环境下的穗部性状进行QTL定位。通过1000次随机抽样确定LOD (LOD > 3.0)阈值[22]。参照 Stuber等[23]的方法估算基因的作用方式, |d/a| =|显性效应值/加性效应值|; A (加性效应)的|d/a| = 0~0.20; PD (部分显性)的|d/a| = 0.21~0.80; D (显性效应)的|d/a| = 0.81~1.20; OD (超显性效应)的|d/a| > 1.20。参照McCouch等[24]的方法命名QTL。
采用 QTL Network 2.0 软件(http://ibi.zju.edu.cn/software/qtlnetwork/)的基于混合线性模型的复合区间作图法(mixed linear model based on composite interval mapping, MCIM)联合多个水分环境进行联合QTL定位, 并分析QTL×E及QTL上位性互作效应。设窗口大小为10 cM, Permutation次数为1000次, 用F值(P< 0.05)表示 QTL 的显著性[25]。若 QTL中间插入字母“J”表示该 QTL只在联合分析时出现,而在单环境检测下未出现。根据Tuberosa等[26]的标准检测稳定表达的sQTL (stable QTL), 即在不同群体或环境间检测到同一性状的 QTL, 标记区间相同或置信区间(confidence interval, CI)重叠(距离< 20 cM), 则被认定为一个sQTL。
2 结果与分析
2.1 不同水分环境下2套F2:3群体穗部性状的表型鉴定
同一水分环境下, 6个穗部性状在双亲间差异较大(表1), 说明亲本TS141与廊黄或昌7-2间存在丰富的穗部性状遗传变异可对其杂交后代群体进行数量性状遗传分析。与4种正常供水环境(E1、E3、E5、E7)相比, 4种干旱胁迫环境(E2、E4、E6、E8)下 3个亲本(廊黄、昌7-2、TS141)、2个F1杂交种(F1LT、F1CT)和 2 套 F2:3群体(LTPOP、CTPOP)的 6 个穗部性状均显著降低(表 1), 其平均降低程度(RC)为穗轴重(17.0%)> 百 粒 重 (13.0%)> 穗 长 (12.1%)> 穗 粒 重(9.9%)>单穗重(9.6%)>出籽率(3.9%)(图 2), 表明干旱胁迫能够显著抑制玉米产量因子, 导致玉米严重减产。此外, 8种不同水分环境下, 2套F2:3群体6个穗部性状的峰度和偏度均基本介于-1.0~1.0间(表1),呈典型的数量遗传特性, 适合对其进行QTL分析。
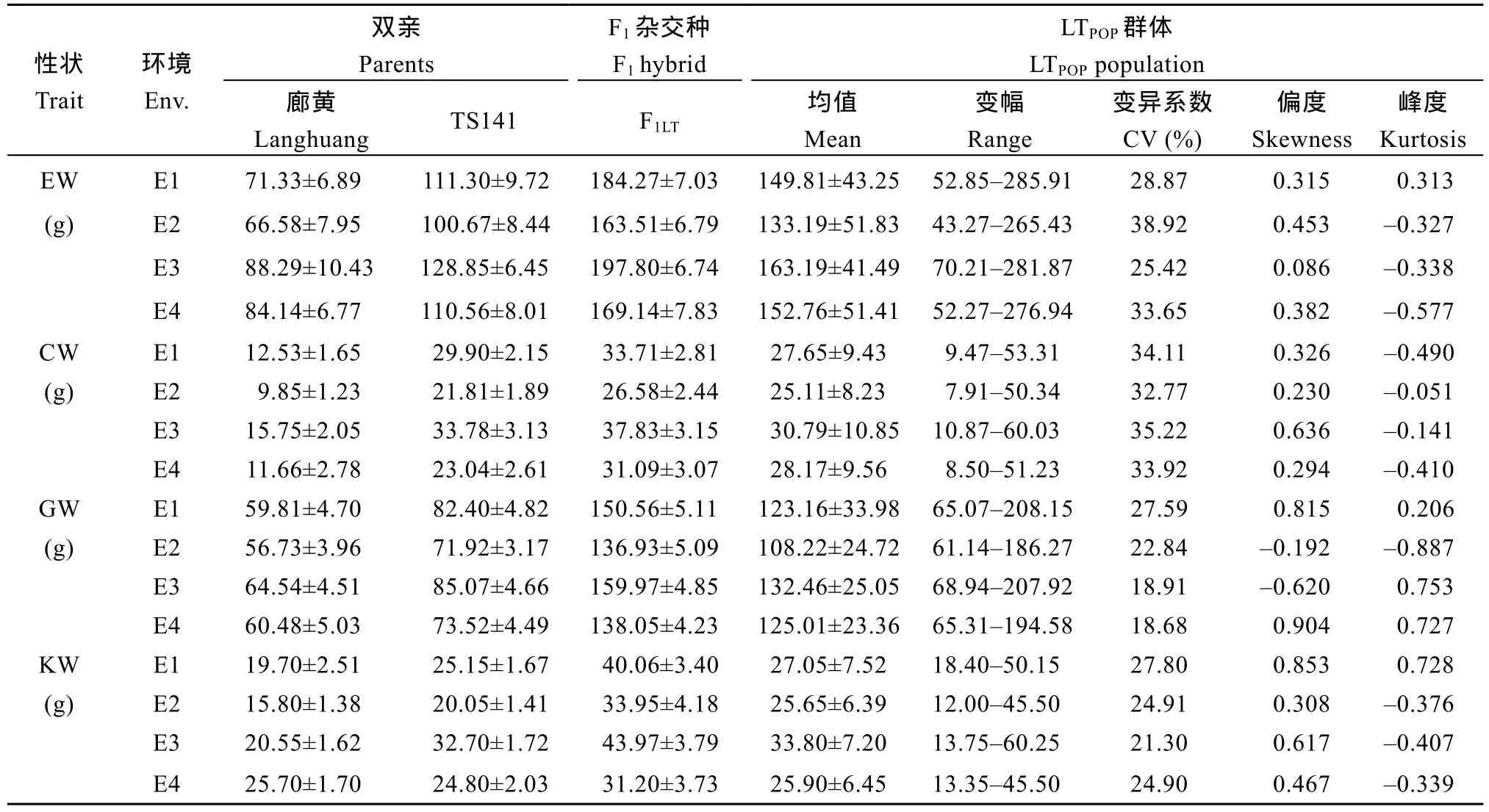
表1 8种水分环境下F2:3群体(LTPOP/CTPOP) 6个穗部性状的表型值Table 1 Phenotypic value of six ear related traits in F2:3 population (LTPOP/CTPOP) under eight watering environments

(续表 1)
2个 F1杂交种(F1LT、F1CT)与其亲本相比, 除出籽率的正向超亲优势(0.9%)表现不明显外, 其余 5个穗部性状均显著大于高值亲本, 表现为明显的正向超亲优势, 其平均超亲优势介于 117.8% (穗粒重)~35.8% (穗轴重)(图 2); 此外, 6 个穗部性状的 F1杂种优势指数、相对杂种优势、中亲优势及 F2:3优势降低率均一致表现为穗粒重(256.3%、59.7%、156.3%和-34.6%)>单穗重(236.3%、55.8%、136.3%和-33.9%)>穗轴重(196.1%、47.5%、96.1%和-26.9%)>穗长(185.2%、45.5%、85.2%和-26.3%)>百粒重(176.7%、42.0%、76.7%和-25.4%)> 出籽率(105.2%、5.5%、5.8%和-2.8%)(图 2), 说明玉米 F1杂交种 6个穗部性状的杂种优势大小不一, 且自交后出现不同程度的杂种优势衰退现象。
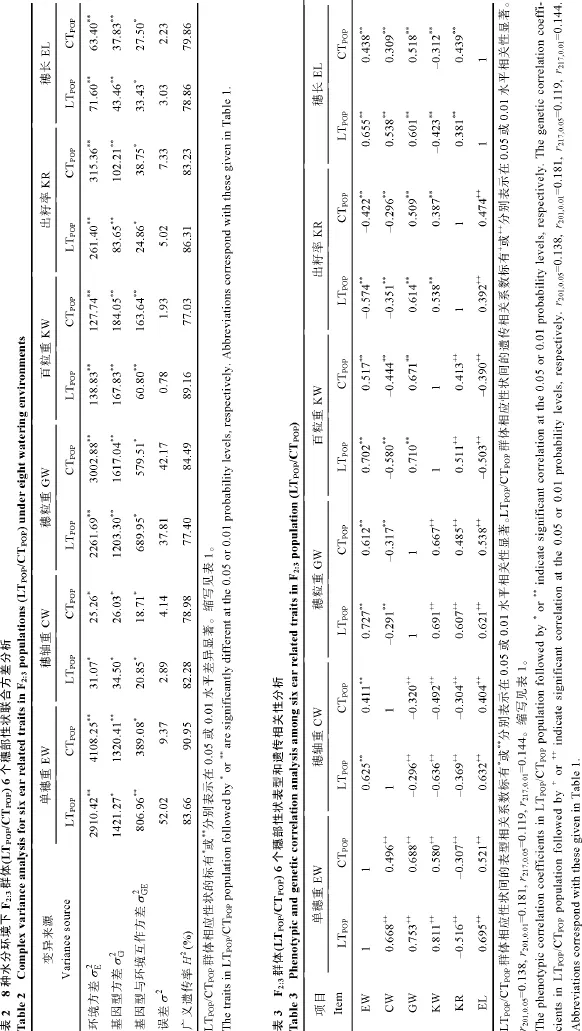
联合方差分析表明, 构建的2套F2:3群体6个穗部性状在基因型间、环境间、基因型与环境互作间均达到P< 0.01或P< 0.05差异显著水平(表2), 说明玉米的6个穗部性状除显著受自身的遗传调控外,还显著受水分环境及其互作间的影响。且多种水分环境下 6个穗部性状的广义遗传力均较高, 介于77.03%~90.95% (表2), 表明玉米的6个穗部性状受遗传本质的影响较大。
玉米 6个穗部性状表型和遗传相关分析表明,在不同水分环境下, 玉米的单穗重与穗轴重、穗粒重及穗长间极显著(P< 0.01)正向表型/遗传相关, 与出籽率间极显著负向表型/遗传相关; 穗轴重与穗长间极显著正向表型/遗传相关, 与穗粒重、百粒重及出籽率间极显著负向表型/遗传相关; 穗粒重与百粒重、出籽率及穗长间极显著正向表型/遗传相关; 百粒重与出籽率间极显著正向表型/遗传相关, 与穗长间极显著负向表型/遗传相关; 出籽率与穗长间极显著正向表型/遗传相关(表 3), 说明不同水旱环境下玉米的各个穗部性状彼此高度遗传和表型关联, 并在不同水分环境影响下协同作用, 最终形成玉米产量。
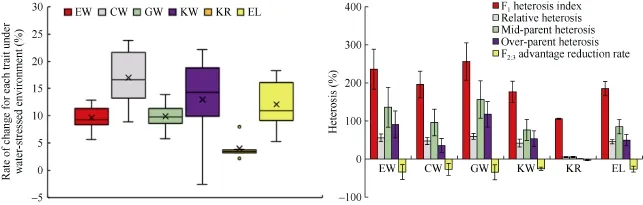
图2 6个穗部性状RC和杂种优势分析Fig. 2 RC (rate of change for each trait under water-stressed environment) and heterosis analysis of six ear related traits缩写见表1。Abbreviations correspond with these given in Table 1.
2.2 单水分环境下2套F2:3群体穗部性状的QTL分析
采用CIM法, 2套F2:3群体8种水旱环境下总共检测到62个穗部性状QTL, 分布于玉米的10个连锁群中, 单环境下单个 QTL的表型贡献率介于4.00% (LTPOP在 E1环境下的qCW-Ch.4-1)~15.65%(LTPOP在E2环境下的qEW-Ch.1-2)(图3)。其中有关单穗重的13个QTL, 44.4%、22.2%、7.4%和26.0%的单穗重分别受加性(A)、部分显性(PD)、显性(D)和超显性(OD)等遗传效应调控; 有关穗轴重的11个QTL, 55.2%、17.2%和27.6%的穗轴重分别受A、PD和 D 等遗传效应调控; 有关穗粒重的 13个 QTL,25.0%、35.7%、17.9%和21.4%的穗粒重分别受A、PD、D和OD等遗传效应调控; 有关百粒重的7个QTL, 35.3%、47.1%和17.6%的百粒重分别受A、PD和 OD等遗传效应调控; 有关出籽率的 9个 QTL,66.7%、19.0%和14.3%的出籽率分别受A、PD和D等遗传效应调控; 有关穗长的 9个 QTL, 50.0%、35.0%和15.0%的穗长分别受PD、D和OD等遗传效应调控。
?

干旱胁迫环境下 2套 F2:3群体间总共检测到 38个(占 61.3%)穗部性状 QTL (图 3), 说明干旱胁迫能够激活部分玉米穗部性状QTL/基因的表达。2套F2:3群体在多个干旱胁迫环境下总共检测到10个稳定表达的 sQTL (图 3), 即 umc2224-bnlg1484 (Bin 1.01-1.03)、bnlg1484-umc1917 (Bin 1.03-1.04)、bmc1627/umc1356-umc1278 (Bin 1.07)、bnlg1018-bnlg1909/bnlg1613 (Bin 2.04)处分别调控穗轴重、出籽率、穗长等的 4 个 sQTL; 及 umc2025-umc1395 (Bin 1.05)、bnlg1025-mmc0041 (Bin 1.07-1.08)、umc2041-umc2188(Bin 4.08)、umc2216-umc1072 (Bin 5.06-5.07)、umc2040-bnlg1174a (Bin 6.05)、umc1120-umc2346(Bin 9.04-9.06)处同时调控多个穗部性状的6个“一因多效”sQTL, 说明玉米的这些Bin区域6个穗部性状在不同环境下普遍呈紧密连锁遗传。
2.3 不同水分环境下2套F2:3群体穗部性状的联合QTL及QTL×E分析
采用MCIM法, 2套F2:3群体在8种水旱环境下进行了QTL联合分析, 总共检测到54个穗部性状联合QTL, 单个联合QTL的加性效应表型贡献率(h2A)介于 2.79% (LTPOP的qGW-Ch.8-1)~12.95% (LTPOP的qEW-J10-1), 其中 25个(46.3%)联合 QTL仅在联合分析中被检测到(图3和表4)。
此外, 24个(44.4%)联合 QTL 参与了 QTL×E (P<0.05), 主要分布于第 1、第 2、第 5、第 8和第 10染色体上, 单个QTL×E的加性与环境互作表型贡献率(h2AE)介于 1.24% (LTPOP的qGW-Ch.8-1)~7.11%(CTPOP的qEW-J10-1)(表 4)。2 套 F2:3群体间总共检测到 6个稳定表达的 QTL×E (表 4), 分别位于umc2224-bnlg1484 (Bin 1.01-1.03)、phi308707-umc1847 (Bin 1.10)/mmc0041-phi308707 (Bin 1.08-1.10)/bnlg1025-mmc0041 (Bin 1.07-1.08)、bnlg1520-umc1736 (Bin 2.09)、bnlg1863-umc2075 (Bin 8.03)、umc2356-umc1607 (Bin 8.06-8.07)和umc1319-bnlg 1451 (Bin 10.01)处。
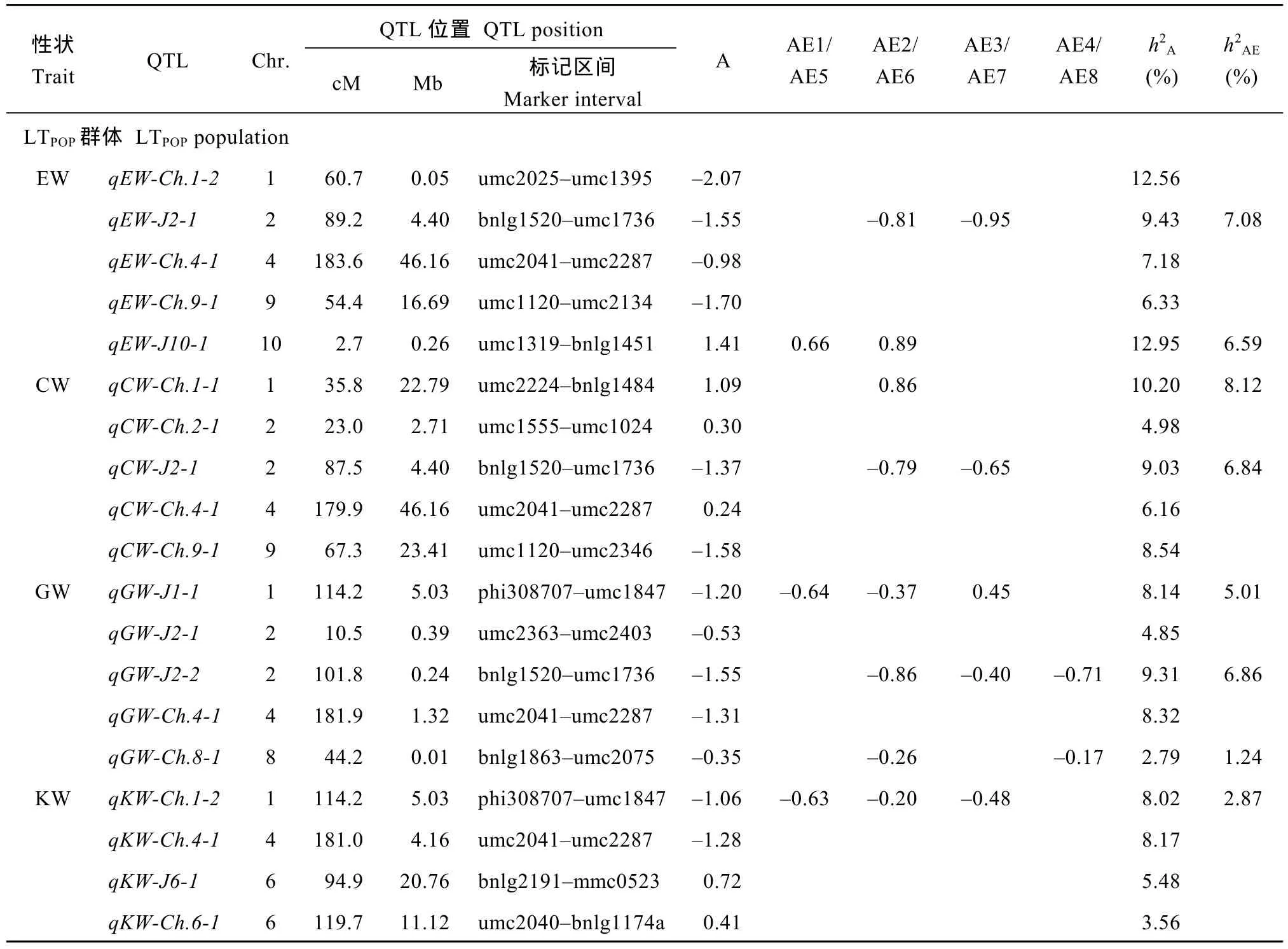
表4 多环境下采用MCIM法对F2:3群体(LTPOP/CTPOP) 6个穗部性状联合QTL及QTL×E分析Table 4 Joint QTLs and QTL×E for six ear related traits detected in F2:3 population (LTPOP/CTPOP) across multiple environments with MCIM

(续表 4)
2.4 不同水分环境下 2套 F2:3群体穗部性状的QTL间上位性效应分析
不同水分环境下2套F2:3群体穗部性状QTL间的上位性互作效应分析中总共检测到 17对加性与加性/显性上位性(AA/AD) QTL (P< 0.05)(表 5)。其中单穗重间检测到2对AD互作, 分别位于Bin 2.09与Bin 4.08-4.09、Bin 1.07-1.08与Bin 6.04-6.05处,AD上位性互作表型贡献率(h2AD)介于4.27%~6.92%;穗轴重间检测到3对AA互作, 分别位于Bin 1.01-1.03与1.10、Bin 2.09与Bin 4.08、Bin 1.10-4.09处, AA上位性互作表型贡献率(h2AA)介于 3.85%~5.14%间;穗粒重间检测到1对AA和1对AD互作, 分别位于Bin 2.02-2.04与Bin 6.05、Bin 2.02-2.04与Bin 8.03处,h2AA和h2AD分别为 5.94%和 3.61%~4.93%; 百粒重间检测到1对AD互作, 位于Bin 1.08-1.10与Bin 6.04处,h2AD为 4.40%~6.88%; 出籽率间检测到 4对AA互作, 分别位于Bin 1.07-1.08与Bin 8.06-8.07、Bin 6.05与Bin 7.04、Bin 6.05与Bin 8.06-8.07处,h2AA介于2.24%~6.01%; 穗长间检测到1对AA互作, 位于Bin 1.08-1.10与Bin 4.08处,h2AA为4.96%。
3 讨论
3.1 水分对玉米穗部性状的影响及穗部性状的育种应用
在全球对玉米需求量的持续刚性增加及水资源短缺不可逆转的趋势下, 通过遗传改良提高玉米的抗旱性并最终增加产量已成为全球玉米生产亟待解决的问题之一。生殖生长阶段水分亏缺时, 玉米的雌穗发育迟缓, 小花受精率降低, 籽粒结实率下降,空秆率增加, 籽粒发育受阻, 穗长、单穗重、穗轴重、穗粒重、百粒重、穗粒数和产量等严重降低[2-3,14,27]。本研究也得到类似的研究结果, 即干旱胁迫后抗旱性差异较大的3份玉米亲本自交系及其构建的2个F1杂交种和 2套 F2:3群体的 6个穗部性状均显著降低, 其降低程度为穗轴重>百粒重>穗长>穗粒重>单穗重>出籽率, 表明穗轴重、百粒重和穗长的下降是导致玉米产量降低的主要原因。Robinson等[28]研究表明, 玉米育种中通过间接选择遗传力较高的穗粗、穗长、穗行数、百粒重等穗部性状, 进而培育出优良品种的效率远高于对其产量的直接选择。本研究表明, 8种不同水旱环境下2套F2:3群体6个穗部性状受本身遗传特性影响较大, 其广义遗传力为77.03%~90.95%。此外, 2个F1杂交种的单穗重、穗轴重、穗粒重、百粒重、穗长呈明显的正向超亲优势, 其值显著大于高值亲本, 而出籽率表现为较弱的正向超亲优势; 且2个F1杂交种的F1杂种优势指数及相对杂种优势与 F2:3群体的优势降低率表现一致, 均为穗粒重>单穗重>穗轴重>穗长>百粒重>出籽率, 这与李忠南等[29]、赵小强等[12]和 Zhao等[18]的研究结果一致。因此, 选择优良穗部性状的玉米基因型时需要注重对其基础材料的选择, 同时注意对父本、中亲和高亲的选择, 并兼顾杂种优势和杂种优势的衰退, 进而提高育种选择效率。
剖析不同水旱环境下玉米穗部性状的遗传机制,可为开展抗旱高产分子育种提供理论支持。本研究共检测到62个穗部性状QTL, 分布于玉米的10个连锁群中。穗轴重和出籽率QTL主要受加性遗传效应调控, 其加性遗传效应分别占 55.2%和 66.7%, 单穗重、穗粒重和百粒重QTL主要受非加性遗传效应调控, 其非加性遗传效应分别占55.6%、75.0%和64.7%,而穗长QTL受两种遗传效应调控, 各占50.0%, 与前人[2-5,12]的研究结果一致。因此, 在不同水旱环境下改良玉米的穗轴重、出籽率和穗长时应注重对其加性效应的累加, 同时还要考虑非加性效应的影响, 而对单穗重、穗粒重和百粒重而言, 组配杂交种时应特别注重双亲的相互作用及杂种优势的影响。
3.2 干旱胁迫下玉米穗部性状QTL/sQTL的挖掘
本研究检测到62个QTL, 在干旱胁迫环境下检测到38个QTL。说明调控玉米穗部性状的QTL在不同水旱环境下会发生改变, 有些在正常供水环境下表达的QTL在干旱胁迫环境下被抑制了, 而有些在正常供水环境下不表达的QTL在干旱胁迫环境的诱导下被激活了, 因此QTL/基因在不同水旱环境下的特异性表达直接导致了玉米穗部性状表型上的差异。Tuberosa等[26]研究发现由于不同性状间存在共同的遗传机制, 导致“一因多效”或控制不同性状的基因普遍紧密连锁。本研究也在 Bin 1.05、Bin 1.07-1.08、Bin 4.08、Bin 5.06-5.07、Bin 6.05和Bin 9.04-9.06处检测到多个“一因多效”穗部性状 QTL,与表型及遗传相关分析结果高度一致, 暗示玉米染色体的这些 Bin区域协同作用, 共同调控玉米穗部相关性状的遗传。此外, 作为典型的复杂数量遗传性状, 玉米穗部性状的QTL定位因不同遗传背景、生态环境或定位方法而不尽相同, 所以直接将这些QTL应用于玉米育种实践中尚存在一定难度。本研究总共检测到 10个稳定表达的 sQTL, 可为干旱胁迫环境下玉米穗部性状遗传机制阐述、QTL精细定位、基因克隆及抗旱分子育种提供有益参考。
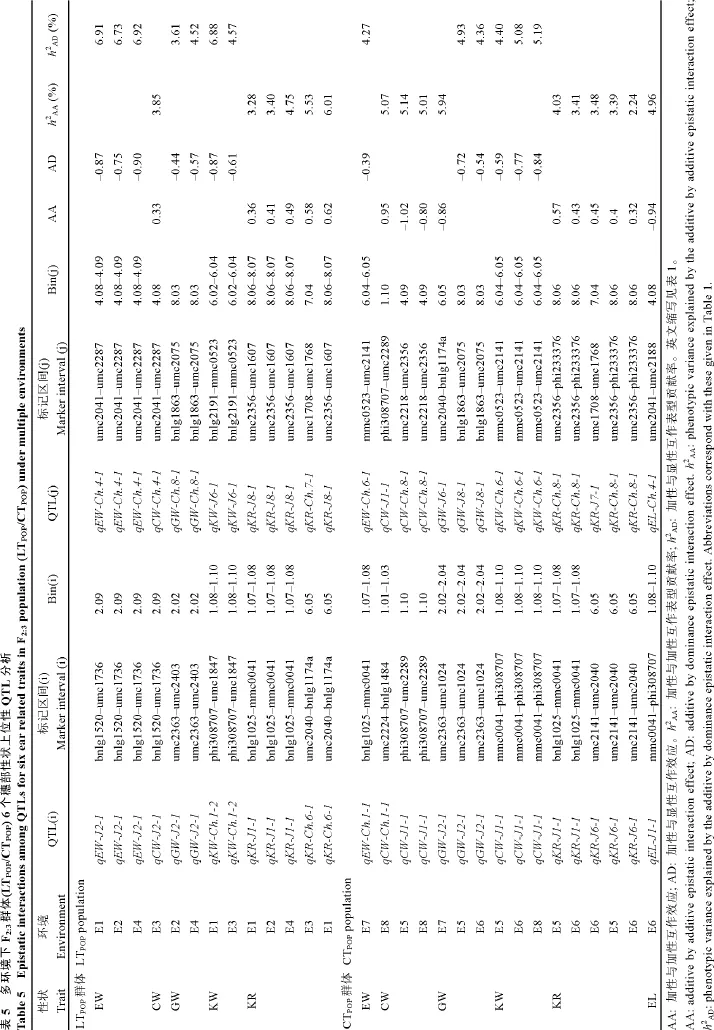
?
位于umc2224-bnlg1484 (Bin 1.01-1.03)处存在1个调控穗轴重的 sQTL, 位于 bnlg1484-umc1917(Bin 1.03-1.04)处存在1个调控出籽率的sQTL。赵小强等[12]利用2套F2群体也在此区间bnlg1484附近检测到 1个同时调控单穗重、穗轴重和出籽率的sQTL。Messmer等[30]利用 1套 RILs群体还在 Bin 1.03和 Bin 1.04处定位到 2个调控玉米百粒重的QTL。此外, 采用 meta分析法, 于多个干旱胁迫环境下 Zhao等[2]在 Bin 1.02-1.03 (umc1166-bnlg439)处挖掘到1个同时调控单穗重、穗轴重、穗长和产量的 meta-QTL(mQTL), 并在此区间检测到glutamine synthetase 6(gln6)、heat shock protein 26(hsp26)和heat shock protein(hsp70) 3个候选基因,其中gln6可以显著提高植物的耐盐性, 而hsp26和hsp70参与了植物的耐热和抗旱性。李雪华等[11]也在Bin 1.03 (umc11a)处检测到1个同时调控产量和10株穗数的 mQTL, 说明 Bin 1.03附近是调控玉米多个穗部性状及产量的重要“一因多效”或富集位点,在不同水分环境下通过协调调控单株穗数、单穗重、穗轴重、出籽率和穗长等的发育, 影响玉米产量的形成。于umc2025-umc1395 (Bin 1.05)处存在1个同时调控单穗重、穗粒重和百粒重的 sQTL。马金亮等[31]利用 1套 F2:3群体的多年表型鉴定, 在 Bin 1.05(umc1676-umc1703)处挖掘到 1个调控出籽率的sQTL, 暗示Bin 1.05处可能是调控玉米穗部性状的重要富集区域, 可能包含调控玉米穗部性状的重要功能基因。于bmc1627/umc1356-umc1278 (Bin 1.07)处存在 1个调控出籽率的 sQTL, 于 bnlg1025-mmc0041 (Bin 1.07-1.08)处存在1个同时调控单穗重、穗轴重、穗粒重和百粒重的sQTL。马金亮等[31]在Bin1.07-1.08 (umc1122-bnlg643)处挖掘到1个调控出籽率的sQTL。张伟强等[32]在Bin 1.07 (umc2236)附近定位到 1个调控出籽率的主效 QTL。Li等[33]也在Bin 1.07-1.08 (bnlg1556-phi039)区间检测到1个同时调控穗长和行粒数的mQTL, Wang等[34]也在Bin 1.07处检测到1个调控产量的mQTL, 印证了这一Bin区域是重要的玉米穗部性状“一因多效”位点。于umc2041-umc2188 (Bin 4.08)处挖掘到1个同时调控单穗重、穗粒重、百粒重和穗长的sQTL。多个水旱环境下Zhao等[2]在Bin 4.08 (umc2041-umc2287)处检测到1个同时调控单穗重、穗轴重、百粒重和穗长的sQTL, 进一步分析在umc2287附近发掘到1个调控穗轴重的 mQTL, 并预测到 1个H+-ATPase基因。于umc2040-bnlg1174a (Bin 6.05)处检测到1个同时调控穗粒重、百粒重、出籽率和穗长的sQTL。赵小强等[12]在同一区间的 umc2040-bnlg1174处还检测到1个调控雌穗个数的sQTL。利用meta分析法, Wang等[34]在Bin 6.05处也检测到了2个同时调控雌穗个数、穗粒重和产量的mQTLs, 以及1个调控玉米雌雄穗发育的iguleless3(Ig3)基因。于umc1120-umc2346 (Bin 9.04-9.06)处存在 1个同时调控单穗重、穗轴重、穗粒重、百粒重和穗长的sQTL。Zhao等[2]、赵小强等[12]和兰进好等[35]也在此区间内同样检测到多个调控单穗重、穗轴重、穗长、百粒重、穗行数和穗粒重的QTL。另外, 本研究还检测到2个新的sQTL, 位于bnlg1018 (Bin 2.04)附近的调控穗长,位于umc2216-umc1072 (Bin 5.06-5.07)处的同时调控单穗重和穗粒重, 这2个Bin位点可为干旱胁迫环境下玉米穗部性状遗传基因剖析提供新信息。
3.3 玉米穗部性状QTL×E效应
Zhuang等[36]分析表明基因与环境互作是影响数量性状的重要因素之一, 因此在不同环境下定位到的QTL结果不尽相同。本研究中也存在类似的研究结果, 但又与前人研究存在较大差异。如谭巍巍等[37]利用 2套 F2:3群体在多年多点的联合分析中只检测到8个穗部性状(分别为 1、2和5个穗行数、穗长和穗粒重) QTL×E (P< 0.05)位点, 主要分布于第1、第6、第7、第 8和第 10染色体。本研究分析表明, 44.4%的 QTL参与了 QTL×E (P< 0.05), 主要分布于第1、第2、第 5、第8和第10染色体。另外, 部分 QTL×E位点能在多个环境中被检测到,如位于Bin 1.01-1.03 (umc2224-bnlg1484)区间调控穗轴重的 QTL, 能在 LTPOP群体的 E1、E2、E3和E4等 4种环境下被检测到, 又同时与 E2环境存在较强的互作关系, 还在 CTPOP群体的 E5、E6和 E8等3种环境下被检测到, 又同时与E6和E8等环境存在较强的互作关系, 其平均主效h2A为8.35%, 明显大于其平均h2AE的 6.35%。位于 bnlg1863-umc2075 (Bin 8.03)区间调控穗粒重的 QTL, 在LTPOP群体的E3和E4等两种环境下被检测到, 又同时与 E2和 E4等环境存在较强的互作关系, 还在CTPOP群体中与 E5和E6等环境存在较强的互作关系, 其平均主效h2A为5.00%, 远大于其平均h2AE的2.86%。这与谭巍巍等[37]的研究结果类似, 即2种环境下在第1染色体umc1009-umc1331区间定位到的qGW1-1-2, 又同时与 3种环境存在显著的互作关系。出现这种现象的原因主要体现在2个方面[38-39],一是可能QTL本身的表型贡献率较大, 易在不同环境中被检测到, 二是可能存在较强的 QTL×E, 显著影响QTL在不同环境中的检测结果。对于这些既能在多环境下被检测到又同时与环境存在显著互作的QTL, 能否成为分子标记辅助选择或图位克隆的候选染色体区段, 关键在于这些QTL×E是否有利。因此, 如何利用玉米穗部性状的这些QTL×E将是今后研究的重点。
3.4 玉米穗部性状QTL的上位性互作效应
Hagiwara等[40]指出 QTL的上位性互作效应是复杂数量性状遗传和杂种优势形成的重要遗传基础。常立国等[41]采用 178×K12构建 1套 RILs群体检测到15对调控出籽率的AA上位性QTL。谭巍巍等[37]利用掖 478×黄早 4和齐 319×黄早四构建 2套F2:3群体检测到 18对调控穗长、穗粗、穗行数和穗粒重的AA、AD、DA、DD上位性QTL。本研究也同样对 2套 F2:3群体的 6个穗部性状在 8种不同水分环境下检测到17对AA/AD上位性QTL。综合分析这些研究结果发现, AA、AD、DA及DD上位性QTL在玉米穗部性状中普遍存在, 也从一定程度上阐述了玉米穗部性状基因位点间的内在关系, 并在遗传中可能与主效QTL发挥同等重要的作用。因此,今后应在更为丰富的遗传背景下有效地检测和利用穗部性状上位性 QTL, 为玉米穗部性状分子遗传机制剖析提供有益参考。
4 结论
干旱胁迫下玉米的 6个穗部性状均显著降, 降低程度为穗轴重>百粒重>穗长>穗粒重>单穗重>出籽率, 表明穗轴重、百粒重和穗长的下降是导致玉米产量降低的主要原因; F1杂交种的单穗重、穗轴重、穗粒重、百粒重、穗长呈明显的正向超亲优势,而出籽率表现为较弱的正向超亲优势, 其杂种优势表现为穗粒重>单穗重>穗轴重>穗长>百粒重>出籽率; 采用 CIM 法, 单环境下在 2套 F2:3群体间总共定位到62个穗部性状QTL, 其中干旱胁迫环境下检测到 38个, 且在2套F2:3群体多个干旱胁迫环境下检测到10个sQTL, 位于Bin 1.01-1.03、Bin 1.03-1.04、Bin 1.05、Bin 1.07、Bin 1.07-1.08、Bin 2.04、Bin 4.08、Bin 5.06-5.07、Bin 6.05和 Bin 9.04-9.06处, 将在一定程度上为干旱胁迫下玉米穗部性状的改良提供参考; 采用 MCIM 法, 联合分析中总共定位到54个穗部性状联合QTL, 其中24个表现显著的QTL×E, 17对QTL参与了显著的AA/AD上位性互作, 体现了穗部性状遗传基础的复杂性。今后应在更为丰富的遗传背景及环境下深入研究穗部性状的遗传机制, 应用于玉米分子育种。
