小麦芒长抑制基因B2的精细定位与候选基因分析
2019-05-31王冬至王焕雪李润枝陈树林阳文龙张爱民刘冬成詹克慧
金 迪 王冬至 王焕雪 李润枝 陈树林 阳文龙张爱民 刘冬成,4,* 詹克慧,*
1河南农业大学农学院, 河南郑州 450002; 2中国科学院遗传与发育生物学研究所 / 植物细胞与染色体工程国家重点实验室, 北京100101; 3北京农学院植物科学技术学院, 北京 102206; 4北京科技大学生物与农业研究中心, 北京 100024
芒是小麦穗器官的重要组成部分, 由小花外稃的末端延伸形成, 属于叶的变态, 是植物长期进化与适应环境的结果。一般有长芒、无芒、半芒和顶芒之分, 芒在麦穗上的分布情况可以概括为芒长均匀分布、从顶部到基部逐渐变短的倒塔形分布与中上部最长而顶部和基部较短的钟形分布等类型[1]。小麦品种之间芒的差异如芒的有无、形状、长短及颜色是非常容易识别的特性, 可以作为区分不同小麦品种以及基因定位的重要形态标记[2-5]。
小麦芒的横切面呈锐角三角形, 3个角上斜生着许多刺毛, 远轴端两侧表皮中部具有带状分布的气孔, 气孔带下方是绿色组织, 富含叶绿体与线粒体,叶绿体沿壁排列, 而近轴端没有气孔和绿色组织[6]。从芒中分离出来的叶绿体能进行光合作用, 尤其是在小麦籽粒灌浆后期, 旗叶开始衰老光合能力下降时, 芒仍保持较高的光合速率, 其光合产物成为小麦籽粒同化物来源的重要补充[7]。芒的光合作用产物就近向籽粒运输,14C同位素标记证实芒的同化产物99%运入着生该芒的小穗[8], 包括芒在内的小麦穗部光合对籽粒干重的贡献依据环境条件不同约为10%~44%[9-12]。在干旱少水条件下, 叶片与芒的蒸腾作用均会减弱, 叶片光合速率亦相应降低, 而芒光合速率能保持相对稳定。因此, 在干旱条件下, 有芒小麦可比无芒小麦增产15%~30%[13]。此外, 芒刺及芒的机械特性, 使得芒在减少收获前种子损失[12]、促进小麦的传播与进化方面起着重要作用[14]。
影响芒长度的基因较多, 目前在1B、2A、2D、3B、4A、5A、6B、7D等染色体上均发现与芒长相关的位点[4,15-17], 其中B1、B2、B3、A和Hd5个基因在芒的发育过程中发挥主要作用,Hd是产生钩芒的基因,A基因促进芒的伸长, 而B1、B2和B3抑制芒的伸长, 且B1的抑制作用最强,B2次之,B3的抑制作用最弱[6,15,18]。Hd的芒缩短成钩状, 基部特征性弯曲, 通常自身弯曲成闭合螺旋, 有时会出现芒基部膨大成膜状[15,18];B1会造成穗基部和中部极短的芒或无芒, 顶端约1/4处芒长增加, 最长可达到1 cm,这些芒一般基部不弯曲故呈竖直状[15,18];B2基因型会造成整个穗部的短芒, 通常麦穗各部位的芒长基本没有差异, 偶尔出现穗中部芒较长的现象, 但芒长度大多在6 mm以下, 偶有弯曲[15,18]。芒长控制基因均遵循孟德尔遗传定律, 其不同等位基因的不同组合产生了芒的不同类型[15], 如携有纯合 3个隐性等位基因hd、b1和b2的小麦表现为长芒, 而基因型为HdB2(如中国春)、B1 B2(如 Federation)则表现为完全无芒[15]。
在禾本科作物中, 已有多个控制芒性状的基因被克隆, 如水稻An-1[19]、An-2/LABA1[20-21]、DL[22]、GAD1/RAE2[23-24]和大麦Lks2[25]、Hooded[26]及ROUGH AWN1[27]等。在小麦中,Hd、B1和B2在染色体上的位置已经通过中国春单体系统、中国春染色体片段缺失系、全基因组关联分析、QTL等手段进行了定位,Hd位于4A染色体短臂[1,15,18],B1位于5A染色体长臂[3-5,15-18,28],B2位于6B染色体长臂[15,17-18,29],然而到目前为止, 小麦中尚无有关控制芒性状的基因被克隆的报道。本研究对小麦短芒材料‘六柱头’的芒长发育及芒长抑制基因的遗传进行探讨, 旨在精细定位其基因位点, 分析其候选基因的序列和表达谱, 为该基因的克隆及功能分析奠定基础。
1 材料与方法
1.1 供试材料及遗传群体的构建
试验材料为‘六柱头’、‘石矮 1号’及其配制的遗传分离群体(简称SL)。‘六柱头’是中国小麦微核心种质资源, 生物学形态表现: 较高株高, 短芒,整穗各部分芒长均不超过0.5 cm; ‘石矮 1号’为河北石家庄农林科学研究院与河北省小麦工程技术研究中心利用花药组织培养育种方法创制的小麦矮秆新种质, 穗部遍布长芒, 芒长度超过 5 cm。利用‘六柱头’和‘石矮1号’杂交获得F1, 自交获得的F2群体(SL-F2)用于基因定位, 部分 F2单株自交得到F2:3家系, 以鉴定 F2单株基因型和进行芒的细胞学观察。分别于2016—2017年和2017—2018年在河南农业大学郑州科教园区种植F2群体和F2:3家系。
1.2 芯片分型
利用植物基因组 DNA提取试剂盒(天根生化科技有限公司, 北京, DP305)提取 F2单株幼苗叶片DNA, 根据 F2:3家系的芒性状分离情况对 F2单株进行选择, 分别将短芒纯合、短芒杂合与长芒材料各15株的DNA等量混合, 构建显性混合池、杂合混合池和隐性混合池, 利用Wheat660 SNP芯片进行全基因组 SNP分型检测(北京博奥晶典生物技术有限公司)。将SNP侧翼序列进行BLAST中国春参考基因组(IWGSC.Ref.V1.0)[30], 参考 SNP标记的遗传图谱及遗传位置信息(中国农业科学研究院作物科学研究所赵光耀研究员提供), 获得SNP在中国春参考基因组上的物理位置信息。利用Microsoft Excel进行混合池之间差异SNP的筛选与染色体分布统计。
1.3 标记开发与遗传图谱构建
采用CTAB法提取SL-F2群体叶片DNA[31], 利用 SSRLocator软件[32]及内置的 Primer 3程序进行SSR搜索与引物设计, 参考 Li等[33]采用 CAPS/dCAPS Designer基于Wheat660K SNP芯片开发的标记进行修改完成CAPS和dCPAS标记的开发, 所用标记的信息如表 1所示, 所有引物均由北京博迈德基因技术有限公司合成。PCR扩增体系总体积为20µL, 包括50 ng模板DNA, 0.2 µmol L-1引物和 1×TaqMasterMix (江苏康为世纪生物科技有限公司,CW0682L, 包含 0.2 mmol L-1dNTPs、0.15 mmol L-1MgCl2和1 UTaqDNA聚合酶)。PCR扩增采用94℃预变性5 min, 然后按照94℃变性30 s, 55℃退火30 s(对于个别引物需根据具体情况调节退火温度), 72℃延伸30 s (对于EST标记, 延伸时间延长至2 min)的条件进行35个循环, 最后72℃延伸10 min。SSR标记在 PCR扩增后直接进行电泳, CAPS标记、dCAPS标记及EST标记在PCR扩增后采用相应的限制性内切酶酶切后电泳检测。限制性内切酶(美国NEB公司, 购自生工生物工程(上海)股份有限公司)的酶切反应按照相应说明书进行。对于 SSR标记PCR扩增产物和dCAPS标记的酶切产物, 用8%非变性聚丙烯酰胺凝胶电泳进行分离, 而 CAPS标记与EST标记的PCR产物和酶切产物用2%琼脂糖凝胶电泳分离检测。
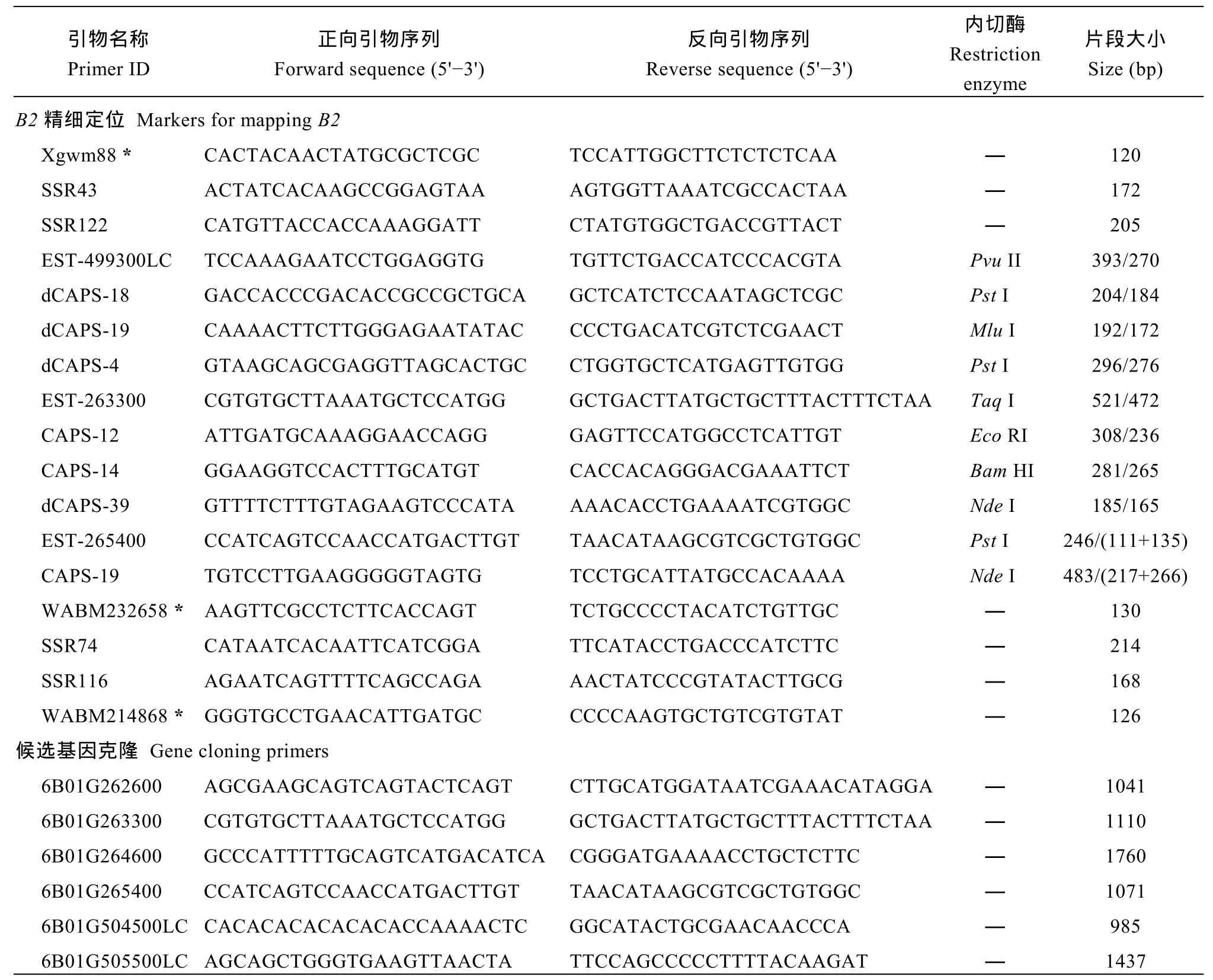
表1 本研究所用到的引物Table 1 Primers used in this study
对SL-F2群体的标记基因型和表型用JoinMap v4.0 (Kyazma B.V.)软件[34]完成遗传图谱的构建, 采用极大似然算法进行重组率计算, 使用Kosambi作图函数进行重组率和遗传距离(cM)的转换, 用Mapchart v2.3软件[35]绘制遗传图谱。
1.4 石蜡切片
将10个短芒和5个长芒SL-F2:3株系分别种植于中国科学院遗传与发育生物学研究所植物温室(IGDB, CAS), 分别取芒长性状没有分离的显性纯合和隐性纯合单株进行芒发育的细胞学观察。对护颖分化期的幼穗(长度约0.5~1.0 cm)用FAA固定液(冰醋酸5 mL, 37%甲醛溶液5 mL, 无水乙醇50 mL,补充双蒸水定容至100 mL)室温固定24 h, 50%乙醇洗涤3次后进行梯度乙醇(70%、80%、90%、95%和100%)脱水和二甲苯(25%、50%、75%和100%)脱色,65℃浸蜡后使用石蜡切片机(德国徕卡, RM2235)将芒中段纵向切成4 µm厚的薄片, 番红-固绿溶液(1.0%番红, 0.5%固绿)染色后封片, NIKON CI-S生物显微镜观察和拍照。
1.5 基因微共线性分析和候选基因分析
以中国春B2区间基因的CDS序列(IWGSC Ref-Seq v1.0 annotation), TBLASTX比对中国春参考基因组CDS数据库(IWGSC RefSeq v1.0 annotation)和矮抗58参考基因组的CDS数据库(中国农业科学研究院作物科学研究所赵光耀研究员提供), 按照一致性>80%、覆盖度>80%、比对E值<1E-10、序列长度>200 bp进行初筛, 综合比对得分、E值、Gaps和Mismatch选取比对最好的序列作为同源基因, 使用Mapchart v2.3软件[35]绘制图谱, 用InKscape软件进行调整。
以中国春IWGSC.Ref.V1.0包含2000 bp启动子区域和 500 bp 3′-UTR区域在内的基因序列BLASTN比对矮抗 58基因组序列(中国农业科学研究院作物科学研究所赵光耀研究员提供), 获得矮抗58中的同源基因序列, 用 SeqMan软件进行候选基因中国春和矮抗58基因组序列及中国春CDS序列的比对。
使 用 Wheat Expression Browser (http://www.wheat-expression.com/)网站进行B2区间候选基因的表达谱数据调取, 使用的数据集为“Developmental time-course of Chinese Spring”和 “Developmental time-course of Azhurnaya”, 使用TBtools软件进行热图的绘制[36], 用InKscape软件进行美化调整。
2 结果与分析
2.1 ‘六柱头’的短芒主要由细胞的变短所致
为了解析SL-F2群体芒性状差异形成的发育生物学机制, 对 SL-F2:3株系显性纯合和隐性纯合幼穗的芒切片进行了显微镜观察。在长芒材料(图 1-A)和短芒材料(图 1-B)的芒中均有维管束的存在, 短芒材料芒刺较为稀少, 但芒的解剖结构并没有大的差别。由图 1可知, 长芒材料的细胞长度明显大于短芒材料,细胞长度分别为21.49 µm和8.30 µm, 说明SL-F2群体‘六柱头’的短芒性状主要由细胞的变短所致。
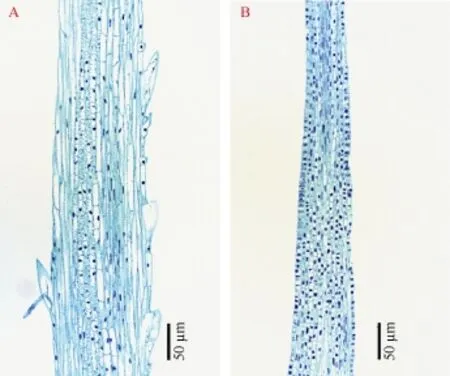
图1 长芒材料(A)和短芒材料(B)芒的石蜡切片Fig. 1 Longitudinal section of middle region in long awn (A)and short awn (B)
2.2 SL-F2群体的短芒性状是由显性单基因控制
短芒亲本‘六柱头’与长芒亲本‘石矮1号’杂交, 杂种F1代全部表现为短芒, F2代(SL-F2)出现芒长的分离(图 2-A), 但只有长芒、短芒 2种类型而没有中间型, 长芒植株穗中部芒长均超过5 cm, 短芒植株穗中部芒长均小于0.5 cm。F2群体共统计1413株, 其中长芒350株, 短芒1063株(表2)。χ2检验表明, 短芒和长芒单株的数量符合3∶1的分离比例(P= 0.84)(表2)。说明, 在SL-F2群体中短芒对长芒为完全显性,‘六柱头’中的短芒性状受显性单基因遗传控制。
2.3 芒长抑制基因B2控制SL-F2群体的芒长性状
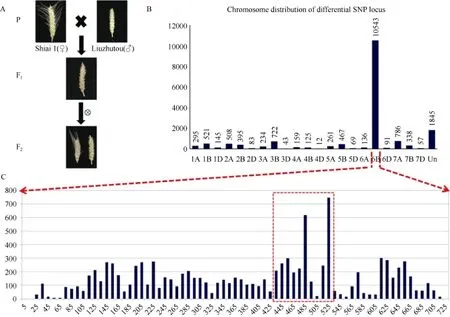
图2 SL-F2群体的构建及Wheat660K芯片分型结果分析Fig. 2 Population construction and analysis of Wheat660K SNP chip

表2 SL-F2群体的遗传分析及卡方检验结果Table 2 Chi-square test and genetic analysis of SL-F2 population
根据短芒纯合、短芒杂合与长芒材料构建的显性混合池、杂合混合池和隐性混合池, 利用Wheat660K芯片进行全基因组SNP分型, 共得到3个混合池间差异 SNP标记 145,915个, 其中显性池及隐性池为纯合基因型且杂合池为杂合基因型的SNP标记有17,835个。在这17,835个差异标记中,59.11% (10,543个)位于6B染色体, 10.34% (1845个)尚未定位, 定位到其他染色体上的均不超过5% (图2-B), 由此推断控制SL-F2群体芒长性状的基因很可能位于6B染色体。对6B染色体的SNP标记以10 Mb为滑窗统计平均每Mb中含有的差异SNP标记数量,发现在430~530 Mb差异SNP最多, 尤其以480 Mb附近及525 Mb附近最为集中(图2-C)。
芒长抑制基因B2定位于6B染色体长臂[15,17-18,29],与Wheat660K芯片SNP分型的富集结果一致, 因此推测SL-F2群体中控制芒长性状的基因可能就是B2基因。为了验证这一推测, 选取96个无芒单株和96个有芒单株组成 SL-F2亚群体, 用前人报道[18]的B2连锁标记Xgwm88、WABM232658、WABM214868进行基因型扫描, 将表型与基因型进行遗传图谱构建,结果表明SL-F2群体芒性控制基因被定位在Xgwm88与WABM232658之间, 标记顺序与前人报道的一致[18]。此外, SL-F2全群体的遗传图谱构建也得到了相同的结果(图3-A)。因此, SL-F2群体中的芒性控制基因应该是前人报道的B2基因。
2.4 芒长抑制基因B2定位在4.84 Mb的物理区间内
通过引物序列比对,Xgwm88和WABM232658分别被定位到中国春参考基因组 IWGSC.Ref.V1.0染色体6B的430.08 Mb和482.79 Mb附近。为了确认初步定位结果并精细定位B2基因, 在中国春参考基因组 6B 染色体 450~451 Mb、465~466 Mb、500~505 Mb及530~531 Mb区间内用SSRLocator软件及内置的Primer 3程序进行SSR搜索与引物设计, 将亲本间及混池间存在差异的 SSR标记SSR43、SSR74、SSR116和SSR122加密到遗传图谱中, 将B2定位在SSR122与WABM232658之间的0.79 cM的遗传区间(图 3-A)。
根据显性池、杂合池和隐性池的Wheat660K全基因组 SNP分型结果, 借助前人根据 Wheat660K SNP芯片开发的CAPS/dCAPS标记[33], 将3个CAPS标记CAPS12、CAPS14、CAPS19和3个dCAPS标记dCAPS4、dCAPS18、dCAPS19加密到遗传图谱。此外, 还通过对亲本‘六柱头’、‘石矮 1号’克隆基因并测序, 开发了3个EST标记EST-499300LC、EST-263300和EST-265400。最终, 这些CAPS标记、dCAPS标记和EST标记被加密到B2区段的遗传图谱中, 标记dCAPS19、dCAPS4、EST-499300LC、CAPS12及CAPS14与B2共分离,B2与标记dCAPS18和dCAPS39之间各存在2个重组事件(图3-C), 重组单株的表型通过F2:3的芒性状分离情况得到了确认。最终,B2被定位于dCAPS18和dCAPS39之间0.29 cM的遗传区间(图3-A), 对应于IWGSC.Ref.V1.0参考基因组6B染色体4.84 Mb的物理距离(图3-B, C)。
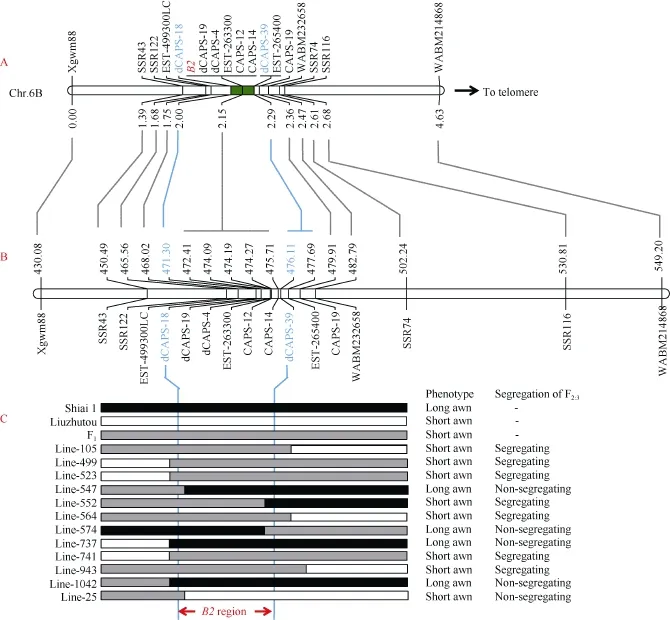
图3 B2基因的精细定位Fig. 3 Fine mapping of awn inhibiting gene B2
2.5 B2区间分析与候选基因预测
根据中国春参考基因组注释, 在B2区间内共有61个基因(图5), 其中包括30个高可信度基因和31个低可信度基因。这些基因主要为酶类(如 E3泛素蛋白质连接酶、类受体激酶)、转录因子(如碱性螺旋-环-螺旋 bHLH转录因子、乙烯响应转录因子)、调节蛋白(如 pH响应调节蛋白、细胞壁松弛蛋白及含钙依赖脂质结合蛋白)及反转录转座子蛋白等。
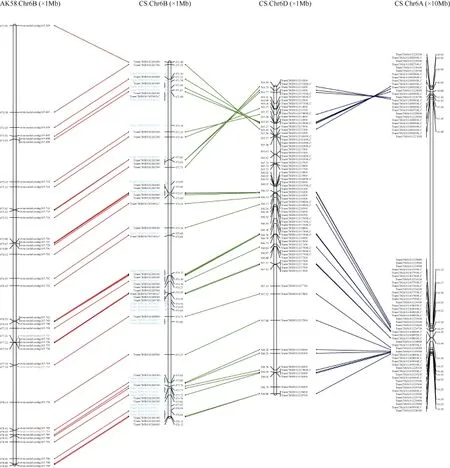
图4 B2区段的基因微共线性分析Fig. 4 Micro-collinearity analysis of B2 region
为了评估B2区间的序列保守程度, 对中国春B2区间基因A、B、D亚基因组同源基因及矮抗58基因组6B染色体的微共线性进行分析(图4)。中国春B2区段4.84 Mb (471.28~476.12 Mb)的物理区间对应于矮抗58中6B染色体长臂上5.99 Mb (472.90~478.89 Mb)的物理距离, 除位于边界的基因evm.model.contig105.687外, 矮抗 58基因组B2区间的大小为4.81 Mb, 与中国春B2区间基本一致。中国春所有高可信度基因以及 4个低可信度基因在矮抗 58中存在同源基因, 其他 27个低可信度基因在矮抗 58不存在基因注释, 而矮抗 58在B2区段共注释出 35个基因, 除 3个基因(evm.model.contig105.755、evm.model.contig105.766和evm.model.contig105.784)外均在中国春中找到同源基因, 这些基因排列顺序均一致, 表明2个基因组在B2区段的共线性关系很好(图4)。此外,B2区段在中国春A、B、D亚基因组的共线性表现为6B区段473.07~476.12 Mb在3个亚基因组间基因顺序一致,6B区段471.28~472.71 Mb与6A染色体基因顺序一致,而与6D染色体区段之间存在倒位, 在6A染色体上两个区段间存在这一个约40 Mb的大片段插入(图4)。
中国春含有芒长抑制基因B2[15,17-18], 而矮抗58是长芒品种, 比较这 2个品种定位区段内基因序列的差别有助于确定候选基因。序列比对结果表明, 在这61个基因中, 有13个基因在中国春和矮抗58基因组间不存在序列差异, 12个基因仅仅在启动子区或3′-UTR区存在序列变异, 6个基因在内含子区存在序列变异而外显子序列无差异, 30个基因的外显子存在序列差异导致编码氨基酸的改变, 其中 4个基因出现移码突变(TraesCS6B01G503600LC、TraesCS6B01G503700LC、TraesCS6B01G263100和TraesCS6B01G505300LC)。
同时, 对中国春(含有芒长抑制基因B2B2)和长芒材料 Azhurnaya (基因型b2b2)的表达谱数据(http://www.wheat-expression.com/)进行分析。通过计算穗部表达量相对于各时期根、茎、叶和籽粒表达量平均值的 Fold-Change, 按照 Fold-Change(TPMSpike/TPMMean(Leaf,Root,Grain)) ≥ 2 (即穗部表达量是各时期根、茎、叶和籽粒表达量平均值的 4倍或4倍以上)为条件进行筛选, 共得到 5个基因(TraesCS6B02G262200,TraesCS6B02G505000LC、TraesCS6B02G505100LC、TraesCS6B02G264400和TraesCS6B02G264600)(图 5), 其中, 中国春和Azhurnaya之间仅有TraesCS6B02G264400在幼穗中的表达量差异达到Fold-Change ≥ 2的阈值(5.32-fold)。
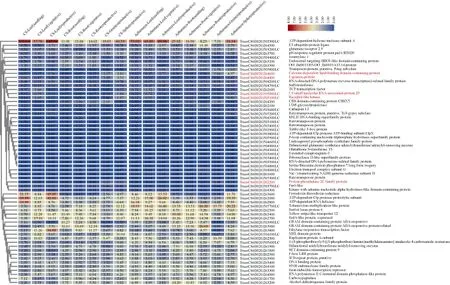
图5 中国春B2区间基因注释与表达谱分析Fig. 5 Annotation and expression profiling of genes in B2 region
3 讨论
芒是禾本科作物中典型的形态特征之一, 也是一种重要的驯化性状。在自然驯化阶段, 芒可以使种子粘在动物的皮毛上借助动物的运动迅速传播;种子从母体脱离并下落的过程中, 芒能起平衡作用,使其胚一端先着地并埋入土壤, 有利于种子萌发;芒的吸湿作用可以推动种子入土进行“自我掩埋”,芒剌还能够提供根扎入泥土中的反作用力, 有利于幼苗的成活[14,37-39]。然而, 进入人工驯化阶段, 芒的存在不利于人们的收获、储存等农业活动, 作为一个驯化靶点承受了较大的选择压[37-38]。大麦和小麦的芒具有相似的解剖结构, 如三角形的横截面, 包含两个绿色细胞的区域和三个维管束, 芒表面具有气孔, 可以进行光合作用和蒸腾作用, 大麦和小麦的长芒是它们对干旱环境条件的适应, 有芒品种具有一定的产量优势。麦芒对产量的作用主要体现在:(1)芒可进行光合作用, 尤其是在植株发育的后期,叶片光合速率迅速下降时芒的光合速率仍能保持相对稳定, 可作为叶片光合作用的重要补充; (2)芒着生在植株的冠层顶部, 通风透光条件良好, 且同化产物就近向籽粒运输; (3)芒可以进行蒸腾作用, 且在干旱条件下, 芒的光合速率能保持相对稳定;(4)芒具有一定的机械强度, 可以减少因碰撞引起的落粒; (5)芒的存在可以减少鸟类啄食和一些病虫的滋生。
在水稻和大麦中, 已有多个控制芒发育的基因被克隆, 小麦中功能基因的定位与克隆工作受限于参考基因组而进展缓慢。随着小麦参考基因组数据的完善、TILLING突变体库的释放和RNA-seq等高通量测序技术的发展, 小麦重要功能基因的定位和功能研究即将迎来一个黄金期。自集群分离分析方法(Bulked Segregant Analysis, BSA)被提出进行遗传学研究来[40], 该策略被广泛用于筛选与目标性状或基因连锁的分子标记, 进行基因或QTL的快速定位,并已开发出BSA-seq、BSR-seq、MutMap等基因快速克隆方法[41-44]。本研究探讨了一种基于小麦高密度基因芯片的极端集群分析法(BSA+CHIP)对芒长抑制基因B2进行快速定位。首先, 选择极端个体构建混池进行芯片分型, 分析差异SNP标记将基因定位到目标染色体较小的染色体区段; 再根据SNP分型结果, 针对性地筛选差异SNP, 借助CAPS/dCAPS Designer工具[33]开发CAPS或dCAPS标记对候选区段进行验证和精细定位。理论上, 遗传定位群体只要有足够的重组事件, 采用这种方式便可以在短期内将基因定位到Mb水平。混池所用的群体类型、混池个体数目、目的基因染色体区域的重组频率均对芯片分型的初步定位精度有着较大影响。为提高芯片分型定位效率, 可优先选用多代自交衍生F2群体或近等基因系, 使用2个或2个以上群体进行芯片分型以互相参考降低噪音干扰。在定位过程中, 可结合使用SSR标记验证区间和初步定位以降低成本, 在重组单株较少的精细定位阶段, 选择差异SNP有针对性地开发标记以进行快速定位。
通过SNP芯片分型及精细定位,B2基因被定位到了6B染色体上0.29 cM的遗传区间, 对应着IWGSC.Ref.V1.0参考基因组4.84 Mb的物理距离。在该区间内, 共注释有61个基因, 其中TraesCS6B02G504500LC编码一个碱性螺旋-环-螺旋类的bHLH转录因子, 其拟南芥同源基因AtbHLH137是GA信号传导途径关键基因REPRESSOR OF GIBBERELLIC ACID INSENSITIVE3(RGA, 赤霉素不敏感阻遏子)的下游靶基因[45], 可能参与GA介导的发育过程调控。此外, 水稻An-1也编码一个bHLH转录因子, 调控芒的发育、籽粒大小和穗粒数[19]。该基因CDS区在中国春和矮抗58基因组之间存在一个SNP, 此SNP也存在于亲本‘石矮1号’与‘六柱头’之间, 它引起编码蛋白在bHLH的转角处一个氨基酸的替换, 可能导致蛋白质二级结构的改变;TraesCS6B02G262600编码TCP类转录因子, 该类转录因子是一类植物特有蛋白, 含有保守的TCP结构域。TCP转录因子广泛参与调控植物的生长发育过程(如分枝、株高、叶型、花型等)和植物逆境胁迫应答(如低温和高盐)[46-48]。TCP蛋白参与多种信号转导途径(如油菜素内酯、茉莉酸、赤霉素、细胞分裂素等), 可能是连接生长发育和介导胁迫响应的一个交叉点; 基因TraesCS6B01G264600编码一个钙依赖脂质结合蛋白, 可能与钙离子通道及细胞周期相关,表达谱分析表明其在中国春和Azhurnaya的幼穗中特异表达(相对其他组织分别为8.89-Fold和9.27-Fold); 基因TraesCS6B01G264400是一个细胞壁松弛蛋白, 它是一种能使植物细胞壁松弛的非酶类细胞壁糖蛋白, 普遍存在于发育中的植物组织和成熟的果实之中。该基因在中国春的幼穗中特异表达(相对其他组织4.88-Fold), 相比Azhurnaya的幼穗, 其在中国春幼穗中的表达量显著上调(5.32-Fold), 和矮抗58相比, 中国春中该基因在外显子、内含子和启动子区均存在大量SNP。因此, 在定位的4.84 MbB2物理区间内, 含有若干可能的候选基因, 上述基因都有可能参与芒的发育调控, 要明确具体哪个基因导致‘六柱头’短芒的表型, 还需进一步的精细定位与更深入的功能研究。
4 结论
利用‘六柱头’与‘石矮1号’构建的F2群体,探讨了一种基于高密度 SNP芯片的极端集群分析(BSA+CHIP)进行小麦基因快速定位的方法, 并首次将小麦中控制芒长的基因进行了精细定位。‘六柱头’的短芒主要是由细胞长度变短引起, 由显性单基因B2控制, 其被定位到6B染色体4.84 Mb的物理区间内, 该区段在中国春与矮抗58间具有良好的共线性。在B2定位区间共有61个基因, 通过表达谱分析与序列分析, 鉴定了几个可能的候选基因。
