棉花黄萎病菌鸟氨酸脱羧酶抗酶蛋白基因VdOAZ的功能分析
2019-04-10宋雯王春巧俞燕高峰黄家风
宋雯,王春巧,俞燕,高峰,黄家风
(石河子大学农学院/ 新疆绿洲农业病虫害治理与植保资源利用重点实验室,新疆石河子832003)
棉花黄萎病对棉花生产造成严重危害,在发病严重的地区可造成棉花减产30%以上,是影响中国棉花生产的主要病害之一[1]。在中国,该病是由土传真菌大丽轮枝菌 (Verticillium dahliaeKleb.)引起的维管束病害。棉花黄萎病菌产生的微菌核抗逆性强,可在土壤中存活10年以上[2],常年连作导致棉花黄萎病发生日趋严重;由于缺乏有效的防治药剂和抗病品种,该病害防治已是生产上的重要难题。因此,尽快从分子水平深入解析大丽轮枝菌的致病机制,找到调控致病机制中的关键因子,对棉花抗病分子育种和探索新型防治方法具有重要的理论价值。
近年有关大丽轮枝菌功能基因组研究取得了较大发展,有些基因是大丽轮枝菌致病所必需的基因,如噻唑合成基因VdThi4[3]、维生素B1 运输基因VdThit[4]、内切葡聚糖酶基因VdEG-1[5]和与侵染钉形成相关的基因VdNoxB、VdPls1[6],它们的敲除均使大丽轮枝菌丧失致病力。有些基因虽然不是致病所必需的基因,但是将其敲除后明显减弱大丽轮枝菌的致病力,如葡萄糖阻遏蛋白基因VdCYC8[7]、编码富含谷氨酸蛋白的基因VdGARP1[8]、蔗糖非发酵激酶基因VdSNF1[9]和尿嘧啶DNA 糖基化酶基因VdUDG[10]。有些基因编码效应子蛋白通过影响植物免疫参与致病,如Ave1 基因编码的蛋白诱导含Ve1 基因的番茄产生抗性,在不含Ve1 基因的番茄上却是主要的致病因子[11];效应蛋白Vdlsc1 通过干扰寄主植物的水杨酸代谢,抑制水杨酸介导的防卫反应,协助病原菌侵染寄主[12];VdNLP1、VdNLP2[13-14]和Vd-CUT11[15]基因编码的蛋白诱导植物免疫引起细胞死亡。有些基因通过信号途径参与大丽轮枝菌致病,如丝裂原活化蛋白激酶基因VMK1[16]、跨膜粘蛋白基因VdMSb[17]、高渗透激活蛋白激酶基因VdHog1[18]和编码产物具有4 个跨膜功能域的VdSho1 基因[19]通过丝裂原活化蛋白激酶(Mitogen-activatedproteinkinase,MAPK)信号途径影响大丽轮枝菌致病;VdPKAC1 和VGB基因分别通过环腺苷酸 (Cyclic adenosine monophosphate,cAMP) 依赖信号途径和G 蛋白信号途径对大丽轮枝菌的致病力起正向调控作用[20-21];聚酮合酶基因VdPKS1 通过黑色素合成途径影响致病[22]。还有一些基因通过编码转录因子参与大丽轮枝菌的致病过程,如VdSge1 基因编码的转录调节因子不仅调节其他效应子基因的表达,而且是大丽轮枝菌产孢和致病所必需的因素[23-24];转录因子基因Vdpf[25]、VdMcm1[26]、VdCrz1[27]和VdFTF1[28],除了对大丽轮枝菌的毒力起正向调控作用外,还分别参与调控微菌核形成、黑色素合成相关基因和植物细胞壁降解酶基因的表达。综上所述,大丽轮枝菌的致病机制复杂,所有这些基因在真菌发育和致病过程中的相互作用仍有待深入研究。
多胺包括腐胺、亚精胺(Spermidine,Spd)和精胺,是广泛存在于细胞内的低分子量、聚阳离子、具有生物活性的脂肪族含氮碱,在基因表达、胚胎发育、细胞分化以及响应非生物胁迫等方面有重要作用[29]。细胞内多胺水平的稳定主要受鸟氨酸脱羧酶(Ornithine decarboxylase,ODC)和鸟氨酸脱羧酶抗酶蛋白(Ornithine decarboxylase antizyme,OAZ)严格调控[30]。ODC 是以磷酸吡哆醛为辅基的氨基酸脱羧酶,是多胺合成途径中的第1 个限速酶,催化L-鸟氨酸脱羧生成腐胺,腐胺再经过一些催化作用生成精脒和精胺[31]。它对多胺的合成起极其重要的作用。OAZ 在翻译后可以连接到ODC 上,抑制ODC 的催化活性,并靶向地促使26S 蛋白酶降解ODC,从而负向调控细胞内的多胺含量[32]。OAZ 都具有保守的ODC-AZ结构域,将编码这类蛋白的同源基因命名为OAZ基因。OAZ基因具有2 个开放阅读框(ORF1 和ORF2),ORF2 的表达以核糖体移码的翻译机制翻译蛋白,当细胞中存在过高浓度的多胺时,诱导核糖体+1 移码,跳过ORF1 终止子中的T 碱基,继续翻译,表达具有抗酶蛋白功能的OAZ,OAZ 又反过来降低胞内多胺的浓度,从而使细胞内的多胺浓度维持在稳定水平[33]。
本实验室前期研究发现,利用棉花根系分泌物诱导培养导致棉花黄萎病菌鸟氨酸脱羧酶抗酶蛋白基因(VdOAZ)明显上调表达。因此,本研究将该基因从大丽轮枝菌野生型菌株V592 中敲除,通过生物学特性和致病力测定及致病相关的其他基因在敲除突变体和V592 中的表达分析,以及Spd 诱导条件下,测定V592 菌株中VdOAZ基因及致病相关的其他基因的相对表达量,初步明确VdOAZ基因对大丽轮枝菌的毒力、 微菌核的形成及分生孢子产生的影响,并能响应Spd 水平的变化。
1 材料与方法
1.1 供试菌株及载体
本研究所用的大丽轮枝菌野生型菌株V592[8]来自于棉花,属于落叶型强致病力菌株,由本实验室分离、鉴定并保存。克隆载体pMD19-T 购自宝生物TaKaRa 公司。敲除载体pGKO-HPT 由郭惠珊研究员惠赠,该载体携带单纯疱疹病毒胸苷激酶(Herpes simplex virus thymidine kinase)基因HSVtk作为负向筛选标记。用于基因互补的载体p1300-Neo-oLiC-Cas9-TtrpC,包括oLiC 启动子和TtrpC 终止子,由本实验室构建并保存。
1.2 VdOAZ 基因的克隆及测序
将V592 菌株在马铃薯葡萄糖琼脂培养基(Potato dextrose agar medium,PDA 培养基)上活化并培养菌株7 d,并按照Biospin Fungus Genomic DNA Extraction Kit(BioFlux)提取试剂盒说明书的方法提取菌株DNA。将V592 菌株在Czapek-Dox 液体培养基中培养3 d,离心并收集沉淀,按照Trizol(QIAGEN)法分别提取菌株的总RNA。并用PrimeScript RT Enzyme Mix Ⅰ(TaKaRa)进行cDNA 合成。根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI) 中公布的大丽轮枝菌全基因组(V.dahliaeVdLs.17)数据库的基因信息,检索到OAZ基因VDAG_00022 的序列,根据该序列设计引物VdOAZfull-F (5'-ATGTCGCCCATGAAAAACAACAATAATC-3') 和VdOAZfull-R(5'-CTACAGCTCCATGCCCATGAA G-3')。分别从V592 菌株的基因组DNA 和cDNA 中经聚合酶链式反应(Polymerase chain reaction,PCR)扩增OAZ基因的全长,克隆测序并命名为VdOAZ。
1.3 载体构建和真菌转化
利用基因同源重组原理,用潮霉素抗性基因(HPH)取代VdOAZ基因的1 006 bp 片段。使用I-5TM2×High-Fidelity Master Mix 高保真DNA 聚合酶 (TsingKe) 进行PCR 扩增,先用引物VdOAZ-up-F(5'-CTTGCTGAGGTCTTAATTAAGGGTCATGTCACTCCGT-3') 和VdOAZ-up-R(5'-AGTGCTGAGGCATTAATTAATTCATTTTCCATTCGTCCCA-3') 从V592 基因组中扩增VdOAZ基因上游842 bp 的DNA 片段;再用引物VdOAZ-down-F(5'-CCCGCTGAGGACTTAATTAATTCCTGGGGGTCGAGTT-3')和VdOAZ-down-R(5'-CTCGCTGAGGGTTTAATTAACGTGGCAATTACCTACACA-3') 从V592 基因组中扩增VdOAZ基因下游793 bp 的DNA 片段。用PacⅠ限制性核酸内切酶将载体pGKO-HPT 酶切线性化,将目标基因的2 个同源臂和线性化载体通过ClonExpress MultiS One Step Cloning Kit(Vazyme)进行重组,构建敲除载体pGKO-HPT∷VdOAZ。将构建成功的敲除载体通过农杆菌介导的遗传转化(Agrobacterium tumefaciens-mediated transformation,ATMT)方法转化V592 菌株的分生孢子。转化子的筛选先用Wang 等[34]的PCR 方法进行初步筛选,再分别用检测HPH基因的引物Hph588U (5'-AGCTGCGCCGATG-GTTTCTACAA-3')和Hph588L(5'-GCGCGTCTGCTGCTCCATACAA-3')和检测VdOAZ基因的引物VdOAZfull-F、VdOAZfull-R 对转化子进行二次筛选,目标基因VdOAZ被HPH基因取代的转化子(敲除突变体)只能扩增到HPH基因片段,不能扩增到VdOAZ基因的目标条带。
为了构建VdOAZ基因的互补载体,用引物inEC-OAZ-F(5'-ACAATCGATCCAACCTCTAGAATGTCGCCCATGAAAAACAACA-3')和inECOAZ-R(5'-TTAAGTGCGGCCGCTGGATCCCTACAGCTCCATGCCCATGAA-3')从野生型V592基因组DNA 中扩增VdOAZ基因全长。然后该将基因全长连接到用XbaⅠ/BamHⅠ酶切线性化的p1300-Neo-oLiC-Cas9-TtrpC 载体中。然后通过ATMT 方法将该载体转化至VdOAZ基因的敲除突变体中。转化子通过G418 抗生素和PCR 方法进行筛选。最后,使用引物VdOAZ-qPCR-F ( 5'-CCTGGCTCGAGATCTGGGATTT-3')和VdOAZ-qPCR-R(5'-AACGTTGCCATCGAAGAATACGAACA-3'),通过实时荧光定量逆转录PCR(Reverse transcription-quantitative real time PCR,RT-qPCR)对目标基因VdOAZ在野生型菌株、 敲除突变体菌株和互补菌株中的转录水平进行测定,对目标基因的敲除和互补进行再次确定。
1.4 RT-qPCR分析
VdOAZ基因在野生型菌株V592、VdOAZ敲除突变体和互补菌株中的转录水平,大丽轮枝菌VdPKAC1(VDAG_06474.1)[20]、VMK1(VDAG_09461.1)[16]、VdNLP1(VDAG_04701.1)[14]、VdNLP2(VDAG_01995.1)[14]、VdCYC8(VDAG_07052)[7]、VGB(JQ665433.1)[21]、VdSge1(VDAG_06298.1)[23-24]、VdHog1(VDAG_08982)[18]、VDH1(VDAG_02273.1)[35]基因在野生型菌株V592、VdOAZ敲除突变体和互补菌株中的转录水平,以及在1 mmol·L-1Spd 诱导4 h 后VdOAZ、VdPKAC1[20]、VMK1[16]、VdNLP1[14]、VdNLP2[14]、VdSge1[23-24]、VDH1[35]基因在野生型菌株V592 中的转录水平,均通过RT-qPCR 进行测定。根据方法1.2,提取各菌株的总RNA,并合成cDNA,然后按照PowerUp SYBR Green Master Mix(Life Technologies)试剂盒说明添加样品,PCR 反应在7500 Real Time PCR System(Life Technologies)中进行。针对不同基因设计相应的特异性引物(表1),以β-tubulin基因(DQ266153)作为内参基因。每个反应设3 个重复。试验数据采用SPSS 17.0 软件进行统计分析。

表1 供试引物Table 1 Primers used in this study
1.5 真菌表型特征的测定
菌落生长速率的测定:以野生型菌株V592为对照,取直径5 mm 的菌块接种于PDA 培养基中央,26 ℃黑暗培养。接种后的第5 天和第15天,分别测量每个菌株的菌落直径,计算菌落的平均生长速率;并在接种后第15 天,拍照记录菌落形态,每个菌株设5 个重复。
产孢量的测定:以野生型菌株V592 为对照,将1 mL 含量为1.0×106mL-1的分生孢子悬浮液加入到100 mL Czapek-Dox 液体培养基中,26 ℃、200 r·min-1培养7 d,以24 h 的间隔计数分生孢子的数量,每个菌株设6 个重复。
微菌核量的测定:以野生型菌株V592 为对照,在PDA 培养基上铺1 层玻璃纸,取300 μL含量为1.0×107mL-1的分生孢子悬浮液涂布在玻璃纸上,26 ℃黑暗培养14 d,观察微菌核形成情况[8];将玻璃纸上的微菌核刮下,置于称量纸上称量,得到微菌核的鲜质量;然后将其室温下静置48 h,称量干质量。每个菌株设置3 个重复。
1.6 致病力测定
选取棉花感病品种“军棉1 号”用于致病力测定。将棉苗在MS 液体培养基中培养至3~4片真叶展开时采用无伤浸根接种法进行接种[8],分别以野生型菌株V592 和无菌水为阳性和阴性对照。病害分为4 个等级:1%~25%的叶片表现萎蔫症状为1 级,26%~50%的叶片表现萎蔫症状为2 级,51%~75%的叶片表现萎蔫症状为3级,76%~100%的叶片表现萎蔫症状为4 级。病情指数(DI)的计算公式=[Σ(各病级株数×相应病级)/ 调查总株数×最高病级(4)]×100。植株发病后每2 d 统计1 次病情指数,每个菌株接种3 个营养钵,每个营养钵12 棵棉苗。
1.7 感病棉株中真菌生物量测定
为了明确VdOAZ基因对大丽轮枝菌侵染及定植能力的影响,对接种了野生型菌株V592、VdOAZ基因敲除突变体和互补菌株的棉株,通过qPCR 进行真菌生物量测定。接种后26 d,取棉花的根(红茎线以下取根5 cm)、茎(棉苗一半株高处取茎5 cm)、叶,分别提取根、茎、叶的总DNA。qPCR 所用引物 [转录间隔区(Internal transcribed spacer,ITS)-F(5'-TGTTGCTTCGGCGGCTCGTT-3')和ITS-R(5'-GCGTTTCGCTGCGTTCTTCA-3')] 是基于大丽轮枝菌核糖体RNA(Z29511)的ITS1 和ITS2 区设计的。以组成型表达的β-tubulin基因(DQ266153)作为内参基因,对每个样品的总DNA 进行标准化定量。每个反应设3 个重复。
2 结果与分析
2.1 VdOAZ 基因的克隆与序列分析
通过克隆测序得到VdOAZ基因全长为1 006 bp,预测编码蛋白的cDNA 序列为798 bp。对2 次测序结果进行序列分析,结果表明VdOAZ基因由3 个外显子和2 个内含子组成,外显子分别位于9~161、268~704 和799~1 006位核苷酸,内含子分别位于162~267 位核苷酸和705~798 位核苷酸。VdOAZ基因通过2 个开放阅读框(Open reading frame,ORF)编码蛋白,ORF1 长度为312 bp,编码103 个氨基酸残基;ORF2 长度为798 bp,通过核糖体在第425 位T碱基+1 移码形成,编码的蛋白含有265 个氨基酸,具有OAZ 所特有的ODC-AZ 保守结构域,因此只有ORF2 才编码形成VdOAZ 蛋白。VdOAZ基因与大丽轮枝菌 VdLs.17 的VDAG_00022 基因核苷酸序列相似性为97.9%,VdOAZ 蛋白与大丽轮枝菌 VdLs.17 中VDAG_00022 所编码的氨基酸序列相似性为98.1%,与其他真菌OAZ 也具有一定的氨基酸序列相似性,与碱菌(Sodiomyces alkalinus)的序列相似性为48.0%,与镰刀菌(Fusarium langsethiae)的序列相似性为43.5%。
2.2 VdOAZ 基因的敲除与互补验证结果
利用基因同源重组原理构建了针对VdOAZ基因的敲除载体(图1-A),通过ATMT 法转化大丽轮枝菌分生孢子和PCR 筛选[34],将获得的同源重组转化子,再分别用HPH基因和VdOAZ基因的特异性引物进行二次筛选,结果如图1-B 所示,3 个VdOAZ敲除突变体(vdoaz-1、vdoaz-2 和vdoaz-3) 都能扩增到588 bp 的HPH基因片段,不能扩增到1 006 bp 的VdOAZ基因片段;而野生型菌株V592 只能扩增到预期大小的VdOAZ基因片段。将完整的VdOAZ基因片段转化敲除突变体vdoaz-1,PCR 检测结果(图1-B)显示,2个互补菌株(EC-oaz-1 和EC-oaz-2)均能扩增到预期大小的VdOAZ基因片段。
通过RT-qPCR 对VdOAZ基因在野生型菌株V592、 敲除突变体和互补菌株的表达进行分析,结果(图1-C)显示,VdOAZ基因在vdoaz-1、vdoaz-2 和vdoaz-3 中几乎不表达,而在互补体菌株EC-oaz-1 和EC-oaz-2 中的表达明显恢复到V592 水平,分别达到V592 表达量的102.9%和97.22%。表明VdOAZ基因在vdoaz-1、vdoaz-2 和vdoaz-3 中被成功敲除,在互补菌株EC-oaz-1 和EC-oaz-2 中得到互补。
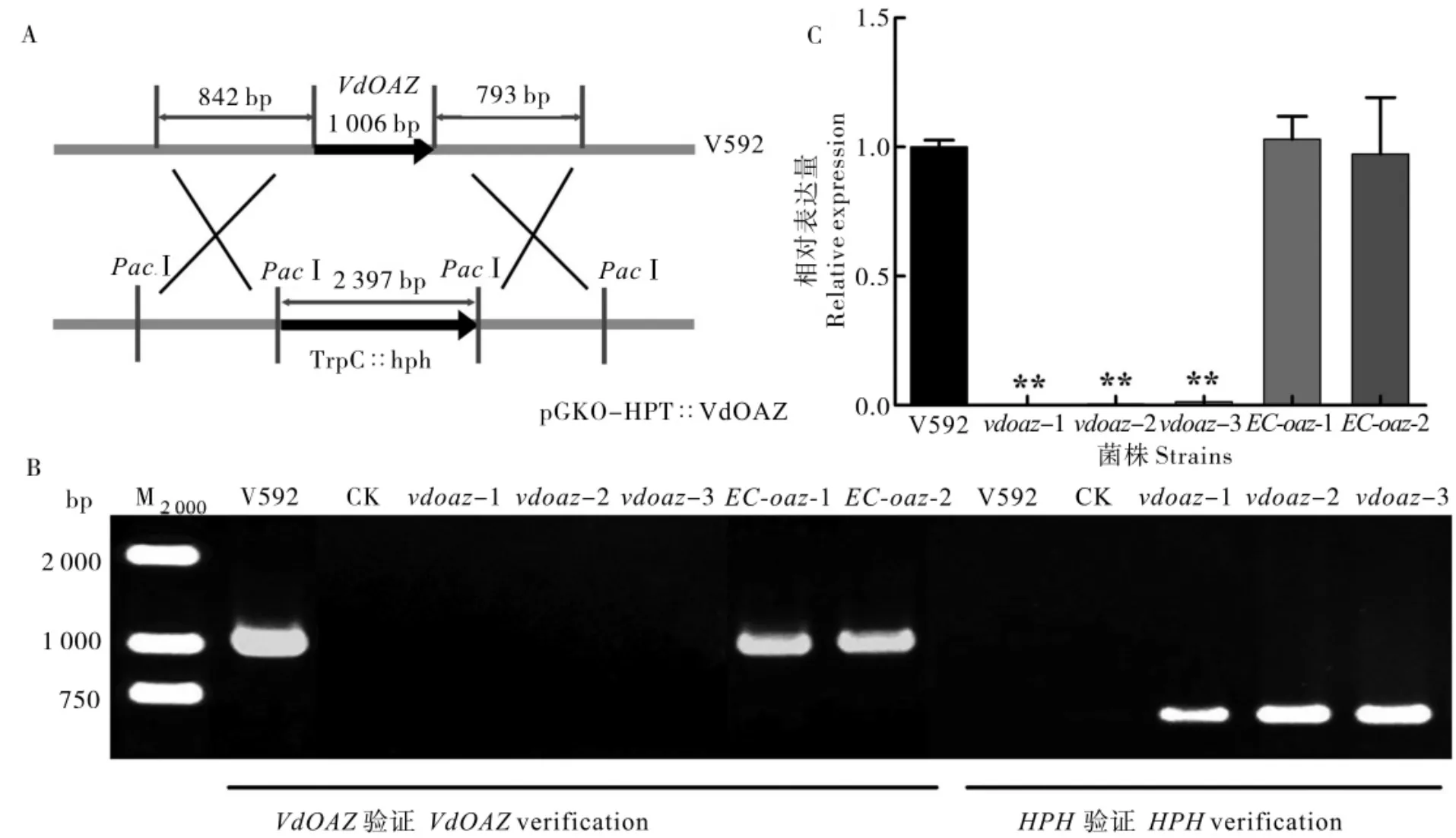
图1 棉花黄萎病菌VdOAZ基因的敲除Fig.1 Deletion of the VdOAZ gene in V.dahliae isolated from cotton
2.3 VdOAZ 基因敲除突变体菌落形态与生长速率
培养性状观察结果显示,3 个VdOAZ敲除突变体的菌落形态与野生型菌株V592 和互补菌株的菌落形态没有明显差异,都形成菌核型菌落(图2),但是3 个VdOAZ敲除突变体的菌落生长速率显著低于V592 和互补菌株(图2,表2),表明VdOAZ基因敲除导致大丽轮枝菌生长减慢。

图2 野生型菌株V592、VdOAZ敲除突变体及互补菌株在PDA培养基上的培养特征Fig.2 Phenotypic characteristics of the wild type strain V592, VdOAZ gene deletion mutants and complementary strains on PDA medium
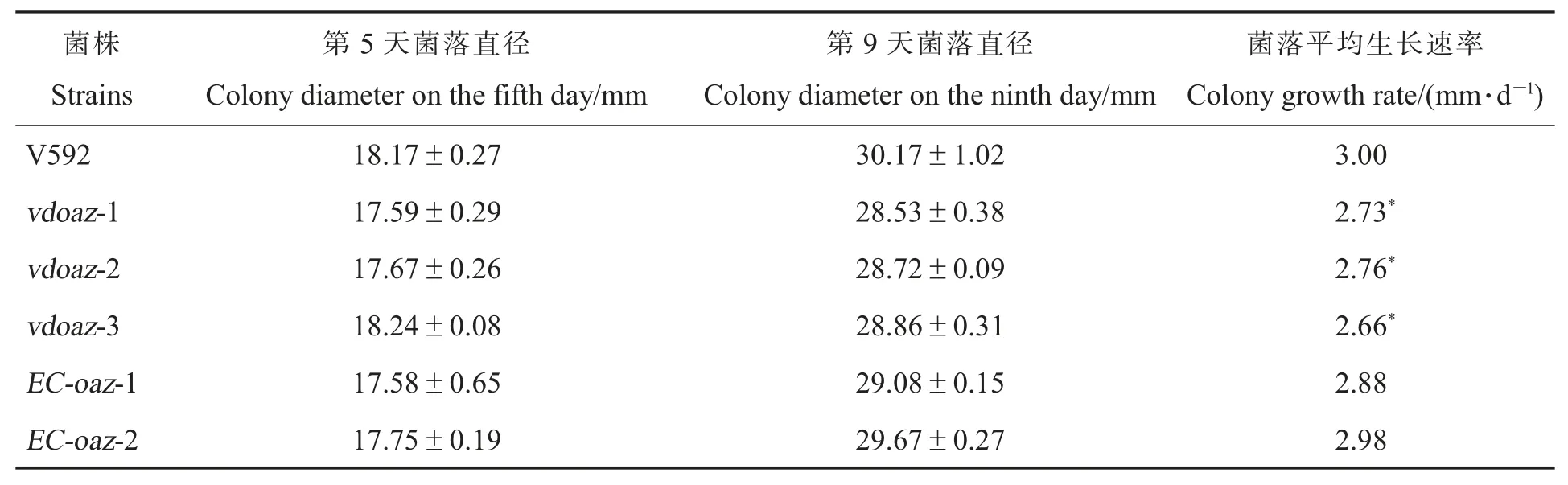
表2 VdOAZ 敲除突变体在PDA 培养基上的菌落生长速率Table 2 Colony growth rate of VdOAZ gene deletion mutants on PDA medium
2.4 VdOAZ 敲除突变体的微菌核产量
图3-A 显示,接种14 d 后,3 个VdOAZ敲除突变体vdoaz-1、vdoaz-2 和vdoaz-3 形成的黑色微菌核明显少于野生型菌株V592 和2 个互补菌株。微菌核鲜质量和干质量结果也显示,3 个VdOAZ敲除突变体形成的微菌核质量极显著低于V592和2 个互补菌株(图3-B)。上述结果表明,VdOAZ基因不是大丽轮枝菌微菌核形成所必需的基因,但是VdOAZ基因敲除明显影响大丽轮枝菌微菌核的产量。
2.5 VdOAZ 敲除突变体的产孢量
产孢量测定结果表明,与野生型菌株V592、互补菌株EC-oaz-1 和EC-oaz-2 相比,敲除突变体vdoaz-1、vdoaz-2 和vdoaz-3 的产孢量显著减少(图4)。在接种第7 天时,敲除突变体vdoaz-1、vdoaz-2 和vdoaz-3 的产孢量仅为 V592 的40.76%、45.65%和57.07%,互补菌株EC-oaz-1 和EC-oaz-2 的产孢量可达到V592 的92.93%和89.67%。结果表明,VdOAZ基因参与分生孢子的产生。
2.6 VdOAZ 敲除突变体的致病力
分别用野生型菌株V592,敲除突变体vdoaz-1、vdoaz-2、vdoaz-3 和互补菌株EC-oaz-1、EC-oaz-2 接种棉花感病品种“军棉1 号”,接种后10 d 时,所有棉花植株开始表现萎蔫症状,表明VdOAZ基因敲除不会对棉花黄萎病的发病有延迟作用。接种后26 d 时,V592 导致感病棉花叶片萎蔫、脱落,甚至全株枯死,病情指数达到94.3;而3 个敲除突变体在感病棉花上引起的病害症状明显减轻,病情指数分别为65.0、68.7 和63.3;2 个互补菌株对棉花的致病力得到恢复,病情指数分别为90.0 和87.3 (图5-A 和5-B);表明VdOAZ基因敲除导致大丽轮枝菌致病力下降。
接种26 d 后,对植株内的真菌生物量进行测定,结果显示,在根组织中,3 个敲除突变体的真菌生物量显著高于野生型菌株V592 和2 个互补菌株(图5-C);而在茎组织中,3 个敲除突变体的真菌生物量又显著低于V592 和2 个互补菌株,表明VdOAZ基因敲除导致大丽轮枝菌在寄主体内的扩展受阻。
2.7 致病相关的其他基因在VdOAZ敲除突变体中的表达
如图6 所示,与野生型菌株V592 相比,VdPKAC1、VMK1、VdNLP1、VdNLP2 和VdSge1 在3个敲除突变体中的相对表达量显著上调,分别是V592 菌株表达量的15.4 倍、14.7 倍、4.5 倍、3.4 倍和6.9 倍;1 个基因(VDH1)在3 个敲除突变体中的相对表达量显著低于V592 中的表达量;3 个基因(VdCYC8、VGB和VdHog1)在3 个敲除突变体中的相对表达量与V592 没有显著差异。由于这些上调或下调表达的基因与大丽轮枝菌的孢子产生、微菌核形成及毒力相关,表明VdOAZ基因在参与大丽轮枝菌的孢子产生、 微菌核形成及致病过程中与这些基因有不同的相互作用。
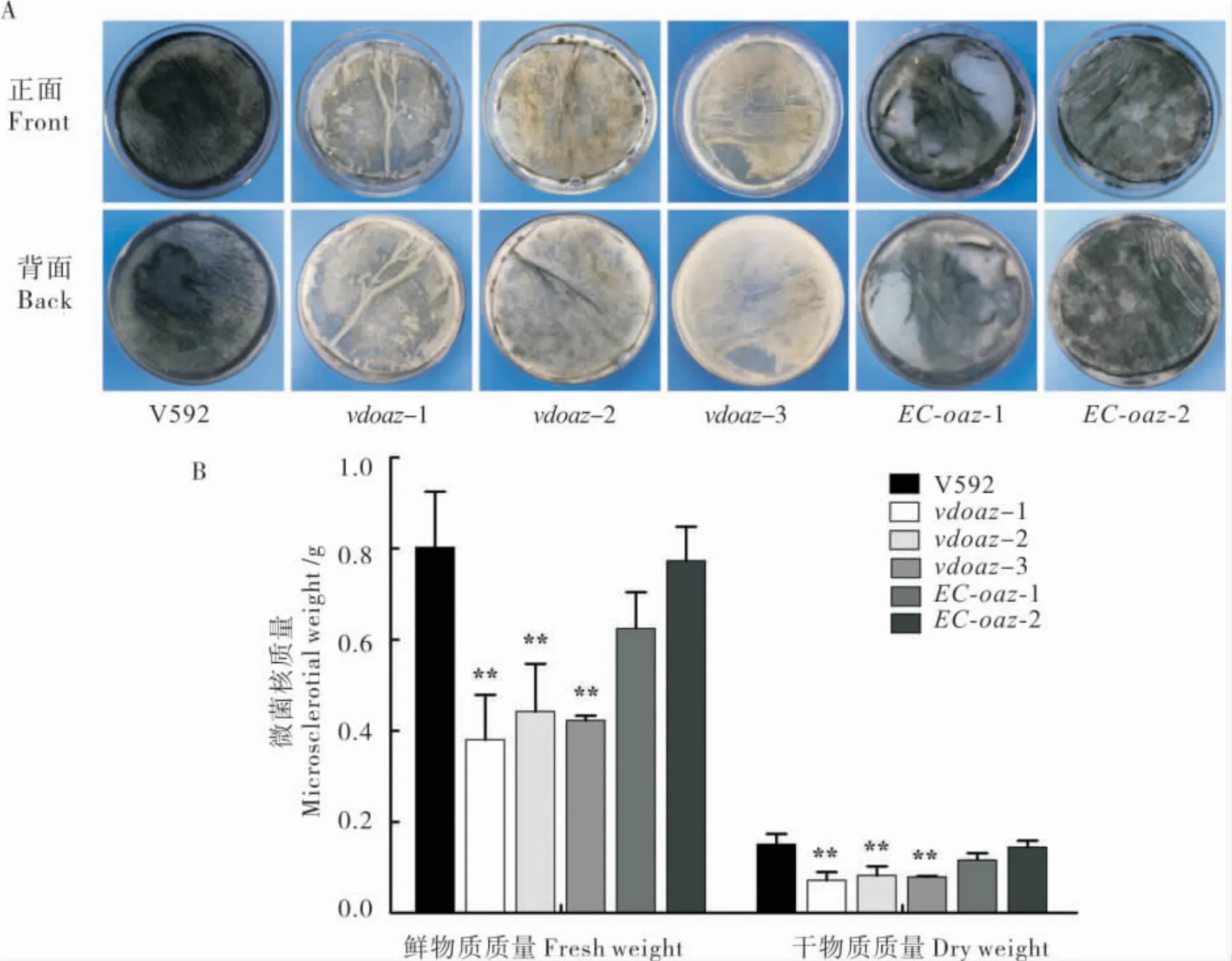
图3 VdOAZ基因敲除体的微菌核产量Fig.3 Microsclerotia production of VdOAZ gene deletion mutants
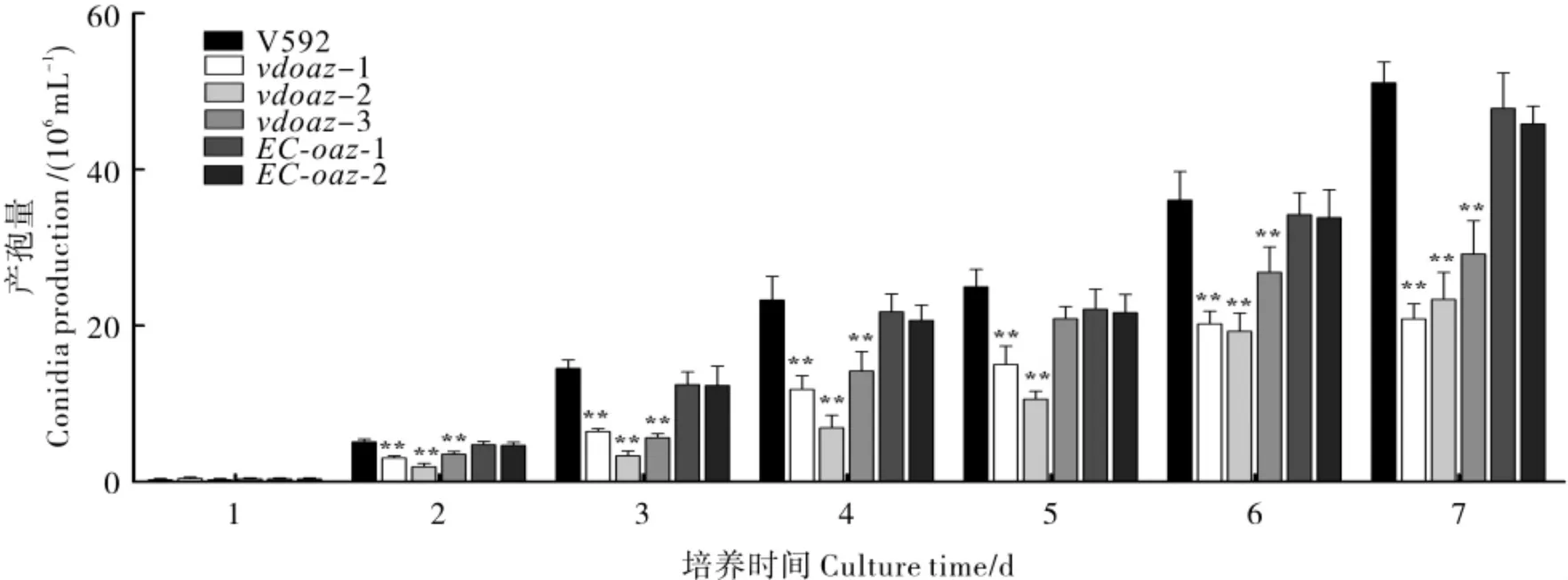
图4 VdOAZ基因敲除突变体产孢量的测定结果Fig.4 Conidia production of VdOAZ gene deletion mutants
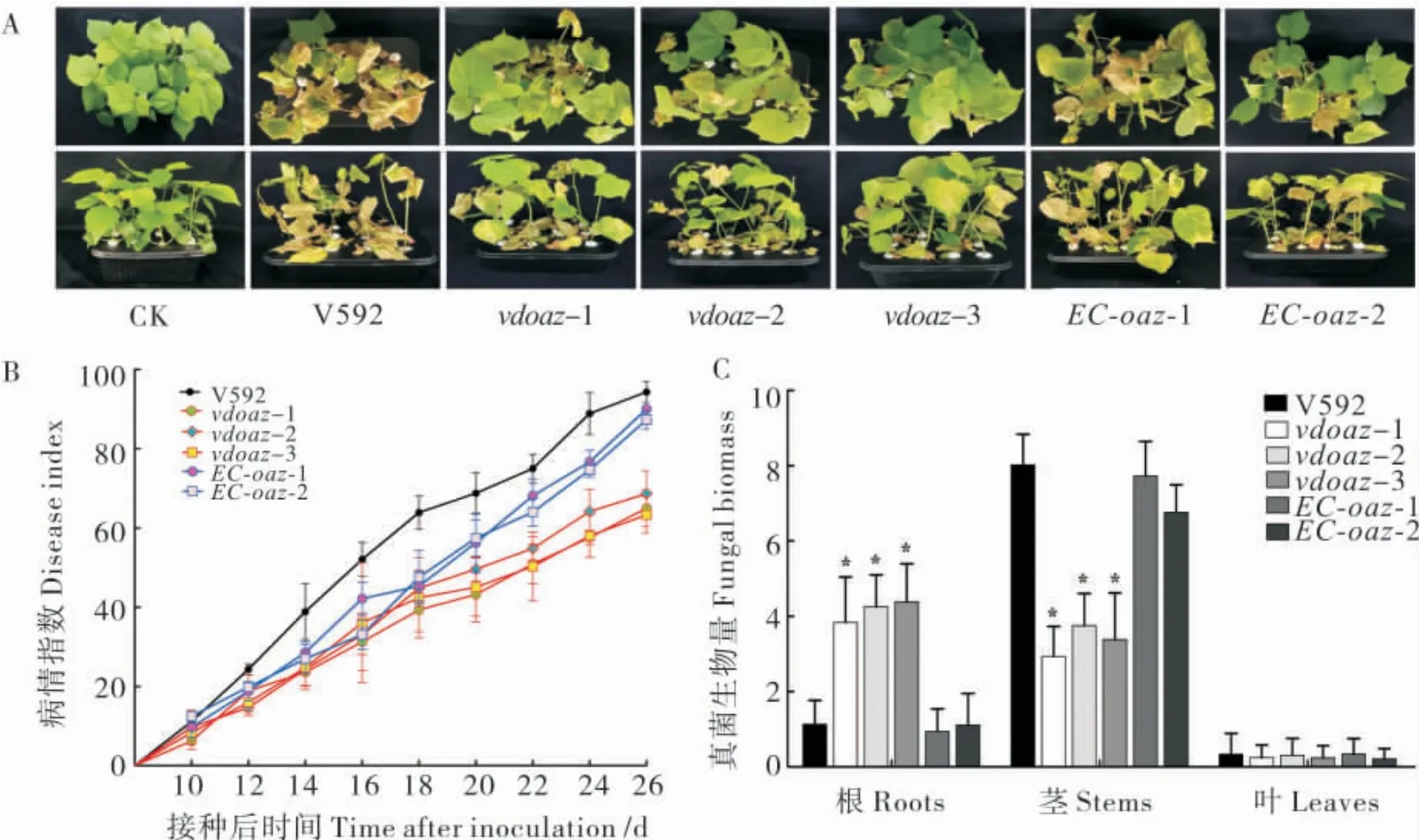
图5 VdOAZ基因敲除突变体对棉花致病力与病株真菌生物量的测定结果Fig.5 Disease severity and fungal biomass in cotton plants infected by the VdOAZ gene deletion mutants
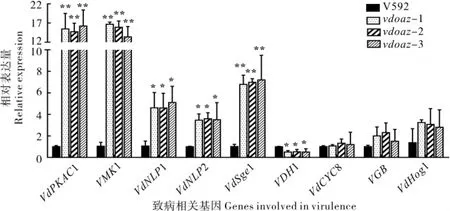
图6 大丽轮枝菌其他致病基因在VdOAZ基因敲除突变体中的相对表达量Fig.6 Relative expression of other genes involved in virulence in V.dahliae in VdOAZ gene deletion mutants
2.8 亚精胺诱导后VdOAZ基因及致病相关的其他基因的表达量
以不被诱导的野生型菌株V592 为对照,上述各基因在Spd 诱导4 h 后的表达情况如图7 所示。V592 经Spd 诱导培养后,VdOAZ基因的相对表达量显著上调了2.6 倍,VDH1 基因的相对表达量有所上调但不显著,而VdPKAC1、VMK1、VdNLP1、VdNLP2、VdSge1 的相对表达量明显下调。表明VdOAZ基因对多胺水平的变化是有响应的;VdOAZ基因对VdPKAC1、VMK1、VdNLP1、VdNLP2 和VdSge1 的表达具有负调控作用,VdOAZ基因及其负调控基因均能响应多胺水平的变化。
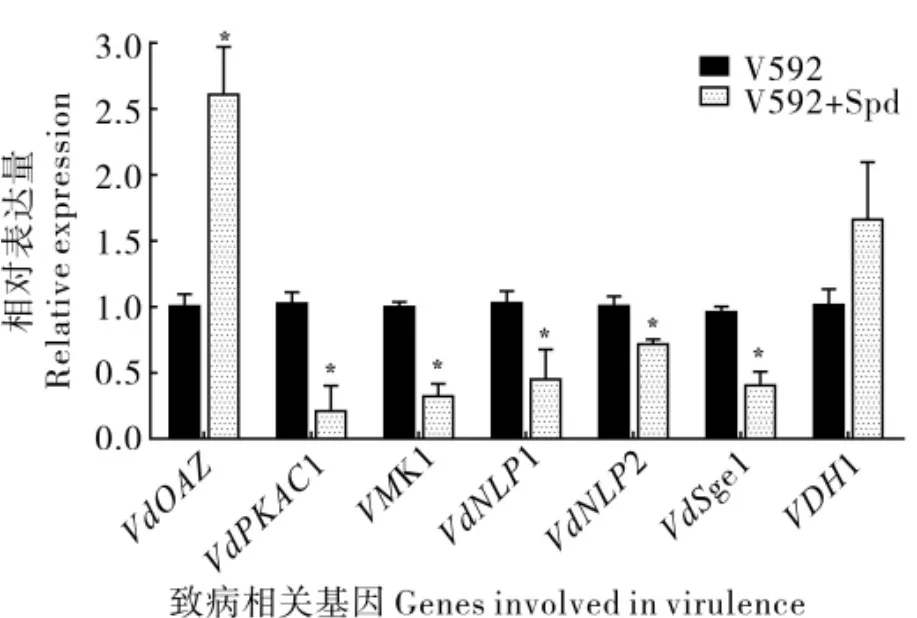
图7 亚精胺诱导4h后VdOAZ和大丽轮枝菌致病相关的其他基因在V592中的相对表达Fig.7 Relative expression of VdOAZ gene and other genes involved in virulence of V.dahliae in V592 induced by spermidine for 4 h
3 讨论
生物体中,当细胞中多胺浓度过高时,为了稳定细胞中多胺水平,OAZ 起负向调控细胞内多胺含量的作用[32]。本研究从棉花黄萎病菌中通过克隆测序得到VdOAZ基因全长,序列分析表明,VdOAZ基因在425~427 位核苷酸有1 个TGA终止密码子,ORF2 的编码只有通过核糖体在425 位T 碱基+1 移码才可以继续翻译蛋白,且只有通过移码翻译的蛋白才具有真核生物OAZ所特有的ODC-AZ 保守结构域,表明ORF2 编码的VdOAZ 蛋白在大丽轮枝菌中可能具有鸟氨酸脱羧酶抗酶蛋白的功能。本研究将V592 菌株经Spd 诱导培养4 h,VdOAZ基因的表达量显著上调,表明VdOAZ基因能对多胺水平变化做出响应,间接证明VdOAZ 蛋白具有鸟氨酸脱羧酶抗酶蛋白的功能。然而莴苣大丽轮枝菌VdLs.17 的同源基因(VDAG_00022)在相同位点不存在终止子,暗示这种移码机制可能只在部分大丽轮枝菌中存在。这需要对不同来源的大丽轮枝菌进行大量测序才能确定。由于目前有关OAZ 的研究主要集中在哺乳动物细胞中,OAZ 在真菌体内是否可以调节多胺水平以及调节机制是否与哺乳动物细胞内的机制一致也需进一步研究。
VdOAZ基因对棉花黄萎病菌生长发育的影响结果表明,VdOAZ基因敲除导致棉花黄萎病菌的菌落生长速率降低、产孢量及微菌核产量下降。通过RT-qPCR 对其他基因在VdOAZ敲除突变体中的转录水平进行测定,VDH1 基因的转录水平明显下调,由于VDH1 基因敲除导致大丽轮枝菌微菌核形成受阻[35],表明VdOAZ基因在VDH1 基因影响微菌核形成的途径中具有正向调控作用。VdPKAC1、VMK1、VdNLP1、VdNLP2和VdSge1 在VdOAZ敲除突变体中的转录水平明显上调,当VdOAZ基因受Spd 诱导表达后,这5 个基因的表达又显著下调,表明VdOAZ基因对这5 个基因的表达具有负调控作用;其中2 个基因VdPKAC1 和VMK1 与大丽轮枝菌的微菌核形成和孢子产生相关,VdPKAC1 基因敲除后,其突变体微菌核产量增加、产孢量减少[20],VMK1基因敲除的突变体微菌核形成和产孢量均减少[16]。由于VdPKAC1[20]和VMK1[16]基因分别是cAMP信号途径和MAPK 信息素调控途径的关键基因,因此VdOAZ基因可能通过这2 个信号途径参与微菌核和分生孢子的形成过程。另外,VdNLP1[13]和VdSge1[24]也与大丽轮枝菌的孢子产生有关,它们的敲除突变体产孢量均明显低于各自的野生型菌株。因此,VdOAZ基因参与大丽轮枝菌的孢子产生过程可能与这2 个基因也有关。
VdOAZ基因敲除导致棉花黄萎病菌致病力显著降低。qPCR 结果表明,VdOAZ敲除突变体在棉花根中的生物量显著高于野生型菌株,但在棉花茎中的生物量却显著低于野生型菌株,表明VdOAZ基因敲除导致大丽轮枝菌由根向茎的扩展受到阻碍,因此推测VdOAZ敲除突变体致病力下降的原因可能与其扩展受阻及茎中的生物量下降有关。另外,在VdOAZ敲除突变体中,转录水平表现明显上调的5 个基因(VdPKAC1、VMK1、VdNLP1、VdNLP2 和VdSge1) 和转录水平表现下调的1 个基因(VDH1)除了与孢子产生和微菌核形成相关外,均是大丽轮枝菌致病相关基因,其中VdSge1 基因敲除导致大丽轮枝菌致病力丧失[23-24],VdPKAC1[20]、VMK1[16]、VdNLP1 和VdNLP2[14]基因敲除导致大丽轮枝菌致病力减弱,表明VdOAZ基因参与的是1 个复杂的调控网络,其中包括cAMP 信号途径、MAPK 信息素调控途径及转录因子调控途径。VdOAZ基因与这些途径和基因共同调节了大丽轮枝菌的产孢、微菌核形成及致病过程,但是这些基因在复杂的调控网络中的相互作用机制还有待深入研究。
已有研究表明,G 蛋白和cAMP 信号途径是相互偶联的,共同调控大丽轮枝菌孢子产生、微菌核形成和致病过程[21]。本研究发现,在VdOAZ敲除突变体中,VdPKAC1 基因[20]的转录水平显著上调,VGB基因[21]的转录水平不受影响,表明VdOAZ基因通过负调控VdPKAC1 基因的表达参与cAMP 信号传导,但不参与G 蛋白信号传导途径。同样地,基因VMK1[16]和VdHog1[18]分别是MAPK 信息素调控途径和MAPK 高渗调节途径的关键基因,在VdOAZ基因敲除突变体中,VMK1 基因的转录水平明显上调,而VdHog1 基因的转录水平不受影响,表明VdOAZ基因通过负调控VMK1 基因的表达参与MAPK 信息素信号途径,但不参与以VdHog1 为中心的MAPK 高渗调节途径。
4 结论
从棉花黄萎病菌落叶型强致病力菌株中克隆到VdOAZ基因全长,其ORF2 编码的VdOAZ蛋白具有OAZ 所特有的ODC-AZ 保守结构域,并且VdOAZ基因表达能够响应多胺水平变化,暗示VdOAZ 蛋白具有OAZ 的功能。VdOAZ基因敲除导致大丽轮枝菌菌落生长速率降低,产孢量和微菌核形成减少,对寄主的致病力下降,在感病棉花茎中的生物量减少,表明VdOAZ基因与大丽轮枝菌的孢子产生、微菌核形成和致病力相关;VdOAZ基因负调控其他与孢子产生、微菌核形成和致病力相关基因(VdPKAC1、VMK1、VdNLP1、VdNLP2 和VdSge1) 的表达,推测VdOAZ基因通过与cAMP 信号途径、MAPK 信息素调控途径及转录因子调控途径相互作用影响大丽轮枝菌孢子产生、微菌核形成和致病过程。
