棉纤维DNA的提取及其在品种溯源中的尝试
2019-04-10田新权付小琼时萌方丹徐双娇马磊
田新权,付小琼,时萌,方丹,徐双娇,马磊
(棉花生物学国家重点实验室/ 农业农村部棉花产品质量安全风险评估实验室/中国农业科学院棉花研究所,河南安阳455000)
我国棉花总产和单产均居世界前列[1];同时我国又是棉花最大的消费国,每年仍需要从国外进口大量棉花来缓解国内供需矛盾[2]。进口棉花存在以次充好、弄虚作假等一系列问题[3]。另外,在我国新疆地区棉花收储过程中一直存在“转圈棉”(纺织企业购买储备棉后未自用而进行倒卖,特别是将储备棉重新套包、打包冒充新棉交储的现象),盗取国家财政补贴,破坏和扰乱国家棉花收储政策的公正性。目前有很多种检测棉纤维品质优劣的技术手段来保障我国棉花产业安全[4],但急需建立能够对棉花原产地进行快速分类的方法,为进一步规范棉花交易市场提供技术支撑,通过建立以棉纤维为介质的棉花品种纯度检测、品种以及产地溯源体系,对我国棉花生产安全具有重要意义。
品种溯源对农作物品质和产业安全具有重要影响。品种溯源可借助于品种纯度及真实性鉴定,比较常见的鉴定方法主要有:小区种植鉴定法、卡那霉素法和DNA 分子标记法[5]。简单序列重复(Simple sequence repeat,SSR)是建立在聚合酶链式反应 (Polymerase chain reaction,PCR)基础上的DNA 分子标记。用SSR 标记鉴定作物品种纯度的试验操作简单,检测速度快,结果稳定可靠,重复性高,成本低,且对DNA 的质量要求不高,备受青睐。基于SSR 分子标记,一些作物已经建立DNA 指纹图谱,如玉米[6]、水稻[7]、棉花[8]等,利用DNA 指纹图谱也实现了玉米、水稻、棉花等作物品种真实性及纯度鉴定,对保证我国农业生产安全发挥了至关重要的作用。
棉花基因组DNA 提取是棉花SSR 分子标记最重要的步骤之一,常规应用于棉花SSR 分子标记的组织多数为幼嫩叶片、 种子等易于提取DNA 的组织。棉花纤维是胚珠外表皮单细胞经快速突起并极性延伸而成[9],其发育过程经历纤维起始期、伸长期、次生壁加厚和脱水成熟4 个过程[10]。成熟期的棉纤维含有超过90%的纤维素,细胞壁厚,且DNA 多发生降解,这些因素均增加了棉纤维DNA 提取的难度,且限制着所提取的棉纤维DNA 的数量和品质。由于其特殊性,目前鲜有文献报道利用棉纤维DNA 进行SSR分子标记。本研究经优化得到提取棉花纤维DNA 的体系,并用于提取不同发育时期的纤维和不同年份皮棉的基因组DNA,通过对所获得的纤维DNA 进行PCR 扩增对其质量进行验证;并选取13 对棉花SSR 引物对鲁1127、 石抗126和瑞杂816 皮棉材料进行SSR-PCR 验证,明确棉纤维DNA 分子标记用于棉花品种纯度鉴定及品种溯源的可行性。
1 材料与方法
1.1 试验材料
陆地棉TM-1 (Gossypium hirsutumL.cv.TM-1)由中国农业科学院棉花研究所提供。2017年材料种植于中国农业科学院棉花研究所试验农场(河南省安阳县),取开花后0 d(胚珠)和10、15、20、25、30、40 d 的纤维样品和正常收获的皮棉置于-80 ℃保存备用;2017、2016、2014、2010、2009年TM-1 皮棉材料均由中国农业科学院棉花研究所提供。鲁1127、石抗126、瑞杂816 皮棉材料由中国农业科学院棉花研究所提供。
主要试剂:十六烷基三甲基溴化铵(CTAB)、Tris、EDTA、PVP-30、 吐温20(Tween-20)、NaCl、β-巯基乙醇,均购于北京索莱宝生物科技有限公司;Taq酶、DNA Marker 均购于北京全式金生物科技有限公司;所涉及的引物均由上海生工生物工程有限公司合成。
裂解液配方:Tris 100 mmol·L-1、EDTA 10 mmol·L-1、CTAB 20 g·L-1、PVP-30 20 g·L-1、Tween-20 20 g·L-1、NaCl 1 mol·L-1、β- 巯基乙醇2%(体积分数),pH 8.0。
1.2 棉花纤维DNA的提取步骤
棉花纤维DNA 提取方法参照Paterson 等建立的棉花基因组快速提取的CTAB(Hexadecyltrimethyl ammonium bromide,十六烷基三甲基溴化铵)法[11],并适当改进,具体步骤如下:1)取200~300 mg 棉花纤维,充分剪碎并用液氮研磨。2)加入1.5 mL 细胞裂解液,充分混匀,65 ℃水浴30 min,水浴过程中颠倒离心管数次。3)加入等体积的氯仿- 异戊醇(体积比24∶1)抽提液,缓慢颠倒多次,12 000 r·min-1,4 ℃,离心10 min。4) 取上清转入新的离心管中,加入0.6 倍体积-20 ℃预冷异丙醇,缓慢颠倒离心管直至有沉淀析出,-20 ℃静置20 min。5)12 000 r·min-1,4 ℃,离心2 min,弃掉上清液。6)向离心管中加入600 μL 70%(体积分数)乙醇水溶液,12 000 r·min-1,4 ℃,离心2 min,弃掉上清液。7)重复步骤6。8)加入无水乙醇,12 000 r·min-1,4 ℃,离心2 min,弃掉废液,室温晾置2 min。9)加入40 μL 无菌水充分溶解DNA,4 ℃保存备用。
1.3 基因组DNA质量的检测
1.3.1棉花纤维DNA 凝胶电泳检测。利用琼脂糖凝胶电泳检测纤维DNA 的质量,将提取的不同发育时期的纤维DNA 在1.5%(质量分数)琼脂糖凝胶上进行电泳,电泳后置于凝胶成像分析系统(美国伯乐公司)下观察,照相。
1.3.2常规PCR 引物扩增。选取棉花泛素蛋白基因GhUBI7(Ghubiquitin7)、组蛋白基因GhHis3(Ghhistone3)和蛋白延伸因子基因GhEF1(Elongation factor-1 gene) 引物对所获得棉纤维DNA进行常规PCR 扩增,引物设计软件为Primer Premier 5,引物序列如表1。PCR 扩增试剂为北京全式金生物科技有限公司的2×EasyTaqPCR SuperMix (AS111-01),PCR 仪器为美国伯乐PCR仪(S1000),将PCR 产物在1.5%(质量分数)琼脂糖凝胶上进行电泳,电泳后置于凝胶成像分析系统(美国伯乐公司)下观察,照相。
1.4 SSR-PCR扩增及聚丙烯酰胺凝胶电泳
选取鲁1127、石抗126 和瑞杂816 皮棉纤维DNA 作为模板,以13 对SSR 引物进行PCR 扩增,引物序列见表2。反应体系:10×Buffer(含MgCl2)2 μL,10 mmol·L-1dNTPs 0.4 μL,2.5 U·μL-1Taq酶0.2 μL,10 μmol·L-1正向引物0.25 μL,10 μmol·L-1反向引物0.25 μL,DNA 模板1 μL,ddH2O 15.9 μL;反应程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,40 个循环;72 ℃延伸10 min。产物于4 ℃保存备用。
取2 μL PCR 扩增产物在8%(质量分数)的非变性聚丙烯酰胺凝胶上进行电泳分离,并显影观察,拍照保存[12]。

表1 PCR所用引物序列Table 1 Primers used in PCR

表2 SSR-PCR所用SSR引物序列Table 2 Primers used in SSR-PCR
2 结果与分析
2.1 不同发育时期的棉花纤维DNA凝胶电泳检测
棉花纤维是胚珠外表皮细胞经突起和极性伸长而成的单细胞。本研究选取开花后不同时间的棉花纤维作为供试样品,提取不同发育时期的棉纤维基因组DNA,将所提取的DNA 进行琼脂糖凝胶电泳。结果表明,0 DPA (开花后天数,Days post anthesis)胚珠(对照组)和10 DPA、15 DPA、20 DPA、25 DPA 的纤维DNA 均可呈现出单一、 清晰的DNA 条带;且对照组0 DPA 胚珠基因组DNA 条带最亮,25 DPA 的纤维DNA 条带微弱,而30 DPA、40 DPA 的纤维DNA 和皮棉的纤维DNA 未呈现出DNA 条带 (图1)。利用Thermo NanoDrop2000 超微量分光光度计检测30 DPA、40 DPA 的纤维DNA 和皮棉的纤维DNA 浓度,结果发现这些时期的材料所提取的DNA 浓度很低(表3),这也可能是进行琼脂糖凝胶电泳未检测出DNA 条带的原因。
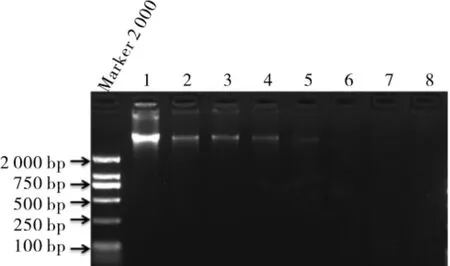
图1 棉纤维基因组DNA的琼脂糖电泳图谱Fig.1 The agarose gel electrophoresis pattern of fiber genomic DNA
2.2 不同发育时期的棉花纤维DNA的PCR扩增
随着棉花纤维的发育,所提取的DNA 含量也在降低。为了明确纤维发育后期低含量的DNA 能否用于常规PCR 扩增中,本研究选取了棉花泛素蛋白基因GhUBI7、组蛋白基因GhHis3和蛋白延伸因子基因GhEF1 引物对所获得的不同发育时期的棉纤维DNA 进行PCR 扩增,产物的琼脂糖凝胶电泳结果显示,不同时期的纤维DNA 均可扩增出清晰的目的基因条带(图2)。这一定程度上表明提取的不同时期的纤维DNA 能满足常规的PCR 扩增,可用于后续系列分子生物学的研究。

表3 DNA样品纯度与浓度检测结果Table 3 The result of inspection on purity and concentration of DNA

图2 对不同发育时期的棉纤维DNA的扩增结果Fig.2 The amplification results of cotton fiber DNA at different developmental stages
2.3 不同年份皮棉DNA的PCR扩增
本研究选取了不同年份(2017、2016、2014、2010、2009年)采摘的成熟棉纤维(室温储存)作为供试样品,同批次提取基因组DNA,以所获得的DNA 作为模板,以棉花GhHis3、GhUBI7、GhEF1 基因引物对所获得DNA 进行PCR 扩增,琼脂糖凝胶电泳结果表明,不同基因均可扩增出清晰的条带(图3),说明所提取的不同年份皮棉DNA 的质量可满足常规PCR 扩增要求。
2.4 棉纤维DNA的SSR-PCR扩增
用13 对SSR 引物对参加2016年棉花区试的鲁1127、 石抗126 和瑞杂816 皮棉DNA 进行PCR 扩增,结果显示不同的SSR 引物均能扩增出DNA 条带,且带型清晰、完整(图4)。说明此DNA提取法提取的DNA 完全能满足于SSR-PCR 扩增,使基于棉纤维DNA 的SSR 标记检测品种纯度成为可能,也进一步为根据棉纤维DNA 区分棉花品种、产地提供了技术支持。

图3 对不同年份皮棉的DNA的扩增结果Fig.3 The amplification results of DNA from ginned cotton in different years
3 讨论
本研究尝试对不同发育时期棉纤维DNA 进行提取,凝胶电泳结果显示发育后期纤维中提取的DNA 含量很低,不能显示出DNA 条带。这一方面可能是由于棉纤维细胞壁厚难裂解,另一方面可能是由于核酸物质多数集中在种壳端,且随着纤维成熟,核酸物质降解,发育后期纤维样品中的DNA 含量少。虽然提取的DNA 质量和数量较低,但是对提取的低浓度纤维DNA 进行PCR和SSR-PCR 扩增发现,均能扩增出清晰、明亮的DNA 条带,这说明利用该提取法提取棉纤维DNA 是可行的。
SSR 分子标记,已被广泛应用于农作物品种纯度鉴定,如水稻[13]、玉米[14]、小麦[15]、棉花[16]、大豆[17]等。基于这种技术手段,棉花品种鉴定取得很大进展:武耀廷等[18]利用SSR 分子标记检测了30 个陆地棉栽培品种和4 个高优势杂交种亲本的多态性,建立了杂交种的SSR 指纹图谱,用于分子鉴定和纯度检测。张小娟等[16]利用39 对SSR引物对16 个不同来源的棉花品种进行了区别与鉴定。棉纤维DNA 的提取为棉花品种纯度及真实性鉴定提供了一种检测途径。
如何通过检测棉纤维来区分其原产地是科研人员所关注的,国内外常见的产地溯源技术有:矿物元素指纹分析技术、有机成分指纹分析技术、近红外光谱指纹分析技术、电子鼻技术和DNA 指纹技术[19-20]。美国研究人员借助近红外光谱技术对来自印度、中国、巴基斯坦、美国等国家棉花纤维进行初步检测分析,目的是通过一些参数来区分美国本土棉和进口棉,避免进口棉花冒充本土棉花[21]。基于DNA 指纹技术来鉴定产地溯源的报道相对较少,现有研究主要依赖于对自身DNA 指纹图谱和寄生微生物菌落的DNA 指纹图谱进行分析[22-23]。本研究所探索的棉纤维DNA提取方法,为下一步以棉纤维DNA 作为介质,利用其遗传信息来区分棉花原产地奠定了基础;可为区分国产棉与进口棉提供技术手段,对保障我国棉花产业安全具有重要意义。
4 结论
本研究提取了不同发育时期棉纤维的基因组DNA。随着纤维发育,DNA 提取的难度也在加大;成熟棉纤维中提取的DNA 含量较低,但不影响PCR 扩增,可满足SSR 分子标记需要。本研究证实了棉纤维DNA 用于棉花品种纯度及品种溯源的可行性。
