杨树枯萎病菌实时荧光定量PCR检测方法的建立及应用
2019-04-06洒荣波晁强王晓辉隋君康刘训理
洒荣波 晁强 王晓辉 隋君康 刘训理

摘要:为建立荧光定量PCR检测杨树枯萎病的方法和明确前期分离的拮抗菌N6-34对杨树枯萎病致病菌尖孢镰刀菌的作用,本试验采用常规PCR法扩增尖孢镰刀菌的特异性片段,将此片段与载体连接构建质粒,提取质粒DNA在实时荧光定量PCR仪上采用两步法进行扩增并绘制实时荧光定量PCR标准曲线,同时对杨树进行不同灌根处理(T1:1×106 cfu/mL的尖孢鐮刀菌孢子悬液和未接N6-34菌株的发酵培养液各20 mL;T2:1×106 cfu/mL的尖孢镰刀菌孢子悬液和灭活的N6-34菌株发酵培养液各20 mL;T3:1×106cfu/mL的尖孢镰刀菌孢子悬液和N6-34菌株的发酵培养液各20 mL),并于10、20、30 d取样检测杨树根际尖孢镰刀菌数量。结果表明:本研究建立的方法能应用于土传尖孢镰刀菌导致的杨树枯萎病的检测;T1处理的尖孢镰刀菌的数量随处理时间的延长呈先下降后上升的趋势,T2和T3中的尖孢镰刀菌数量则呈下降趋势,表明N6-34能够抑制尖孢镰刀菌。本研究对指导杨树种植和病害预报具有极为重要的应用价值,能够为杨树病害管理提供科学依据。
关键词:荧光定量PCR;杨树枯萎病;尖孢镰刀菌;定量检测
中图分类号:S763.15文献标识号:A文章编号:1001-4942(2019)02-0131-05
Establishment and Application of a Real-Time Fluorescent
Quantitative PCR Method for Detection of Poplar Wilt Pathogen
Sa Rongbo Chao Qiang Wang Xiaohui3, Sui Junkang3, Liu Xunli2
(1. College of Life Sciences, Taishan Medical University, Taian 271016, China;
2. Forestry College of Shandong Agricultural University, Taian 271018, China;
3. College of Life Sciences of Shandong Agricultural University, Taian 271018, China)
AbstractThis study was aimed to construct a real-time fluorescent quantitative PCR method for detection of poplar wilt pathogen and make clear of the effect of antagonistic bacterium N6-34 isolated earlier on Fusarium oxysporum. The specific fragment amplified by routine PCR was lingated with the vectors to constrct the plasmid, and then the plasmid DNA was extracted and amplified by two-step method on a real-time fluorescent quantitative PCR instrument. The stantard curve of real-time fluorescent quantitative PCR was also obtained. In addition, an experiment was conducted by irrigating root of poplar with different solutions. Three treatments were designed as T1 (20 mL of 1×106 cfu/mL Fusarium oxysporum spore suspension and 20 mL of fermented culture solution with no N6-34), T2 (20 mL of 1×106 cfu/mL Fusarium oxysporum spore suspension and 20 mL of fermented culture solution with inactivated N6-34) and T3 (20 mL of 1×106 cfu/mL Fusarium oxysporum spore suspension and 20 mL of fermented culture solution with activated N6-34). The quantity of Fusarium oxysporum at the rhizosphere of poplar was detected after treated for 10, 20 and 30 days. The results showed that the real-time fluorescent quantitative PCR method established in this study could be used for the detection of poplar wilt caused by soil-borne Fusarium oxysporum. The quantity of Fusarium oxysporum decreased first and then increased under the T1 treatment, and decreased under the T2 and T3 treatments, which indicated that the antagonistic bacterium N6-34 could inhibit Fusarium oxysporum. This study would have very important application value for guiding poplar planting and disease prediction, and could provide scientific bases for poplar disease management.
KeywordsFluorescent quantitative PCR; Poplar wilt; Fusarium oxysporum; Quantitative detection
杨树作为世界上实用性最强的树种之一,具有速生、丰产、高效的特性,其分布十分广泛,主要生長于亚寒带地区及亚洲、欧洲、北美洲的部分地区[1,2]。其树体高大,体内水分充足,叶宽且多,易发生病虫危害,因而防治形势异常严峻[3]。据统计,危害杨树的病害有300多种,包括杨树溃疡病、枯萎病、烂皮病、黄化病、花叶病、叶锈病、白粉病等[4-7]。杨树枯萎病是一种重要的土传病害,病原菌在土壤中生存和积累,发病逐年加重,可引起杨树成片枯萎死亡。尖孢镰刀菌(Fusarium oxysporum)是一种世界性分布的土传病原真菌,寄主范围广泛,可引起杨树枯萎病的发生[8-10]。随着全球生态环境的恶化,杨树的病害种类也在逐渐增加,并有扩散蔓延的趋势。
本实验室从杨树中分离获得一株内生拮抗细菌N6-34。前期研究表明,该菌株发酵性状优异、拮抗效果好、抗菌谱广,对杨树溃疡病菌、尖孢镰刀菌、立枯丝核菌等多种病原菌有较强的拮抗作用[11]。本研究利用实时荧光定量PCR技术建立尖孢镰刀菌的荧光定量标准曲线,对不同处理下的杨树根际土壤中尖孢镰刀菌进行定量检测,并分析N6-34对该致病菌的抑制作用,以期为杨树枯萎病的诊断提供快速准确的检测方法,同时为该病的防治提供技术支撑。
1材料与方法
1.1试验材料
供试菌株:N6-34由本实验室从泰山林地健康杨树树皮中分离获得,甘油管保存于-80℃超低温冰箱中;尖孢镰刀菌(Fusarium oxysporum),由本实验室分离并保存。
1.2试剂与仪器
10×Loading Buffer、dNTP、DNA Marker、Taq DNA Polymerase,购自德泰生物科技(南京)有限公司。尖孢镰刀菌特异性引物JBf: 5′-CATACCACTTGTTGTCTCGGC-3′,JBr: 5′-GAACGCGAATTAACGCGAGTC-3′,由济南博尚生物技术有限公司合成。其它试剂均为国产分析纯。
基因扩增PCR仪LNB96,上海皓庄仪器有限公司生产;iQ5实时荧光定量PCR仪,美国Bio-Rad公司生产;全温振荡培养箱HZQ-F160,常州恒隆仪器有限公司生产;电热恒温水浴锅HWS-24,上海齐欣科学仪器有限公司生产;自动电热压力蒸汽灭菌器KYQL-RXS,济南来宝医疗器械有限公司生产。
1.3实时荧光定量PCR方法的建立
1.3.1尖孢镰刀菌基因组DNA的提取按照真菌基因组DNA提取试剂盒操作。
1.3.2尖孢镰刀菌特异性片段的扩增以提取的DNA作为模板进行常规PCR扩增。PCR反应体系20 μL:2×Taq PCR MasterMix 2.0 μL,JBf1.0 μL,JBr 1.0 μL,DNA 1.0 μL,ddH2O补齐。反应程序:94℃预变性5 min;94℃ 变性30 s,55℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。对PCR产物进行1%琼脂糖凝胶电泳检测,验证是否为目的片段。
1.3.3尖孢镰刀菌特异性片段胶回收纯化将PCR产物通过1%琼脂糖凝胶电泳进行分离,在凝胶成像分析系统下,用手术刀将目的条带胶条切下,用琼脂糖凝胶DNA回收试剂盒进行胶回收。
1.3.4尖孢镰刀菌目的片段的连接与转化将尖孢镰刀菌特异性片段与载体连接。其反应体系如下:PCR产物1.5 μL,pEASY-T1 Cloning Vector 1 μL,ddH2O 2.5 μL;室温下反应5 min,完成载体与目的片段的连接即质粒的构建。将构建好的质粒与大肠杆菌经冰浴、热击、冷却后加入不含氨苄青霉素的适量LB液体培养基,于37℃下振荡培养1 h,取适量菌液涂布在含50 mg/L的氨苄青霉素的LB平板上,37℃培养16~24 h,进行蓝白斑筛选。
1.3.5质粒提取阳性克隆的质粒提取参照质粒小量提取试剂盒说明书进行,使用超微量核酸蛋白测定仪检测提取质粒DNA浓度。
1.3.6实时荧光定量PCR标准曲线绘制将质粒DNA进行102、103、104、105、106和107倍梯度稀释,并以此为模板,在实时荧光定量PCR仪上采用两步法进行扩增。反应体系20 μL:2×TransStart Tip Green qPCR SuperMix 10.0 μL,JBf 0.4 μL,JBr 0.4 μL,DNA模板2.0 μL,ddH2O 7.2 μL。反应程序:94℃预变性30 s;94℃ 变性5 s,60℃ 退火 30 s,72℃延伸30 s,40个循环。溶解曲线步骤为:95℃ 15 s,60℃ 1 min,95℃ 15 s。反应结束后得到扩增曲线和溶解曲线。扩增结束后由仪器内置软件绘制溶解曲线,并绘制标准曲线。质粒浓度与质粒拷贝数的换算公式如下:
质粒拷贝数(copies/μL)=质粒浓度×6.02×1023/[(载体长度+片段长度)×660]
1.4杨树根际尖孢镰刀菌数量监测
将扦插3月后长势一致的杨树苗移至直径30 cm的花盆中进行不同的灌根处理,其中,T1:1×106 cfu/mL的尖孢镰刀菌孢子悬液和未接N6-34菌株的发酵培养液各20 mL;T2:1×106 cfu/mL的尖孢镰刀菌孢子悬液和灭活的N6-34菌株发酵培养液各20 mL;T3:1×106cfu/mL的尖孢镰刀菌孢子悬液和N6-34菌株的发酵培养液各20 mL。分别于10、20、30 d采集加菌处理后的杨树幼苗根际土壤,提取土壤总DNA(参照北京索莱宝科技有限公司生产的土壤DNA提取试剂盒D2500说明书进行操作)进行实时荧光定量PCR检测。根据PCR扩增曲线,比较各反应体系达到一定荧光阈值所经历的循环数即Ct值,再根据标准曲线获得处理样品中尖孢镰刀菌的质粒浓度,从而计算出尖孢镰刀菌在杨树根际土壤中的绝对拷贝数。
根际土壤中尖孢镰刀菌拷贝数的计算公式:
Ct=algX+b。
式中:X为1 μL DNA样品中的拷贝数;Ct为扩增产物达到设定阈值时经过的扩增循环次数;a、b为通过标准曲线获得的常数。
2结果与分析
2.1尖孢镰刀菌质粒样品的制备
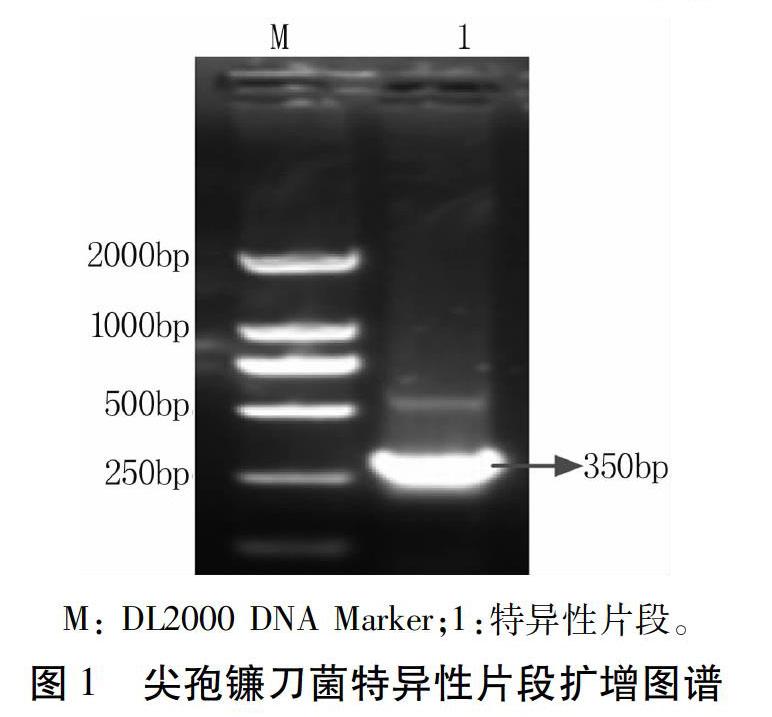
利用尖孢镰刀菌的特异性引物,进行常规PCR扩增得到长度为350 bp左右的特异性片段(图1),将此特异性片段利用琼脂糖凝胶DNA回收试剂盒进行胶回收,利用超微量核酸蛋白检测仪测定回收后的DNA浓度为70.30 ng/μL。
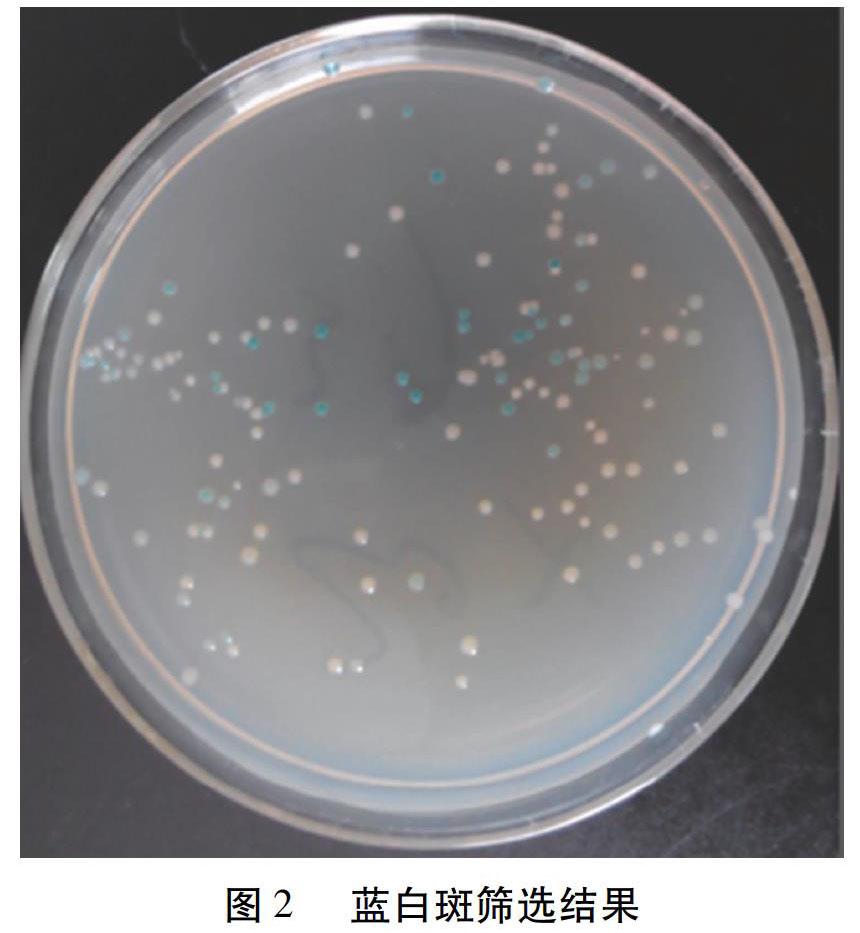
蓝白斑筛选结果如图2所示。随机挑取几个白色菌落,在LB培养基上扩大培养,提取质粒后用超微量核酸蛋白检测仪检测质粒DNA的浓度为179.30 ng/μL,A 260/A 280=1.84。
2.2实时荧光定量PCR标准曲线
经计算,浓度为179.30 ng/μL的质粒拷贝数为3.8×1010 copies/μL。经稀释分别得到系列梯度质粒标准品(对应的拷贝数为3.8×108、3.8×107、3.8×106、3.8×105、3.8×104、3.8×103 copies/μL),分别进行实时荧光定量PCR。以各梯度拷贝数的对数为横坐标,以各梯度Ct值为纵坐标构建实时荧光定量PCR标准曲线(图3),标准曲线的斜率为-3.3029,R2为0.9953。扩增产物的溶解曲线为单峰,表明扩增产物单一(图4)。
2.3杨树根际尖孢镰刀菌的动态监测结果
土壤总DNA琼脂糖凝胶电泳结果如图5所示。以土壤DNA为模板进行荧光定量PCR,检测尖孢镰刀菌在杨树根际的生长情况,结果如表1所示。可以看出,T1中尖孢镰刀菌的拷贝数呈现先下降后上升的趋势,第10 d时杨树根际土中的尖孢镰刀菌数量为35.3×105 copies/g,第20 d时下降为11.4×105 copies/g,第30 d时数量升高到28.4×105 copies/g。T2和T3的尖孢镰刀菌数量变化规律相同,均为下降趋势。不同处理相同时间下土壤中尖孢镰刀菌数量差异显著。
3讨论与结论
本试验对杨树根际土壤尖孢镰刀菌的动态监测发现,T1中尖孢镰刀菌的拷贝数呈先下降后上升的趋势,推测原因是尖孢镰刀菌刚施入土壤后先维持一段时间的高浓度,随后大部分尖孢镰刀菌死亡,但再经过一段时间,存活的尖孢镰刀菌会在杨树根际稳定定殖,数量上升并保持在一个稳定水平。T3中尖孢镰刀菌数量变化充分说明N6-34菌株对尖孢镰刀菌的抑制作用,同时也证明N6-34菌株能在杨树根际稳定定殖。由于T2加入灭活的发酵液,发酵液中已经产生活性物质,活性物质同样可以抑制尖孢镰刀菌,但由于活性物质的量是固定的,随着时间的延长活性物质的量越来越少,因此限制了对尖孢镰刀菌的抑制效果。
传统的土壤中病原微生物的定量一般采用选择性培养基将病原微生物从土壤中分离培养后进行确定[12]。但这种方法工作量大,且只能对可培养微生物进行定量,而土壤中99%的微生物是不可培养的,因此不能准确反映土壤中病原微生物的真实数量。而利用实时荧光定量PCR技术可以不通过病原微生物的分离培养直接对土壤中病原微生物进行定量检测[13]。本研究建立了利用实时荧光定量PCR技术对杨树枯萎病原尖孢镰刀菌的定量方法,证实前期分离的拮抗菌N6-34对杨树枯萎病菌尖孢镰刀菌的抑制作用。因此,本研究建立的方法能够应用于土传尖孢镰刀菌导致的杨树枯萎病的检测,并且本研究结果对指导杨树种植和病害预报具有极为重要的应用价值,能够为杨树病害管理提供科学依据。
参考文献:
[1]曲丹,姜卫兵,魏家星,等. 杨属树种在城乡园林绿化中的应用[J]. 黑龙江农业科学, 2014(9): 70-75.
[2]Bhlenius H, vergaard R. Impact of seedling type on early growth of poplar plantations on forest and agricultural land[J]. Scandinavian Journal of Forest Research, 2016, 31(8):733-741.
[3]張楠. 杨树病虫害防治技术[J]. 吉林农业, 2016(22):97-99.
[4]任嘉红,班虎栋,叶建仁,等. 吡咯伯克霍尔德氏菌JK-SH007的发酵条件及其对杨树溃疡病的防治效果[J]. 中国生物防治, 2010, 26(3): 300-306.
[5]任嘉红,王艳芳,叶建仁. 杨树腐烂病拮抗细菌的筛选及其定殖研究[J]. 西部林业科学,2009, 38(2): 6-11.
[6]项存悌,高克祥,何秉章,等. 杨树烂皮病生物防治的研究[J]. 东北林业大学学报,1991,19(6): 15-25.
[7]李伶俐,韩正敏,吕明亮,等. 杨树枯萎病菌茄类镰刀菌的生物学特性[J]. 林业科技开发, 2009,23(4): 51-54.
[8]谢宝多,马白菡,胡湘芝,等. 欧美杨枯萎病的研究[J]. 中南林学院学报, 1993, 13(1): 25-33.
[9]黄建强,廖树青. 欧美杨枯萎病症状和病原初探[J]. 湖南林业科技, 200 28(4): 52-53.
[10]刘彩云,季洪亮. 园林树木真菌性枯萎病研究进展及其防治策略[J]. 山东林业科技,2014,44(6): 100-103,128.
[11]洒荣波. 杨树内生拮抗菌N6-34抗菌活性物质与防病机制[D]. 泰安:山东农业大学, 2018.
[12]郑亚明,骆勇,周益林,等. 实时荧光定量PCR在植物病害流行学中的应用[J]. 植物保护,201 37(4): 18-22.
[13]陈璐,谢学文,石延霞,等. 实时荧光定量PCR检测蔬菜病原细菌技术[J]. 中国蔬菜,2013(4): 1-5.
