三个多倍体萱草品种的组培快繁
2019-04-06邹岩梅李桂云陈晓流
邹岩梅 李桂云 陈晓流

摘要:以多倍体萱草三个品种(代号分别为28、41、42)的花茎及幼蕾为外植体进行组培研究,结果表明,花茎的愈伤诱导及其相应的芽分化明显好于花蕾,花茎做外植体更适宜;以MS+(2.0~2.5) mg/L BA+(0.20~0.25) mg/L NAA培养基的愈伤诱导效果较好,三个品种中以41号愈伤形成早且量大,28号次之,42号愈伤出现较晚且量较少。在诱导芽分化时,41号和28号在MS+2.5 mg/L BA+(0.20~0.25) mg/L NAA培养基上芽分化数量多,41号最易芽分化,28号次之;42号需要多代的芽诱导驯化培养才分化出芽,在MS+(2.5~3.0) mg/L BA+(0.25~0.30) mg/L NAA培养基上分化数量较多,但分化率低于41号和28号。三个品种在MS+2.5 mg/L BA+0.25 mg/L NAA培养基上的增殖效果较好,在1/2MS+0.10 mg/L NAA中适宜生根培养。
关键词:多倍体萱草;离体培养;快速繁殖
中图分类号:S682.1+90.4+3文献标识号:A文章编号:1001-4942(2019)02-0023-05
Tissue Culture and Rapid Propagation of Three
Cultivars of Polyploid Hemerocallis fulva
Zou Yanmei Li Guiyun Chen Xiaoliu
(1. College of Horticulture Science and Engineering,Shandong Agricultural University/ State Key Laboratory of
Crop Biology,Taian 271018,China; 2. Biotechnology Engineering Department, Taishan Polytenic, Taian 271000,China)
AbstractThree cultivars of polyploid Hemerocallis fulva(cultivar number 28, 41 and 42) were selected for tissue culture by using their floral axis and flower buds as explants. The results were as follows: the callus produced from floral axis were much more and the buds were more easily differentiated compared with flower bud, so the floral axis was preferably as explants. The culture media of MS+(2.0~2.5) mg/L BA+(0.20~0.25) mg/L NAA were better for callus induction. The callus induced from cultivar 41 was the earliest and the most followed by the cultivar 28, while that from the cultivar 42 was the latest and least. In inducing buds, the media of MS+2.5 mg/L BA+(0.20~0.25) mg/L NAA induced much more buds from the cultivars 41 and 28,in which, it was more easily to induce buds from the cultivar 41 compared with 28. It needed for many generations of domestication culture to induce buds for the cultivar 4 and the media of MS+(2.5~3.0) mg/L BA+(0.25~0.30) mg/L NAA was optimal, but its inducing rate was lower than that of the cultivars 41 and 28. The medium of MS+2.5 mg/L BA+0.25 mg/L NAA was better for multiplication culture, and the medium 1/2MS+0.10 mg/L NAA was appropriate for rooting culture.
KeywordsPolyploid Hemerocallis fulva; In vitro culture; Rapid propagation
大花萱草又叫多倍體萱草(Hemerocallis fulva var. flore pleno),为百合科(Liliacea)萱草属(Hemerocallis L.)多年生宿根草本 [1]。其抗旱能力强,耐高温,抗低寒,适应温度范围广,在我国从南到北均可种植。抗病性强,对土壤的适应性广,除过酸、过碱、过沙、过粘的土壤外一般都能栽培,pH值以6.5~7.5为好。萱草对碱性土具有特别的耐性,是油田及滩涂地带不可多得的绿化材料。可用来布置各式花坛、马路隔离带、疏林草坡等;亦可利用其矮生特性做地被植物[2]。
萱草的繁殖方法为分株繁殖,分割萱草丛块是最常用的繁殖方法,该方法操作简单,植株容易存活,长势比较一致。分株多在春季萌芽前或秋季落叶后进行,春季分株移栽,当年即可抽薹开花;秋季分株移栽,翌年才能抽薹开花。但其自然分蘖繁殖的速度较慢,远不能满足商品化生产的需要。而利用组培快繁技术,可以极大地提高萱草的繁殖数量,加快繁殖速度,实现规模化生产。目前已有一些关于萱草组培快繁的报道,对诱导培养、增殖培养、生根培养等过程进行研究[3-6] 。分析以往的研究发现,不同萱草品种间基因型的差异较大,其组培快繁的结果不尽相同。本试验对从国外引进的三个多倍体萱草品种进行组培研究,为扩大其增殖倍数、快速育苗提供参考。
1材料与方法
1.1试验材料
2016年6月末至7月初,于山东泰安的多倍体萱草资源圃中选取三个品种,其代号分别为28、41、42,花色分别为玫红色、金黄色、重瓣深紫色。取整个花序,分别切取幼嫩的花蕾及花蕾下方约5 cm的花茎,流水冲洗1 h后,把花茎切成约0.5 cm的茎段,花蕾横切后保留花蕾下半部。在超净工作台上,把处理好的外植体材料在75%酒精中浸泡30 s后,用无菌水冲洗;再转入3%的NaClO中浸泡10 min,用无菌水冲洗5遍,以备接种。
1.2愈伤组织诱导培养
将外植体接种于愈伤组织诱导培养基上,每种外植体接种40瓶,每瓶1份材料,培养时间为40 d,期间观察愈伤组织诱导及生长状况。培养基分别为:MS+1.0 mg/L BA+0.10 mg/L NAA、 MS+1.5 mg/L BA+0.10 mg/L NAA、MS+2.0 mg/L BA+0.20 mg/L NAA 和MS+2.5 mg/L BA+0.25 mg/L NAA,均添加30 g/L蔗糖和6 g/L琼脂,调pH值为5.8。培养条件:温度25℃,光照强度2 000 lx,每天光照16 h。
1.3芽诱导培养
将诱导的愈伤组织分别转接到芽诱导培养基上,培养基分别为:MS+2.0 mg/L BA+0.20 mg/L NAA、MS+2.0 mg/L BA+0.25 mg/L NAA、MS+2.0 mg/L BA+0.30 mg/L NAA、MS+2.5 mg/L BA+0.20 mg/L NAA、MS+2.5 mg/L BA+0.25 mg/L NAA、MS+2.5 mg/L BA+0.30 mg/L NAA、MS+3.0 mg/L BA+0.30 mg/L NAA,均添加30 g /L蔗糖和6 g/L琼脂,调pH值为5.8。培养条件同上。
1.4继代增殖培养
将芽诱导培养基上生长良好、健壮的嫩芽切下转接到继代培养基中进行增殖培养。培养基分别为:MS+2.0 mg/L BA+0.20 mg/L NAA、MS+2.5 mg/L BA+0.25 mg/L NAA及MS+3.0 mg/L BA+0.30 mg/L NAA,均添加30 g/L蔗糖和6 g/L琼脂,调pH值为5.8。培养条件同上。
增殖倍數=继代后芽苗数量/继代前芽苗数量
1.5生根培养
将增殖培养中生长至2~3 cm高的壮苗剪下,转至生根培养基中,观察生根状况。生根培养基分别为: 1/2MS+0.1 mg/L NAA 和1/2MS+0.15 mg/L NAA,均附加 20 g/L 蔗糖和5 g/L琼脂,调整pH为5.8。培养条件同上。
生根率(%)=生根的组培苗数量/接种的芽苗数量×100
2结果与分析
2.1愈伤组织诱导
将三个多倍体萱草品种的外植体接种到四种培养基上后,保持鲜绿色、无褐变,20 d后有黄绿色的愈伤组织长出,表现为花茎外植体都能诱导出愈伤且愈伤出现时间早、生长量大;而花蕾外植体虽可以诱导出愈伤,但愈伤出现的时间晚、生长量很小。
花茎在MS+1.0 mg/L BA+0.10 mg/L NAA和MS+1.5 mg/L BA+0.10 mg/L NAA培养基上的愈伤生长量少,在MS+2.0 mg/L BA+0.20 mg/L NAA培养基上愈伤生长速度较快且量较多;MS+2.5 mg/L BA+0.25 mg/L NAA 培养基上愈伤生长速度快、量较大,是愈伤诱导的最佳培养基。培养40 d后三个基因型在MS+2.0 mg/L BA+0.20 mg/L NAA 上的表现差异明显,41号愈伤最早分化且生长量大,28号愈伤分化时间略晚且生长量居中,42号则愈伤分化晚且生长量相对较少(表1)。
在初代培养的40 d内,三个品种的愈伤中均未见芽的分化。
2.2芽诱导培养
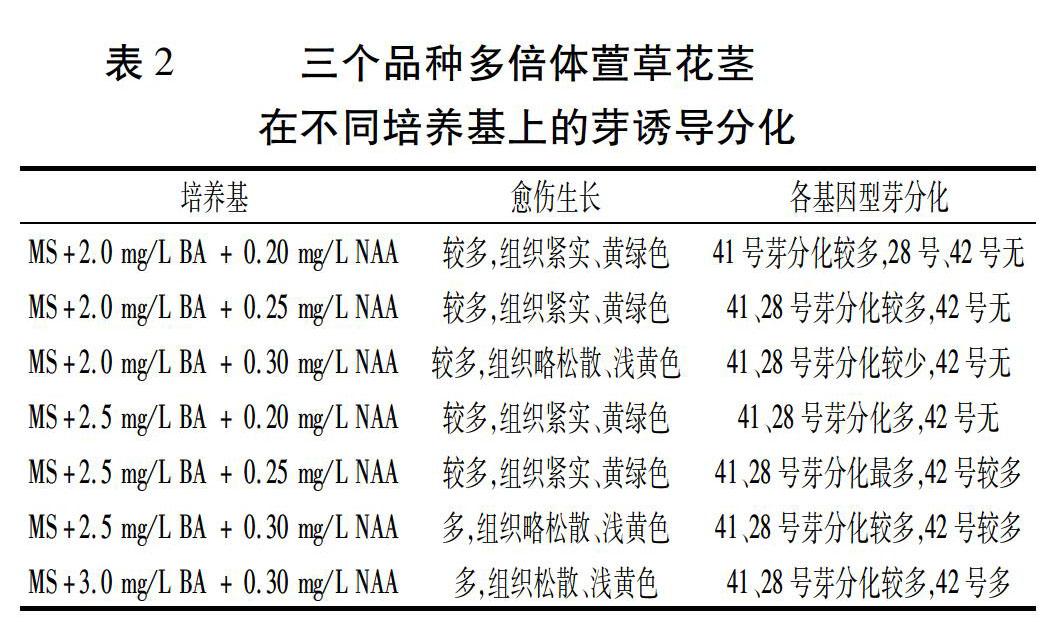
初代培养40 d后,选取各品种花茎和花蕾诱导出的较大体积的愈伤组织,切成小块,转入芽诱导分化培养基中,观察愈伤的生长及再分化情况。结果表明,花茎的愈伤组织生长量大且芽分化率高;而花蕾的愈伤组织生长量少,芽分化率很低。
调查花茎愈伤的芽诱导分化,结果(表2)表明,在MS+(2.0~2.5) mg/L BA+(0.20~0.25) mg/L NAA的培养基上,愈伤组织生长量较多,黄绿色且紧实; 41号和28号均有较多芽的分化,尤以在MS+2.5 mg/L BA+(0.20~0.25) mg/L NAA培养基上分化数量多、分化苗长势健壮、愈伤质量好;在MS+3.0 mg/L BA+0.30 mg/L NAA培养基上,41号和28号虽然芽分化快、数量较多,但分化苗长势较弱,且愈伤质量不佳,不利于后续利用愈伤组织继续诱导分化芽。
在各种培养基中,41号都非常容易分化且分化数量最多;28号较易分化,分化数量居中。42号最难分化,在各分化培养基中培养40 d后均没有分化出芽,直至连续培养10个周期、将近11个月后,才在MS+2.5 mg/L BA+0.25 mg/L NAA和MS+3.0 mg/L BA+0.30 mg/L NAA培养基上分化出芽,且以后者较好,表现为芽健壮且愈伤组织较为紧密,但其分化芽的数量比41号和28号的少。
上述结果表明,多倍体萱草不同基因型之间组织培养的难易程度差别较大。从资源圃里调查发现,41号在田间的自然分蘖数量最多,28号次之,而42号则很少分蘖。可见,对于自然分蘖量大的品种,其组培也相对容易;反之,自然分蘖很少的品种,其愈伤则需要在培养基上经过长时间的多代驯化培养才可以分化成芽,增加了组培成功的难度。
2.3增殖培养
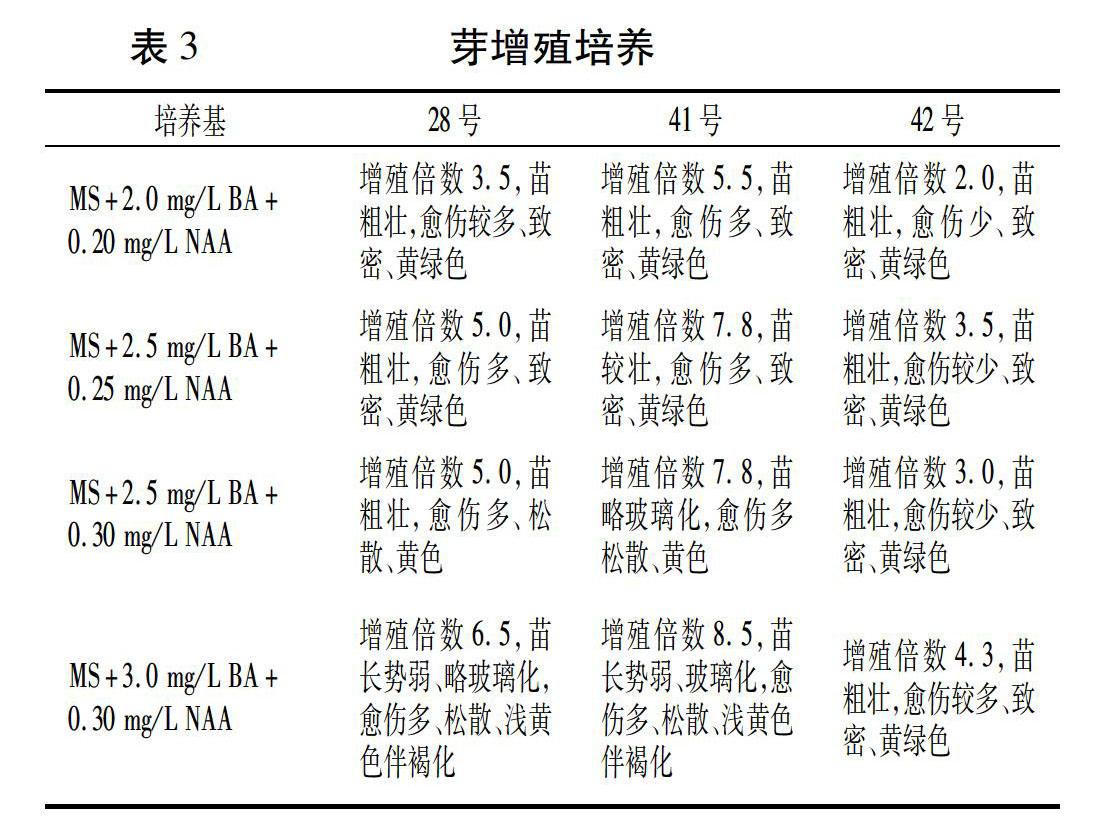
将分化出28、41、42号的芽丛切成单独的芽,接种到增殖培养基上进行培养、形成芽丛,实现快繁增殖。培养40 d时统计各基因型的增殖表现,结果(表3)表明,基因型不同,其增殖能力差别较大。
41号在各培养基上增殖系数都最大,容易增殖。在MS+(2.0~2.5) mg/L BA+(0.20~0.25) mg/L NAA培养基上分化系数适中,分化的芽粗壮、质量好;但在激素水平高的MS+(2.5~3.0) mg/L BA+0.30 mg/L NAA培养基上芽分化过快而导致分化的芽长势稍弱、玻璃化比率较大、愈伤松散伴有褐化。综合考虑,41号在MS+2.5 mg/L BA+0.25 mg/L NAA上增殖效果最佳。
28号在各培养基上增殖系数居中,分化芽长势较为粗壮。在 MS+2.5 mg/L BA+0.25 mg/L NAA 培养基上表现较好,分化率较高且分化苗较壮;在MS+3.0 mg/L BA+0.30 mg/L NAA培养基上虽然增殖系数提高,但分化苗生长势偏弱、略有玻璃化且愈伤太松散、易褐化。
相对于28号和41号,42号增殖倍数较低,愈伤生长也较慢。综合比较,在激素水平都较高的MS+3.0 mg/L BA + 0.30 mg/L NAA培养基上,分化系数高、苗粗壮、愈伤量中等、质量佳。
从三个基因型的增殖表现看出,在单芽分化出芽丛的同时都有愈伤组织的生长,将生长的愈伤组织单独剥离出来放到芽分化培养基上,培养一个周期后仍可诱导分化出较多数量的芽。因此,对于多倍体萱草,可以通过对愈伤进行芽诱导和芽增殖的双重方式达到增殖培养的目的。
2.4生根培养
将三个基因型的壮苗切下,接种到1/2MS+0.10 mg/L NAA 和1/2MS+0.15 mg/L NAA两种生根培养基中进行生根培养。
在1/2MS+0.10 mg/L NAA的培养基上(表4),41号最先生根,培养7 d生根率即达90%,培养10 d后生根率100%,至第15 d,根长5~31 mm,单株根数5~12条,最粗根直径达1.0 mm。28号培养10 d生根率仅30%,培养15 d后生根率达到90%,至20 d时生根率达94%,单株根数3~12条,根长5~30 mm,最粗根直径1.2 mm;继续培养至第25 d生根率达到100%。42号生根相对较晚,培养15 d生根率仅20%,25 d时生根率80%,单株根数2~8条,根长3~20 mm,最粗根直径0.8 mm;继续培养至30 d时生根率达100%。
而在1/2MS+0.15 mg/L NAA的生根培养基上,虽然NAA的浓度增加了0.05 mg/L,但三种基因型生根较为逊色,表现为苗基部先有较多愈伤生长,生根时间延迟。培养30 d时,根系数量变化不大,其长度和粗度与1/2MS+0.10 mg/L NAA培养基的相差不大。可见,1/2MS+0.10 mg/L NAA更适宜多倍体萱草的生根培养。
三个基因型间比较,开始生根的时间不同,41号最早,42号最晚,但最终都达到100%的生根率,且总体根系数量多、质量好,经练苗后移栽成活率均达90%以上。
3讨论与结论
3.1愈伤组织诱导
所用外植体不同,萱草的愈伤组织诱导效果不同。姜凤英等[7]对多倍体萱草‘金娃娃的研究表明,外植体诱导愈伤的效果,花蕾好于花茎,以花瓣最差;尹立辉等[2]的研究则表明多倍体萱草愈伤诱导以幼嫩花蕾和花瓣为外植体最为适宜,花茎最差;柏文琴等[1]报道,大花萱草花茎的愈伤组织诱导率较高,花瓣难以诱导愈伤,花托和子房愈伤组织诱导率较低,并且以花托和子房诱导的愈伤组织在芽诱导培养基上干枯死亡;彭广霖等[4]报道用幼嫩花梗进行大花萱草快繁取得良好效果。本研究也发现,以多倍体萱草花茎为外植体更容易诱导出愈伤和芽,而以花蕾为外植体虽也可诱导出愈伤,但愈伤出现的时间晚、量少,且芽分化率很低,不适宜用作多倍体萱草愈伤诱导的外植体。
3.2芽分化
多倍体萱草不同基因型的組培难易程度差别较大,41号、28号品种的愈伤组织容易分化出芽且数量多,而42号品种的愈伤组织需要经历连续多代的培养驯化才可以分化出芽。因此,当某些基因型萱草初代或继代培养不成功时,可以尝试进行连续多代的驯化培养以诱导出芽,进而实现组培快繁。
3.3增殖培养
尹立辉等[2]研究报道多倍体萱草的增殖系数达5.8,而本研究中三个基因型多倍体萱草的增殖系数在4.3~8.0之间。本研究发现,多倍体萱草在芽增殖培养形成芽丛的同时,产生较多愈伤组织,因此,在后续的连续多代增殖培养时,一方面可以对芽进行增殖培养形成芽丛,另一方面可以利用不断形成的愈伤组织分化形成更多的芽,两方面相结合共同达到快繁的目的。
3.4生根培养
在已有的报道中,多倍体萱草生根的生长素浓度都较低,如尹立辉等[2]报道在MS+0.04 mg/L NAA培养基上可达100%的生根率;袁爱民等[5]报道,多倍体萱草在1/2 MS+0.02 mg/L NAA培养基上生根较好;多倍体萱草‘金娃娃在1/2MS+0.1 mg/L NAA的培养基上生根率达96%[7]。本研究结果与上述结论一致,三个多倍体萱草品种也表现为在1/2MS+0.10 mg/L NAA培养基上生根效果较好。但也有报道采用较高浓度的生长素进行生根培养,如宋雪莲等[8]报道,多倍体萱草的5个新品种在1/2MS+(0.4~0.6) mg/L NAA上生根率可达100%。这可能与不同品种的基因型差别有关。另外,研究中发现生根苗在移栽时对空气湿度的变化不敏感,移植到基质中进行正常管理即可实现很高的成活率。
参考文献:
[1]柏文琴,闫桂琴,李瑞艳,等. 大花萱草不同外植体初代培养的比较研究[J]. 湖北大学学报(自然科学版),2012,34(1):89-92.
[2]尹立辉,武术杰,刘亚亮,等. 多倍体萱草的离体快繁技术[J].东北林业大学学报, 2016, 44(8):41-43.
[3]毕晓颖,王宁. 萱草花茎离体培养与快速繁殖[J].东北林业大学学报, 2012,40(11):56-59,158.
[4]彭广霖,姜宁,潘仕梅,等. 大花萱草的花梗组织培养与快速繁殖[J].安徽农业科学,201 40(17): 9203-9205.
[5]袁爱民,佟宝君,郝砚英,等. 多倍体萱草的组织培养与快速繁殖技术[J].天津农业科学, 2008, 14(3): 45- 47.
[6]张洁茹,刘晓嘉,陈丽飞,等. 萱草优良单株花茎离体快繁[J].东北林业大学学报, 2014, 42(2): 73-77.
[7]姜凤英,栾绍武,吴志刚,等. 多倍体萱草“金娃娃”的离体培养研究[J].辽宁农业科学, 2007(1): 51-52.
[8]宋雪莲,董然,赵和祥, 等. 五种新品种多倍体萱草离体快繁技术研究[J].北方园艺, 2011(7): 127-129.
