石榴查尔酮合成酶蛋白的生物信息学分析
2019-04-06冯立娟尹燕雷杨雪梅唐海霞李英朋鹿英
冯立娟 尹燕雷 杨雪梅 唐海霞 李英朋 鹿英


摘要:本研究用生物信息学方法对石榴及其他19个物种CHS蛋白的系统进化和motif元件进行分析,重点预测分析石榴、巨桉和拟南芥CHS蛋白的理化性质、氨基酸组成、磷酸化位点和二级结构。结果表明,石榴与巨桉亲缘关系最近,与拟南芥最远。石榴、巨桉和拟南芥CHS蛋白由20种氨基酸组成,数量和比例存在差异,石榴和拟南芥中亮氨酸数量最多,巨桉中丙氨酸最多;存在丝氨酸、苏氨酸和酪氨酸3个磷酸化结合位点,多数发生在苏氨酸和丝氨酸位置上;二级结构由α-螺旋、延伸链、无规则卷曲和β-转角构成,α-螺旋和无规则卷曲占比较高。在20个物种CHS蛋白的motif元件中,石榴CHS蛋白motif数量和位置与巨桉完全一致,与大多数物种相似,与拟南芥差异较大。本研究结果可为深入研究CHS生物学功能及其调控石榴果实呈色的机理提供理论依据。
关键词:石榴; 花青苷;查尔酮合成酶;生物信息学
中图分类号:S665.403文献标识号:A文章编号:1001-4942(2019)02-0007-06
Bioinformatics Analysis of CHS Protein in Pomegranate
Feng Lijuan Yin Yanlei Yang Xuemei Tang Haixia Li Yingpeng Lu Ying3
(1.Shandong Institute of Pomology, Taian 271000, China;
2. Guan County Dianzi Forestry Station, Guanxian 252525, China;
3.Shiheng Town Forestry and Fruit Station of Feicheng City, Feicheng 27161 China)
AbstractThe phylogenetic and motif elements of pomegranate and other 19 cultivars of CHS proteins were analyzed by bioinformatics methods in the study. The physicochemical properties, amino acid composition, phosphorylation sites and second structure of CHS proteins were emphatically analyzed in Punica granatum, Eucalyptus grandis and Arabidopsis thaliana. The results showed that Punica granatum had the closest relationship with Eucalyptus grandis and the farthest relationship with Arabidopsis thaliana. There were twenty amino acids in the CHS proteins of Punica granatum, Eucalyptus grandis and Arabidopsis thaliana, and the number and proportion were different. The leucine number was the highest in Punica granatum and Eucalyptus grandis, and alanine number was the highest in Arabidopsis thaliana. There were phosphorylation binding sites of serine, threonine and tyrosine, respectively, most of them existed in threonine and serine. The secondary structure was consist of alpha helix, extended strand, random coil and beta-turn, in which,the proportion of alpha helix and random coil were higher. In the motif elements of CHS protein of twenty cultivars, the number and location of CHS protein motifs in Punica granatum were identical to Eucalyptus grandis, similar to most cultivars, and significantly different from Arabidopsis thaliana. The results could provide theoretical bases for the further study on biological functions of CHS and mechanism of regulating the coloration of pomegranate fruit.
KeywordsPunica granatum; Anthocyanin; Chalcone synthase; Bioinformatics
查爾酮合成酶(chalcone synthase,CHS)是植物类黄酮代谢途径中关键限速酶之一,催化香豆酰辅酶A和丙二酰辅酶A合成柚皮素查尔酮,最终代谢成花青苷、黄酮醇和黄烷酮等类黄酮类物质[1-3]。CHS对植物的生长发育具有重要作用,不仅可以形成色素,还可以通过自身参与代谢调节活动并在一定程度上反映植物与环境间的相互关系[4,5]。CHS日益成为植物遗传育种、抗逆等领域的研究热点。
目前,桃[1]、葡萄[2]、杧果[3]和苹果[6]等多种果树中的CHS基因已被克隆出来,其表达水平受光照[7]、5-氨基乙酰丙酸[8]和机械损伤[9]的影响。石榴(Punica granatum L.)保健功能强,观赏价值高,耐干旱,抗盐碱,适应性广,深受消费者喜爱,发展前景广阔[10,11]。石榴中CHS基因已被克隆出来,其表达与果皮呈色密切相关[12,13]。但关于CHS蛋白生物信息学方面的分析较少,对其生物学功能未深入了解。因此,本研究以石榴CHS蛋白为研究对象,从系统进化、理化性质、磷酸化修饰、二级结构和motif元件等方面进行分析,以期为深入研究石榴果实呈色机理奠定理论基础。
1材料与方法
1.1CHS蛋白系统进化树的构建
通过NCBI数据库搜索已登录石榴CHS蛋白(序列号为ALT22073.1)的氨基酸序列,并通过Blastp检索石榴与其他物种CHS蛋白的同源性。根据同源性高低选取不同的物种(表1),并利用DNAMAN 6.0软件构建石榴与其他物种的系统进化树。
1.2CHS蛋白生物信息学分析
用ExPasy提供的在线ProtParam软件(http://expasy.org./tools/protparam.html)进行氨基酸数目、组分、理论等电点、蛋白质亲疏水性和稳定性等分析。蛋白质磷酸化位点采用 NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)分析,二级结构采用 SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测。利用在线MEME网站(http://meme-suite.org/tools/meme)对CHS蛋白的氨基酸序列进行模序分析。设定参数最大宽度值为50,最小宽度值为6,模序量小于20个,其余参数的设置均为默许。
2结果与分析
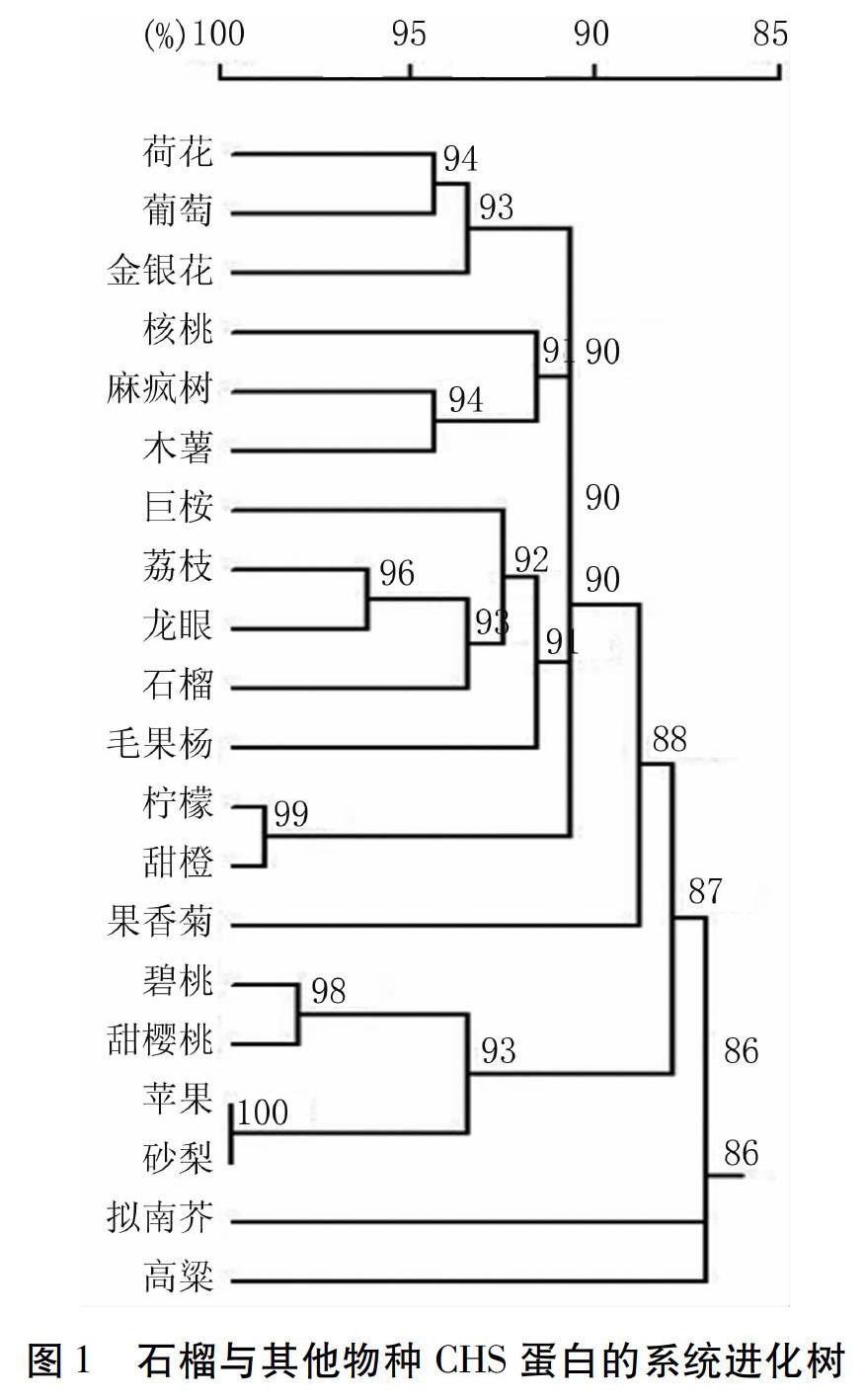
2.1CHS蛋白系统进化树构建
石榴与其他19个物种CHS蛋白的系统进化树如图1所示。该进化树分为三大组,拟南芥单独为一组,高粱单独为一组,其他18个物种为一组。其中,18个物种组又分为三大类,碧桃、甜樱桃、苹果和砂梨为一类,果香菊单独为一类,石榴、荔枝、龙眼、巨桉、葡萄、核桃、柠檬等13个物种聚为一类。由此可知,石榴与荔枝、龙眼、巨桉、葡萄CHS蛋白的亲缘关系较近,与拟南芥、高粱的亲缘关系较远。巨桉和石榴同属于桃金娘目植物,与其亲缘关系较近,拟南芥是一种模式植物,与其亲缘关系较远。因此,本研究选择巨桉、拟南芥与石榴CHS蛋白进行比对分析,进一步预测该蛋白功能的保守性与进化。
2.2CHS蛋白理化性质预测分析
由表2可知,ProtParam软件预测石榴CHS蛋白由398个氨基酸组成,分子式为C 1939H 3107N 523O 573S 19,相对分子质量为43 523.30,理论等电点(pI)为7.14,带负电荷的残基总数(Asp+Glu)和正电荷的残基总数均为47个;不稳定系数为37.18,为稳定蛋白;亲疏水性为-0.122,为亲水性蛋白。巨桉CHS蛋白由396个氨基酸组成,分子式为C 1912H 3051N 523O 573S 20,相对分子质量为43 174.62,理论等电点(pI)为6.10,带负电荷的残基总数(Asp+Glu)和正电荷的残基总数分别为49个和44个;不稳定系数为37.87,为稳定蛋白;亲疏水性为-0.119,为亲水性蛋白。拟南芥CHS蛋白由395个氨基酸组成,分子式为C 1914H 3062N 522O 568S 20,相对分子质量为43 115.72,理论等电点(pI)为6.08,带负电荷的残基总数(Asp+Glu)和正電荷的残基总数分别为49个和43个;不稳定系数为32.16,为稳定蛋白;亲疏水性为-0.074,为亲水性蛋白。
石榴、巨桉和拟南芥CHS蛋白共由20种不同的氨基酸组成,数量和比例存在一定差异(表3)。石榴和拟南芥中均是亮氨酸数量最多,分别为39个和40个,所占比例为9.8%和10.1%;巨桉中丙氨酸数量最多(40个),占比为10.1%。石榴、巨桉和拟南芥CHS蛋白中色氨酸数量最少,均为4个,占比均为1.0%。
2.3CHS蛋白磷酸化修饰预测分析
NetPhos 分析表明,石榴、巨桉和拟南芥CHS蛋白均存在丝氨酸、苏氨酸和酪氨酸3个磷酸化位点,且数量存在差异(图2)。石榴中苏氨酸(threonine)磷酸化位点有21个,丝氨酸(serine) 磷酸化位点有26个,酪氨酸(tyrosine)磷酸化位点有6个。巨桉中苏氨酸磷酸化位点有21个,丝氨酸磷酸化位点有28个,酪氨酸磷酸化位点有6个。拟南芥中苏氨酸磷酸化位点有19个,丝氨酸磷酸化位点有27个,酪氨酸磷酸化位点有3个。
2.4CHS蛋白二级结构预测分析
石榴、巨桉和拟南芥CHS蛋白预测的二级结构如图3所示,均由α-螺旋、延伸链、无规则卷曲和β-转角构成。石榴CHS蛋白中有176个氨基酸参与形成α-螺旋,占44.22%;有130个氨基酸参与形成无规则卷曲,占32.66%;有63个氨基酸参与形成延伸链,占15.83%;有29个氨基酸参与形成β-转角,占7.29%。巨桉CHS蛋白二级结构以α-螺旋和无规则卷曲为主,分别占40.66%和34.09%,延伸链和β-转角分别占16.41%和8.84%。拟南芥CHS蛋白中α-螺旋、无规则卷曲、延伸链和β-转角占的比例分别为47.09%、31.90%、14.43%和6.58%,α-螺旋和无规则卷曲占的比例较高。
2.5CHS蛋白motif元件预测分析
通过MEME在线预测motif元件结果如图4和图5所示,20个物种CHS蛋白motif数量变化为7~13个,类型存在差异。石榴、巨桉、木薯、毛果杨、高粱、果香菊和金银花的motif元件数量为13个,石榴和巨桉的类型相同,木薯和毛果杨的类型仅有1个不同,高粱和果香菊的motif类型基本相同,只有1个不同。葡萄、荔枝、龙眼、麻疯树和荷花均存在12个motif元件,荔枝与龙眼、葡萄与荷花的类型基本相同,麻疯树与其它4个物种仅有1个类型不同。柠檬、甜橙、苹果、砂梨、碧桃、甜樱桃和核桃的motif数量为11个,类型基本相同。拟南芥motif数量为7个,类型与其它19个物种存在很大差异。由此进一步证明石榴与巨桉的亲缘关系最近,与其它18个物种较近,与拟南芥较远。
3讨论与结论
随着现代分子生物学技术的发展,石榴基因组已被国内外科研人员破译出来,把石榴重新划分为千屈菜科(Lythraceae),其分子特征与巨桉存在很多共性[14]。本研究通过分析石榴与其他19种植物CHS蛋白的系统进化关系发现,石榴与巨桉亲缘关系最近,与拟南芥亲缘关系最远。巨桉属于桃金娘科,和石榴同属于桃金娘目植物,所以它们之间的遗传关系较近。
蛋白质是生命活动的主要执行者,磷酸化修饰是蛋白质翻译后修饰的一种重要形式,蛋白质磷酸化在调节植物细胞增殖、发育、信号转导、胁迫应答等活动中起重要作用[15]。本研究表明,石榴、巨桉和拟南芥CHS蛋白均存在丝氨酸、苏氨酸和酪氨酸3个磷酸化结合位点,多数发生在苏氨酸和丝氨酸位置上,少数在酪氨酸位置上。CHS蛋白磷酸化后能改变其自身的活性,调节植物的生长发育过程[16]。
CHS在植物类黄酮生物合成途径中起重要调控作用,受到科研工作者的广泛关注。目前CHS基因序列已克隆出4 000余条,在苔藓、蕨类、裸子植物和被子植物中均有报道[17]。本研究利用生物信息学方法对石榴CHS蛋白系统进化、理化性质、二级结构、motif元件等进行分析,阐明了其重要的分子特征,丰富了该蛋白的相关研究。花青苷代谢受外界环境条件的影响很大,UV诱导能上调CHS基因的表达,促进花青苷的积累[18]。后续将深入分析光照、UV照射等对石榴果实叶色表达的影响,分析CHS的表达模式与花青苷代谢的关系,从而为深入揭示石榴果实呈色机理提供理论依据。
参考文献:
[1]张蕾, 朱立新, 徐川, 等. 查尔酮合酶基因对桃果实花色苷代谢的影响[J]. 园艺学报, 2015, 42 (1): 31-37.
[2]袁华招, 赵密珍, 吴伟民, 等. 葡萄CHS和STS基因家族生物信息学鉴定和表达分析[J]. 植物遗传资源学报, 2016,17(4):756-765.
[3]梅志栋, 张贺, 刘晓妹, 等. 杧果查尔酮合成酶基因(CHS1)的克隆与表达分析[J]. 果树学报, 2015, 32(6):1077-1084,1315.
[4]徐靖, 朱家红, 王效宁, 等. 甘薯查尔酮合成酶基因IbCHS1的克隆和表达分析[J]. 分子植物育种, 2018, 16(6): 1752-1757.
[5]李苗, 石磊, 李国旗. 植物查尔酮合成酶超基因家族组成及分子进化[J]. 分子植物育种, 2016, 14(6): 1421-1429.
[6]Chen L, Guo Y R, Zhang X R, et al. Effects of 5-aminolevulinicacid on the content of total flavonoids and expression of CHS and CHI genes in young apples[J]. Agricultural Biotechnology, 2015, 4(3): 39-42.
[7]骆菁菁, 李虹, 柏斌斌,等. 光照对月季‘光谱花青素合成及其CHS和DFR基因表达的影响[J].分子植物育种, 2013, 11(1):126-131.
[8]陈磊, 郭玉蓉, 张晓瑞, 等. ALA对苹果幼果黄酮含量及CHS和CHI基因表达的影响[J]. 西北农林科技大学学报(自然科学版), 2014, 42(12):161-165,172.
[9]高雄杰, 赵继荣, 毕阳,等. 采后硅酸钠处理及损伤接种对厚皮甜瓜CHS基因的诱导表达[J]. 甘肃农业大学学报, 2010, 45(3): 48-51.
[10][KG*2]Radunic M, pika M J, Ban S G, et al. Physical and chemical properties of pomegranate fruit accessions from Croatia[J]. Food Chemistry, 2015, 177:53-60.
[11][KG*2]馮立娟, 尹燕雷, 焦其庆, 等. 石榴PAL基因的克隆与表达分析[J]. 核农学报, 2018, 32(7): 1320-1329.
[12][KG*2]Zhao X Q, Yuan Z H, Feng L J, et al. Cloning and expression of anthocyanin biosynthetic genes in red and white pomegranate [J]. Journal of Plant Research, 2015, 128:687-696.
[13][KG*2]吴忠红, 杜鹃, 阿塔吾拉铁木尔, 等. 石榴花色苷相关基因( PgANS、PgCHS、PgACT) 的克隆与序列分析[J]. 新疆农业科学, 2017, 54(1): 88-94.
[14][KG*2]Yuan Z, Fang Y, Zhang T, et al. The pomegranate (Punica granatum L.) genome provides insights into fruit quality and ovule developmental biology[J]. Plant Biotechnology Journal, 2017, 16(7): 1363-1374.
[15][KG*2]常丽丽, 王力敏, 郭安平, 等. 木薯叶片响应干旱胁迫的磷酸化蛋白质组差异分析[J]. 植物生理学报, 2018, 54 (1): 133-144.
[16][KG*2]肖培连, 冯睿杰, 侯丽霞, 等. 葡萄WRKY18基因的克隆及表达特性分析[J]. 植物生理学报, 2015, 51(3): 391-398.
[17][KG*2]王志彬, 申晚霞, 朱世平, 等. 柑橘 CHS 基因序列多态性及表达水平对类黄酮生物合成的影响[J]. 园艺学报, 2015, 42 (3): 435-444.
[18][KG*2]戚楠楠, 张晓燕, 苏娜娜, 等. UV-A诱导大豆芽苗菜下胚轴中花青苷积累的分子机理[J]. 中国农业科学, 2015, 48(12): 2408-2416.
