盐胁迫下谷子根部细胞内pH值测定
2019-04-06李小波潘教文丁国华李臻王庆国刘炜
李小波 潘教文 丁国华 李臻 王庆国 刘炜
摘要:利用BCECF-AM荧光染料和激光共聚焦显微镜测定谷子根部细胞内的荧光强度,进而换算成细胞内pH值,以此来研建测定谷子根部细胞内pH值的方法。结果显示:正常水培条件下,谷子品种YG2和AN04根部细胞内pH值分别为5.85±0.11和5.77±0.26;盐处理下YG2和AN04根部细胞内pH值分别达到6.21±0.26和6.19±0.17,即盐敏感品种AN04根部细胞盐处理后pH值变化较大,提高7.28%,而抗盐品种YG2提高6.15%。这说明抗盐品种盐胁迫下细胞内pH值受外界环境影响较小,对盐害的耐受力较高。该方法用来定量测定细胞内pH值具有可信性,亦可作为评价植物耐受胁迫能力的辅助手段。
关键词:谷子;盐胁迫;BCECF-AM荧光染料;根部细胞内pH值
中图分类号:S516.01文献标识号:A文章编号:1001-4942(2019)02-0040-05
Determination of pH Value in Root Cells of
Foxtail Millet under Salt Stress
Li Xiaobo1, Pan Jiaowen Ding Guohua Li Zhen Wang Qingguo Liu Wei1,3
(1.Biotechnology Research Center, Shandong Acadamy of Agricultural Sciences/Shandong
Provincial Key Laboratory of Crop Genetic Improvement, Ecology and Physiology, Jinan 250100, China;
2. School of Life Sciences and Technology, Harbin Normal University, Harbin 150025, China;
3.College of Life Sciences, Shandong Normal University, Jinan 250014, China)
AbstractThe fluorescent probe of BCECF-AM was used to measure the intracellular pH value in root cells of foxtail millet in this research. The fluorescence intensity was detected with laser scanning confocal microscopy, and then was converted to pH value. The results showed that the pH values in root cells of the foxtail millet varieties YG2 and AN04 were 5.85±0.11 and 5.77±0.26 respectively under normal hydroponic culture, but increased to 6.21±0.26 and 6.19±0.17 respectively under salt treatment. The pH value ofsalt-sensitive variety AN04 increased by 7.2%, which was a little more than that of salt-resistant variety YG2 of 6.15% under salt stress. The results indicated that the intracellular pH value of salt-tolerant varieties was less affected by external environment, and their tolerance to salt damage was higher. This method was reliable for the quantitative determination of intracellular pH value, and it could be used as an auxiliary means to evaluate the tolerance of plants to stress.
KeywordsFoxtail milliet (Setaria italic L.); Salt stress; BCECF-AM fluorescent dye; Intracellular pH value in root
土壤盐渍化是目前影响农作物产量和质量的主要环境因子之一,也是全球面临的重大危机之一[1]。盐渍化土壤中,高浓度的盐会引起植物的离子胁迫、渗透胁迫及氧化胁迫[2],导致植物体内正常的离子分布和动态平衡被打乱,从而破坏细胞内的各种代谢活动,最终导致细胞内活性氧积累,细胞膜过氧化、生物大分子破坏,最终伤害植物生长代谢,甚至引起植物死亡[3,4]。据统计,中国盐碱地面积约为9 913×104 hm 占全球盐碱地总面积近10%[5]。盐碱地作为我国重要的后备土地资源,因其土壤质量差、生产效率低而大面积荒芜,导致这些地区农业生产不足,严重制约其区域经济发展[6]。因此研究作物耐盐机制、培育抗逆耐盐作物新品种,是农业科学家的重大责任。
近年来,对植物应答盐胁迫的生理生化研究,尤其是在分子生物学层面的研究成果,使植物响应盐胁迫及植物的耐盐机制越来越清晰。但是对植物细胞如何参与盐胁迫及盐胁迫下细胞内pH值的变化研究较少。已知细胞内的pH值在许多细胞生命活动中发挥着重要作用,是控制植物细胞内生化反应的重要调节因素之一[7]。细胞内pH值通常为中性,而液泡的pH值通常在5.0~6.5之间。细胞内pH值参与调节酶活性、代谢途径和生理活动等,因此细胞内pH值测定可以为植物抗逆等方面研究提供重要参考依据。据报道,细胞内pH值测定方法常用的有核磁共振法(nuclear magnetic resonance spectroscopy,NMR)、微電极法(microelectrodes)、荧光染料法(fluorescent dyes)、细胞液提取法 (cell sap extract)和弱酸弱碱分布法(weak acid and base distribution)等[8]。其中荧光染料法是采用pH值敏感荧光染料进行细胞内pH值测定,常用荧光染料有BCECF[3′-O-acetyl-2′,7′-bis(carboxyethyl)-5-carboxyfluorescein]和SNARF(seminaphtor hodafluor)。BCECF作为一种pH荧光探针被广泛地用于细胞内pH值测定,但是其自身很难穿过细胞膜进入到细胞内,而BCECF-AM[3′-O-acetyl-2′,7′-bis(carboxyethyl)-5-carboxyfluorescein, diacetoxy methyl ester]是乙酰甲酯化的BCECF,它如同其它乙酰甲酯类物质一样能够轻易地进入细胞内。当BCECF-AM透过细胞膜进入细胞后,AM基团在细胞内酯酶的作用下被水解,形成亲水且能发荧光的BCECF,而BCECF的荧光强度依赖于细胞内pH值的大小。分别用490 nm和440 nm的波长激发BCECF所得到的荧光强度比值与pH值之间存在很好的线性关系,继而可以进一步定量测算细胞内pH值。
谷子(Setaria italica L.),作为我国特色杂粮作物,具有须根粗壮、根系发达和耐盐耐旱能力较强等特点,是应对未来水资源短缺的重要战略储备作物[9]。谷子因具备C4 光合途径和特殊抗旱耐逆性而备受国内外研究者关注,近年来已逐渐发展成为C4和抗旱耐逆研究的模式作物[10]。前期研究中,我们筛选到抗盐及盐敏感谷子品种豫谷2号(YG2)和安04(AN04)。本研究,我们以这两种材料为基础,采用BCECF-AM荧光探针标记方法测定150 mmol/L NaCl盐胁迫引起的谷子根部细胞内pH值变化,且为了让BCECF-AM更加快速地透过细胞膜进入细胞,同时选择高分子非离子型表面活性剂泊洛沙姆(Pluronic F-127)来增加BCECF-AM的水溶性,提高其透过细胞膜的效率。通过该研究以明确利用荧光探针标记法定量测定细胞内pH值的可靠性,继而作为评价植物耐受胁迫能力的辅助手段用于抗性品种的筛选及培育。
1材料与方法
1.1材料与试剂
所用谷子品种为豫谷1号(YG1)、豫谷2号(YG2)和安04(AN04)。将种子排放入培养皿,放到人工气候培养箱中,于28℃、光周期(光照/黑暗)8 h/16 h条件下萌发培养4 d备用。
所用试剂BCECF-AM、Pluronic F-127购于英杰生命技术有限公司;MES(2-吗啉乙磺酸)购于赛国生物科技有限责任公司;HEPES(4-羟乙基哌嗪乙磺酸)购于北京酷来搏科技有限公司;MS、NaCl、蔗糖、醋酸铵、KOH购于上海泸试实验室器材股份有限公司。
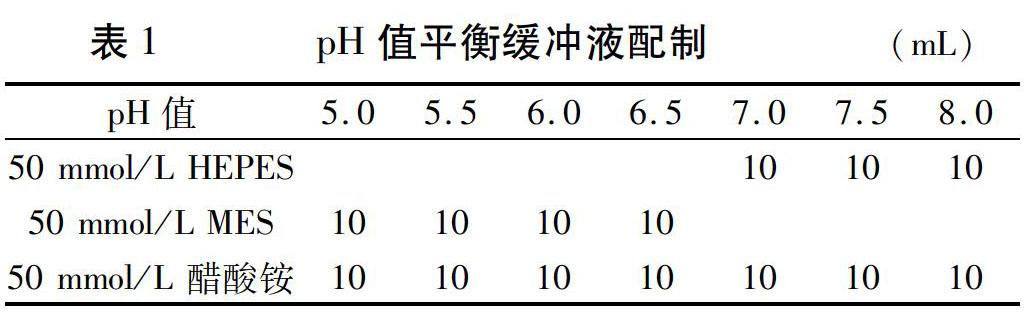
pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0)平衡缓冲液配制如表1所示,加入相应试剂后用KOH调至相应pH值,并定容至50 mL。
1.2检测方法
1.2.1pH值标准曲线的绘制挑选7组YG1幼苗,每组20株,将其放在含有10 μmol/L BCECF-AM 和0.02% Pluronic F-127的1/10 MS液体培养基中,于22℃、黑暗中温育2 h,然后在不同pH值(5.0、5.5、6.0、6.5、7.0、7.5、8.0)平衡缓冲液中平衡15 min,以校正幼苗根部细胞内pH值。之后洗涤两次,用激光共聚焦显微镜观察、拍照。即:分别对根部根尖细胞、伸长区细胞和下胚轴细胞进行观察,用488 nm和ECFP nm荧光激发后,收集荧光图像;图像经校正后测定488 nm和ECFP nm激发图像的荧光强度,并利用ImageJ1.44软件计算比值ratio488/ECFP。通过不同pH值下的荧光强度比值绘制pH值标准曲线。
1.2.2细胞内pH值的检测以抗盐及盐敏感谷子品种YG2和AN04为试材。将YG2和AN04幼苗置于含有无菌水的培养皿中,于28℃、光周期(光照/黑暗)8 h/16 h条件下人工气候培养箱中培养3 d。之后处理组用150 mmol/L NaCl处理12 h,再将处理组(NT)和对照组(CK)分别置于含有10 μmol/L BCECF-AM和0.02% Pluronic F-127的1/10 MS液体培养基中,于22℃、黑暗中温育2 h,再用MS培养基清洗两次,而后用488 nm和ECFP nm荧光激发后,收集荧光图像。利用ImageJ1.44软件计算两个激发波长下图像的荧光强度,并计算两者比值ratio488/ECFP,再与pH值标准曲线进行比对,计算得到不同比值对应的pH值。
1.3数据处理
利用WPS Office 11.1软件对数据进行处理和作图。
2结果与分析
2.1pH值标准曲线
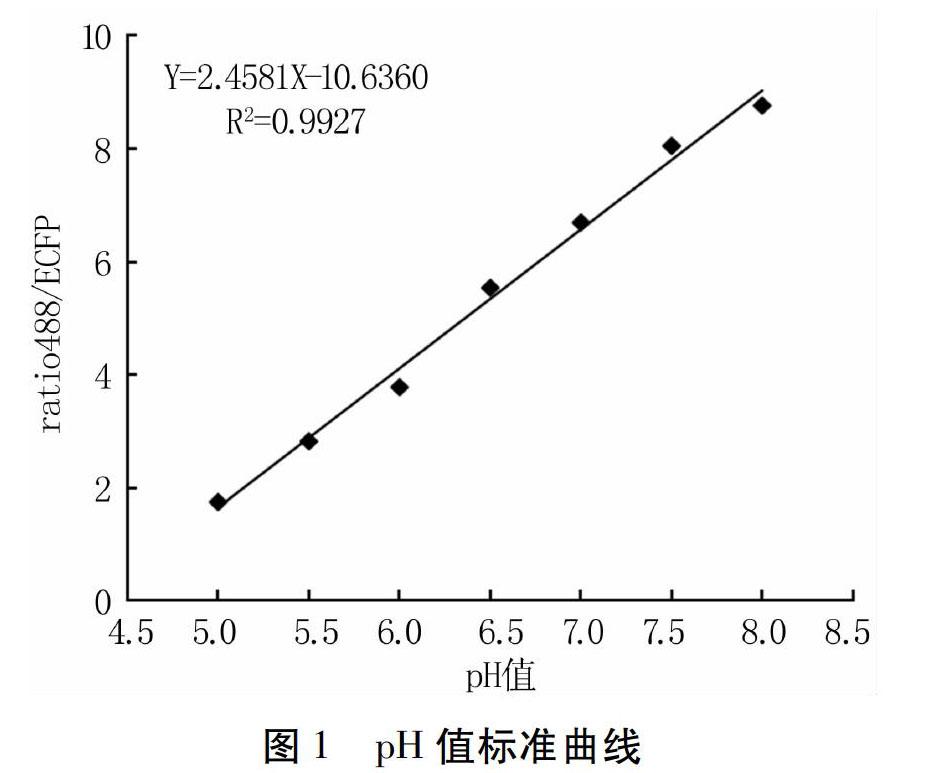
激光共聚焦显微镜检测时,选择两个荧光通道,分别是绿色荧光488 nm通道和蓝色荧光ECFP通道(ECFP约475~503 nm),最终得到两激发波长的荧光强度比值ratio488/ECFP。利用激光共聚焦显微镜测定不同pH值缓冲液下YG1根部细胞中的BCECF荧光强度,并通过ImageJ1.44软件分析并计算得到不同pH值下的ratio488/ECFP,结果如图1所示。pH值与BCECF荧光强度比值 ratio488/ECFP之间呈良好的线性关系,其R2=0.9927,回归方程为Y=2.4581X-10.6360,式中Y为荧光强度比值 ratio488/ECFP,X为 pH 值。可以看出,随着谷子根部细胞内pH值的升高,绿色荧光通道488 nm和蓝色荧光通道ECFP的荧光强度比值也随之升高,两者呈正相关。
2.2YG2和AN04盐处理前后根细胞内pH值的变化
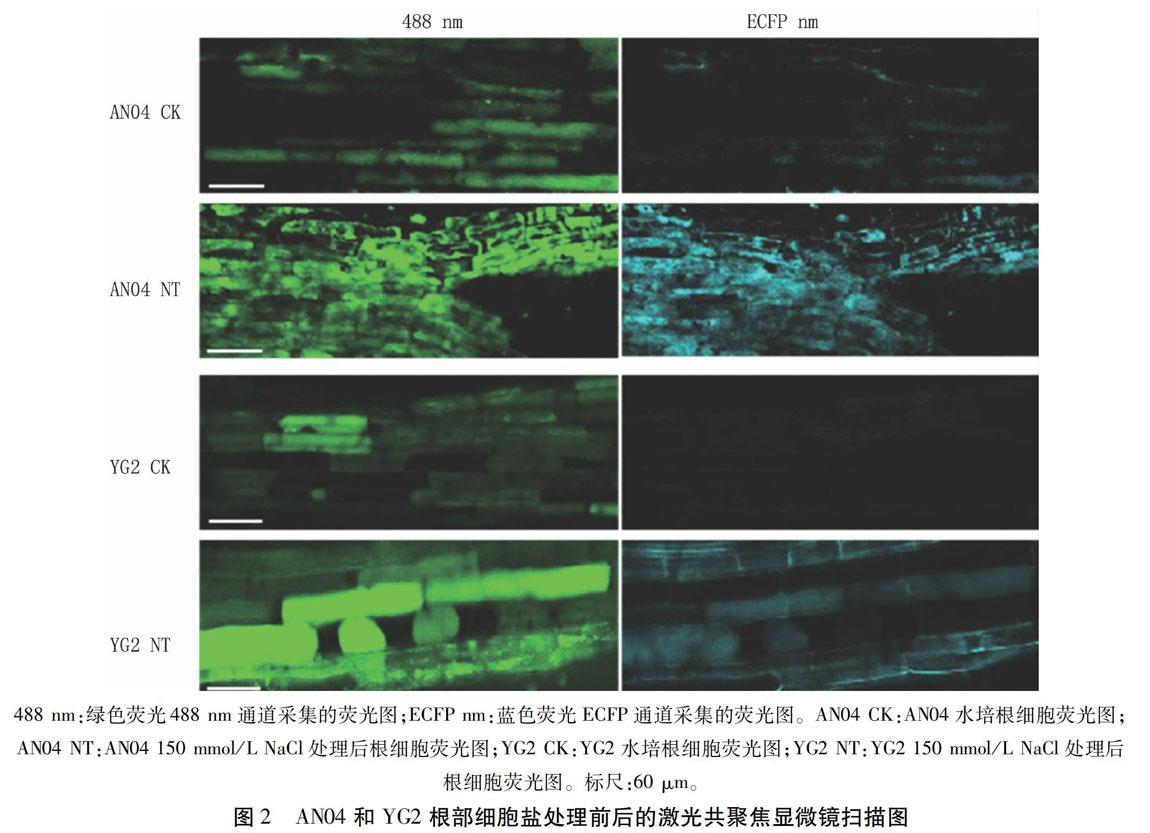
利用激光共聚焦显微镜测定YG2和AN04谷子幼苗根部细胞在正常水培条件下和150 mmol/L NaCl胁迫下的荧光强度(其扫描图见图2),并计算得到比值ratio488/ECFP。将该比值代入到pH值标准曲线的回归方程,得到对照和盐处理下YG2和AN04根部细胞内的pH值。从图3看出,对照组根部细胞内pH值明显低于盐处理组,其中AN04对照组的pH值为5.77±0.26,盐处理组为6.19±0.17,盐处理组比对照提高7.28%;YG2对照组根部细胞内pH值为5.85±0.11,盐处理组为6.21±0.26,盐处理组比对照提高6.15%。說明盐敏感品种AN04的根部细胞,在盐处理下的pH值变化较大,比YG2高1.13个百分点。由此可见,抗盐品种YG2在盐胁迫下,细胞内pH值受外界环境影响较小,对盐害的耐受力较高。
3讨论与结论
迄今为止,利用荧光染料技术研究植物细胞内pH值的报道较少。其中姜淑媛等(2009)[11]在研究茶树荧光性绿斑病时发现,在含BCECF的茶树叶中,正常叶片胞内pH值为5.35,病害叶片胞内pH值为6.89,病害叶片胞内pH值与病害程度呈显著正相关。Krebs等(2010)[12]为了研究拟南芥液泡ATP酶活性,测定了野生型和VHA-A3单突变体拟南芥根细胞内的pH值,发现野生型的为5.9,而突变体的为6.4,液泡膜ATP的丢失使根表皮细胞液泡pH值增加0.5个pH单位。Bassil等(2011)[13]为了研究细胞内Na+/H+ 反转运体在细胞pH值和Na+、K+稳态中的作用,测定了拟南芥根细胞的pH值,发现根成熟区和下胚轴细胞中nhx1、nhx2缺失型植株的液泡pH值较野生型分别降低0.50个和0.35个pH值单位。
本研究中,我们选用YG1来制作pH值标准曲线。YG1基因组序列已测序并释放,也是我国育成的优良品种,国内外对其研究较深入,以该材料制作的pH值标准曲线具有较高参考价值。通过对盐胁迫下谷子YG2和AN04根部细胞内的荧光图像及pH值的分析表明,谷子经盐处理后,两品种根部细胞内pH值均升高。鉴于pH调控系统是植物在长期进化过程中形成的一种抗逆机制,故认为本研究中谷子根部细胞内pH值的上调,是其对盐胁迫的一种应答响应,是其在遭受盐害时降低离子吸收以减轻离子毒害的应激反应。盐胁迫前后细胞内pH值的变化大小及pH值调控系统效率高低客观上反映出植物在进化过程中抵抗逆境胁迫能力的强弱。本研究中通过对盐胁迫下抗盐谷子品种YG2和盐敏感品种AN04根部细胞内pH值的变化进行定量测定,结果发现,盐胁迫处理后两个谷子品种根部细胞内pH值均升高,且抗盐品种YG2升高幅度较盐敏感品种AN04小。这也与盐胁迫处理前后细胞内pH值的变化大小反映出植物抵抗逆境胁迫能力强弱这一理论一致,证实了该测定方法的可靠性。因此该方法可以作为评价植物耐受盐胁迫能力的辅助手段。
总之,利用BCECF荧光染料方法测定植物根系细胞内pH值,优点在于操作相对简单,能够实时监测细胞内pH值变化,适用于各种不同大小的细胞,重复性较好,可以同时测定细胞内多个位点的pH值[8]。这一方法为今后研究植物在各种胁迫条件下细胞内pH值的变化提供了一条有效途径。应用该方法,本试验在国内首次研究了盐胁迫对谷子根系细胞内pH值的影响,显示盐胁迫处理后根系细胞内pH值明显升高,并且抗盐品种较盐敏感品种变化小,说明抗盐品种在应对盐胁迫过程中其胞内环境更加稳定。这为进一步研究盐胁迫与植物细胞内pH值变化间的关系奠定了一定基础。
参考文献:
[1]王合云,李红丽,董智,等. 滨海盐碱地不同造林树种林地土壤盐碱化特征[J]. 土壤学报,2015,52(3):706-712.
[2]Yang Y Q,Guo Y. Unraveling salt stress signaling in plants[J]. Journal of Integrative Plant Biology,2018,60(9):796-804.
[3]Rozema J,Flowers T. Crops for a salinized world[J]. Science,2008,322(5907):1478-1480.
[4]Munns R. Genes and salt tolerance: bringing them together[J]. New Phytologist, 2005,167(3):645-663.
[5]張建锋,张旭东,周金星,等. 世界盐碱地资源及其改良利用的基本措施[J]. 水土保持研究,2006,12(6):28-30.
[6]Liu Z X,Zhang H X,Yang X Y,et al. Effects of soil salinity on growth,ion relations,and compatible solute accumulation of two sumac species:Rhus glabra and Rhus trilobata[J]. Communications in Soil Science and Plant Analysis,2013, 44(21):3187-3204.
[7]柳参奎,张欣欣,程玉祥. “植物细胞内pH调控系统”是适应环境逆境的一个耐性机制?[J]. 分子植物育种,2004,2(2):179-186.
[8]周文彬,邱保胜. 植物细胞内pH值的测定[J]. 植物生理学通讯,2004,40(6):724-728.
[9]李顺国,刘斐,刘猛,等. 我国谷子产业现状、发展趋势及对策建议[J]. 农业现代化研究,2014,35(5):531-535.
[10]贾冠清,刁现民. 谷子(Setaria italica (L.) P. Beauv.)作为功能基因组研究模式植物的发展现状及趋势[J]. 生命科学,2017,29(3):292-301.
[11]姜淑媛,张丽霞. 茶树荧光性绿斑病叶胞内pH值变化[J]. 中国茶叶,2009,31(2):27-29.
[12]Krebs M, Beyhl D, Grlich E,et al. Arabidopsis V-ATPase activity at the tonoplast is required for efficient nutrient storage but not for sodium accumulation[J]. PNAS,2010,107(7):3251-3256.
[13]Bassil E, Tajima H, Liang Y C,et al. The ArabidopsisNa+/H+ antiporters NHX1 and NHX2 control vacuolar pH and K+ homeostasis to regulate growth,flower development,and reproduction[J]. The Plant Cell,2011,23(9):3482-3497.
