血管紧张素(1⁃7)对胰岛β 细胞自噬及磷酸化Akt 表达的影响
2019-04-02周夏利陆春丽孙明谨
周夏利 陆春丽 孙明谨
1湖北医药学院第五临床学院转化医学中心(湖北随州441300);2湖北医药学院附属随州医院(湖北随州441300)
胰岛β细胞功能取决于β细胞的数量和分泌胰岛素的能力。糖脂毒性(glucolipotoxicity,GLT)是指高血糖可协同增加游离脂肪酸(FFA)对细胞的毒性作用,诱导胰岛β细胞凋亡导致β细胞功能障碍及数量减少。GLT 可诱导内质网应激、氧化应激等引起β细胞自噬水平显著升高以耐受凋亡。自噬(autophagy)是一个高度保守的分解代谢过程,能再循环利用细胞内多余或受损成分,促进应激状态下细胞内环境稳定和细胞存活[1]。然而过多的自噬活化可导致β细胞死亡。血管紧张素(1⁃7)[angiotensin(1⁃7),Ang(1⁃7)]是肾素-血管紧张素系统(RAS)的生物活性成分,由血管紧张素转换酶2(ACE2)和其他酶分解血管紧张素I(AngⅠ)或血管紧张素Ⅱ(AngⅡ)生成,与G 蛋白偶联受体Mas 结合,在心脏、肾脏、脑和其他器官组织中发挥一系列与AngⅡ相反的作用[2]。研究表明Ang(1⁃7)干预可减轻β细胞功能障碍[3],减少MS⁃1 细胞脂性凋亡[4],对调节胰岛素分泌有显著作用[5]。Ang(1⁃7)可抑制自发性高血压大鼠脑组织自噬[6],保护心肌细胞免受AngⅡ诱导的自噬[7],但Ang(1⁃7)对胰岛β细胞自噬的作用国内外研究暂未见报道,因此探索Ang(1⁃7)对自噬的影响对保护胰岛β细胞具有非常重要的意义。本研究旨在探讨Ang(1⁃7)对GLT 孵育的胰岛β细胞自噬和磷酸化Akt(p⁃Akt)表达的影响。
1 材料和方法
1.1 材料与试剂 MIN6 细胞购自江苏无锡英纽瑞生物医药科技有限公司;DMEM(高糖、低糖)培养基购自Gibco 公司;链-青霉素溶液购自Sigma 公司;胎牛血清(FBS)购自浙江天杭生物科技股份有限公司;Ang(1⁃7)和A779 购自上海吉尔生化公司;葡萄糖粉末、棕榈酸(PA)购自国药集团化学试剂有限公司;无游离脂肪酸牛血清白蛋白(BSA)购自上海爱必信生物科技有限公司;CCK⁃8购自广州奕源生物科技有限公司;兔Beclin1 抗体购自武汉博士德生物工程公司;鼠p62 抗体、兔/鼠GAPDH 抗体、AP 标记山羊抗兔IgG 二抗、AP 标记山羊抗小鼠IgG 二抗均购自上海碧云天生物技术有限公司;p⁃Akt 购自CST 公司。
1.2 方法
1.2.1 棕榈酸(palmitate acid,PA)的配制 称取一定质量的PA 溶于0.01 mol/L 的NaOH 溶液中使PA 的浓度为20 mmol/L,于70℃水浴锅中振荡溶解30 min。PBS 配制5% BSA 溶液,再按一定比例将保温的PA 溶液与BSA 混合。实验中按比例将PA稀释至终浓度为0.5 mmol/L。
1.2.2 细胞培养及分组 MIN6 细胞用含15%胎牛血清及1%链-青霉素的高糖(4.5 g/L)DMEM 培养液,在37 ℃、5%CO2、饱和湿度的细胞培养箱中培养。
细胞分为四组:(1)对照组(CON),(2)高糖高脂组(HGHF),(3)Ang(1⁃7)干预组,(4)A779 干预组。其中,CON 组细胞用含5 mmol/L 葡萄糖及BSA 的低糖DMEM 培养基培养;HGHF 组细胞用含25 mmol/L 葡萄糖和0.5 mmol/L PA·BSA 的培养基培养;Ang(1⁃7)干预组细胞先给予Ang(1⁃7)10-6mol/L 预孵育30 min,再给予含25 mmol/L 葡萄糖和0.5 mmol/L PA·BSA 的培养基共同培养;A779干预组细胞先给予A779 10-6M 预孵育30 min,再加入Ang(1⁃7)孵育30 min[5],最后给予含25 mmol/L葡萄糖和0.5 mmol/L PA·BSA 的培养基共同培养。四组细胞均干预12 h。
1.2.3 Western⁃Blot 检测MIN6 细胞p62、Beclin1及p⁃Akt 表达 用SDS⁃PAGE 凝胶电泳,300 mA 恒流转膜,5%BSA 室温封闭2 h,一抗(p⁃Akt、p62、GAPDH 均1∶1 000 稀释,Beclin1 1∶400 稀释)4 ℃摇床过夜孵育,二抗(AP 标记山羊抗小鼠1∶1 000,AP 标记山羊抗兔1∶800 稀释)室温孵育2 h,按照BCIP/NBT 碱性磷酸酯酶显色试剂盒说明书进行显色,以GAPDH 为内参,分析目的蛋白表达水平。
1.2.4 DAPI染色观察MIN6细胞凋亡 按照DAPI染液说明书,细胞以每孔1 × 106个接种于6 孔板中,按上述分组培养12 h 后,用PBS 清洗3 遍后,4%多聚甲醛固定细胞15~20 min,PBS 清洗3 遍,加一至两滴DAPI 染液,避光反应10 min,再用PBS清洗3 遍,吸干残余液体,于荧光显微镜下观察各组细胞有无凋亡。
1.2.5 CCK⁃8 检测细胞凋亡率 按照CCK⁃8 说明书,细胞以每孔100 μL,每孔细胞数>1 000 个接种于96 孔板,按不同分组将细胞预培养12 h,每孔加入10 μL 的CCK⁃8 溶液,继续孵育2 h,每隔一定时间置于酶标仪检测波长为450 nm 处的吸光度(A450nm,OD值),然后按公式计算凋亡率[公式为:凋亡率=(对照组OD值-加药处理组OD值)/(对照组OD值-空白组OD值)×100%]。
1.3 统计学分析 实验至少独立重复3 次。采用SPSS 20.0 软件分析,实验数据以均数±标准差表示。组间比较采用单因素方差分析,两两比较采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 GLT 及Ang(1⁃7)对自噬的影响 见图1,与CON 组相比,HGHF 组p62 及Beclin1 的表达水平明显升高(P<0.05);与HGHF 组相比,Ang(1⁃7)干预组p62 及Beclin1 的表达水平明显下降(P<0.05);与Ang(1⁃7)干预组相比,A779 干预组p62 及Be⁃clin1 的表达水平有所升高(P<0.05)。
2.2 GLT 及Ang(1⁃7)孵育MIN6 细胞12 h DAPI染色观察细胞凋亡 见图2,CON 组可见细胞核蓝染,荧光均匀呈类圆形或椭圆形,其余三组可见荧光颜色明亮,核染色质固缩,向外周聚集,形成周边化(箭头所示,为细胞凋亡的标志)。与CON 组比较,HGHF 组细胞核数量明显减少,可见大部分细胞核染色质固缩。与HGHF 组比较,Ang(1⁃7)干预组核染色质固缩明显减少,且细胞数量明显多于HGHF 组。与Ang(1⁃7)组比较,A779 干预组核染色质固缩及周边化增多。

图1 GLT 及Ang(1⁃7)干预MIN6 细胞12 h p62 和Beclin1的表达Fig.1 Expressions of p62 and Beclin1 proteins exposure of MIN6 pancreatic beta cells to glucolipotoxicity in the presence or absence of angiotensin(1⁃7)for 12 hours
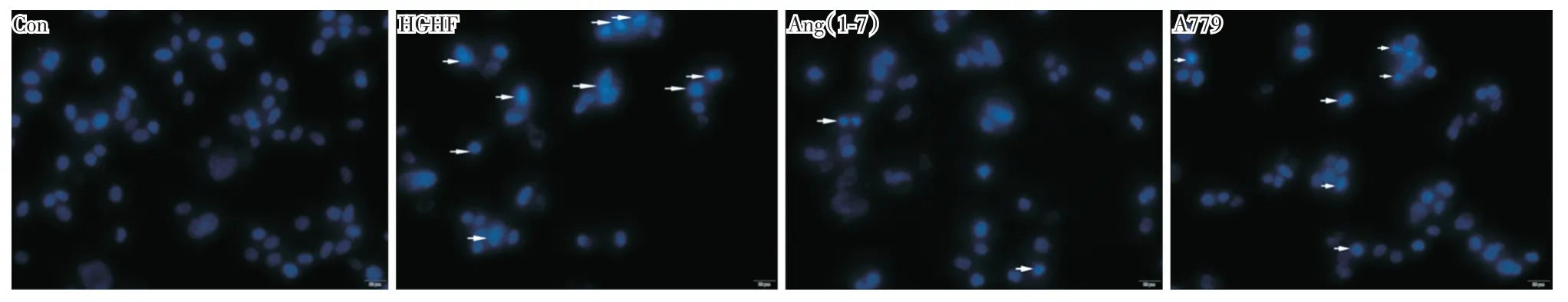
图2 GLT 及Ang(1⁃7)干预MIN6 细胞12h DAPI 染色观察细胞凋亡Fig.2 To observe apoptotic cells induced by glucolipotoxicity in the presence or absence of angiotensin(1⁃7)in MIN6 pancreatic beta cells for 12 hours by DAPI staining
2.3 GLT 及Ang(1⁃7)孵育12 h 检测细胞凋亡率 如图3所示,与CON组相比,HGHF组细胞凋亡率明显增加(P<0.05),与HGHF 组相比,Ang(1⁃7)干预组细胞凋亡率明显降低(P<0.05),与Ang(1⁃7)干预组相比,A779 干预组细胞凋亡率增加(P<0.05)。
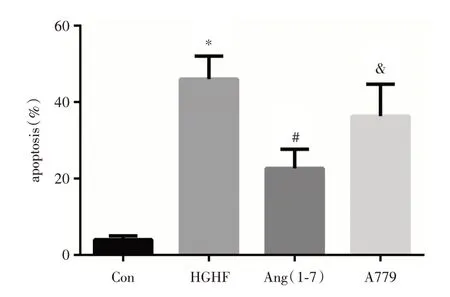
图3 GLT 及Ang(1⁃7)干预MIN6 细胞12 h 的凋亡率Fig.3 Apoptosis rate of MIN6 pancreatic beta cells incubated with glucolipotoxicity alone or in combination with angiotensin(1⁃7)for 12 hours
2.4 GLT 及Ang(1⁃7)对p⁃Akt 表达的影响 如图4所示,与CON 相比,HGHF 组p⁃Akt 水平显著降低(P<0.05);与HGHF 组相比,Ang(1⁃7)干预组p⁃Akt 表达升高(P<0.05);与Ang(1⁃7)干预组相比,A779 干预组p⁃Akt 的表达水平下降(P<0.05)。

图4 GLT 及Ang(1⁃7)干预MIN6 细胞12 h p⁃Akt 的表达Fig.4 The level of phosphorylated Akt in MIN6 pancreatic beta cells incubated with glucolipotoxicity alone or in combination with angiotensin(1⁃7)for 12 hours
3 讨论
胰岛β 细胞数量减少和功能障碍是胰岛素抵抗发展到显性糖尿病的关键事件。细胞凋亡、内质网应激、氧化应激以及线粒体功能障碍等都与胰岛β细胞功能障碍有关。其中,细胞凋亡是导致2 型糖尿病胰岛β细胞功能障碍的主要机制。研究表明,GLT(PA 和葡萄糖)可诱导氧化内质网应激和泛素化蛋白积聚导致细胞凋亡性死亡[8],Ang(1⁃7)可减少MS⁃1 细胞内PA 诱导的活性氧簇(ROS)产生[4],也可减轻胰岛β细胞凋亡[9]。与上述研究结果一致,本研究(图2、图3)通过体外培养MIN6 胰岛β细胞,从细胞层面证实了GLT 可产生明显的细胞毒性诱导β细胞凋亡,Ang(1⁃7)与Mas 受体结合发挥抗凋亡作用。
生理状态下,自噬主要通过清除细胞内受损的蛋白和细胞器等机制保护细胞免受外界应激的损伤,抑制细胞凋亡[10],对胰岛β细胞的存活、功能和维持细胞内环境稳定至关重要[11]。自噬与凋亡之间通过关键蛋白p62 和Beclin1 产生相互作用与联系。p62 作为一种关键的自噬底物蛋白,主要功能是参与泛素化蛋白及衰老、受损细胞器的周转循环,p62 积聚提示细胞受损[8]。Beclin1(BECN1)是一种自噬所必需的蛋白,与Ⅲ型PI3K 结合,在自噬体形成过程中起重要作用。PA/GLT 干预可增加p62 的表达[8]和自噬体的数量,通过诱导内质网应激及JNK 活化[12]而激活自噬。GLT 虽可刺激β细胞自噬但也可诱导溶酶体功能障碍而损伤自噬流[8],本研究结果(图1)与上述研究结果一致,考虑为GLT 可能诱导内质网应激、激活JNK 上调自噬水平,但笔者未检测自噬流、内质网应激和p⁃JNK 水平,下一步实验可通过检测内质网应激、p⁃JNK 的表达明确GLT 上调自噬的分子机制,同时进一步检测溶酶体功能证实GLT 通过损伤溶酶体功能诱导MIN6β细胞自噬流受损。
Ang(1⁃7)干预可调节胰岛素敏感性和胰岛素产生[9],而胰岛素是公认的自噬抑制剂。已有研究表明,Ang(1⁃7)依赖Mas 受体可抑制高血压所诱导的自噬,Ang(1⁃7)干预可能有利于阻止高血压引起脑组织内过度的自噬活化[6];Mas 受体可介导Ang(1⁃7)抑制氧化应激从而阻止AngⅡ诱导的心肌细胞自噬[7]。本研究结果首次表明Ang(1⁃7)与Mas 受体结合可抑制GLT 介导的自噬活化,说明在胰岛β细胞中Ang(1⁃7)以Mas 受体依赖方式发挥抗自噬作用,可能通过阻止GLT 诱导的过度的自噬活化减少β细胞损伤从而保护胰岛β细胞。Ang(1⁃7)抑制自噬的机制还不清楚,考虑为:(1)诱导胰岛素分泌抑制自噬。已有很多研究均证实Ang(1⁃7)/Mas 轴对调节体内外胰岛的胰岛素分泌有突出作用[5]。(2)拮抗AngⅡ的不利影响。GLT 可使胰岛局部RAS 过度活化引起AngⅡ增加,AngⅡ可诱导内质网应激、氧化应激、凋亡从而激活自噬[13],Ang(1⁃7)与Mas 受体结合可拮抗AngⅡ对胰岛β细胞的有害作用。
PI3K/Akt 信号通路广泛存在于真核细胞中,Akt 在调节细胞生长、存活和凋亡方面起关键作用。活化的Akt 可通过磷酸化其丝氨酸或苏氨酸位点激活或抑制其下游靶蛋白从而介导细胞凋 亡[14];有研究证实PA 干预INS⁃1 细胞p⁃Akt 及p⁃mTOR 的表达水平随时间增加而减少,内质网应激和Ⅲ型PI3K 参与PA 诱导的自噬激活,说明Akt/mTOR 信号通路、内质网应激均与PA 诱导的自噬上调有关。另有研究给予PI3K/Akt 信号通路抑制剂LY294002 处理MIN6 细胞后,PA 诱导的自噬水平进一步增加,p⁃Akt 的表达降低,而牛磺熊去氧胆酸和SP600125 均可抑制PA 诱导的p⁃Akt 减少,表明PA 通过激活内质网应激和它下游的JNK 磷酸化可诱导胰岛β细胞自噬,内质网应激和JNK 活化介导PA 诱导的Akt 磷酸化减少参与PA 刺激β细胞自噬[12]。也有研究给予PA 干预可下调MS⁃1 细胞p⁃Akt 的表达,而Ang(1⁃7)可逆转PA 的这一作用从而保护MS⁃1 细胞免受PA 诱导的凋亡[5]。研究表明Ang(1⁃7)发挥细胞保护和抗凋亡作用与诱导Akt 磷酸化有关[15]。与上述研究结果一致,本研究表明Ang(1⁃7)通过调控p⁃Akt 的表达可介导GLT 诱导的胰岛β细胞自噬和凋亡。原因可能是:(1)PI3K/Akt 信号通路既参与细胞自噬也能参与细胞凋亡的调控。GLT 可能通过激活内质网应激和它下游的JNK 活化抑制p⁃Akt 的表达,从而刺激β细胞自噬和凋亡,内质网应激和JNK 活化介导GLT 诱导的p⁃Akt 减少参与GLT 诱导的自噬增加和凋亡;(2)Ang(1⁃7)可能通过调节胰岛素分泌和Akt 的磷酸化水平介导胰岛β细胞的保护作用。Ang(1⁃7)可增加胰岛素分泌,使Akt 活化增加,从而阻止GLT 诱导过度的自噬活化及凋亡,减少β细胞损伤。下一步实验需给予PI3K/Akt 及p⁃JNK抑制剂证实Ang(1⁃7)抗自噬和抗凋亡的效应由PI3K/Akt 及JNK 信号通路介导,重点阐述Ang(1⁃7)对自噬的具体机制。
综上所述,本研究揭示了通过调控p⁃Akt 的表达,Ang(1⁃7)与Mas 受体结合可抑制GLT 诱导的β细胞自噬,证明了Ang(1⁃7)可以拮抗GLT 诱导的胰岛β细胞凋亡。因此,激活体内外胰岛局部Ang(1⁃7)/Mas 受体轴,以Ang(1⁃7)为干预靶点调控胰岛功能,可能成为逆转β 细胞损害的潜在治疗策略。
