小檗碱调控TLR4/NF⁃κB 信号通路抑制宫颈癌Hela 细胞增殖研究
2019-04-02洪丹丹任青玲徐传花徐雯雯王伟荣慧郭红玉赵玉芹马蔚蓉曹丹丹陈冰倩
洪丹丹 任青玲 徐传花 徐雯雯 王伟 荣慧 郭红玉 赵玉芹 马蔚蓉 曹丹丹 陈冰倩
南京中医药大学第一附属医院妇科(南京210000)
流行病学研究发现我国目前宫颈癌发生率位居世界第一,占每年新增病例29%左右[1]。小檗碱是从黄连、黄柏等中药中提取的季胺类化合物[2],可通过调控p65 等凋亡分子[3]和抑制微管蛋白聚集[4]等途径抑制宫颈癌细胞增殖,但是机制仍尚未明确。Toll 样受体(Toll⁃like receptors,TLRs)可调控炎症反应和免疫应答,介导机体天然免疫转向获得性免疫[5]。TLR4是人类发现的第一个TLR相关蛋白,其下游通路主要通过髓样分化因子88激活后介导,进一步核因子κB(nuclear factor κB,NF⁃κB)活化[6]。NF⁃κB是一类具有多向转录调节作用的Rel 家族转录因子,参与细胞增殖与凋亡过程[7]。小檗碱对于宫颈癌细胞具有明确的抑制作用,但TLR4⁃NF⁃κB是否小檗碱抗癌的具体通路尚未见相关报道。
1 材料与方法
1.1 试剂和材料 Hela 细胞由江苏凯基生物提供。小檗碱购自阿拉丁试剂有限公司(纯度≥95%,货号:B139120);Trizol 购自美国Invitrogen(货号:15596⁃026);Lipo 2000(货号:12566014)和cDNA 第一链合成试剂盒(货号:K1622)购自美国TFS;Real time PCR Master Mix 购自日本TOYOBO(货号:QPR⁃201)。
1.2 TLR4 siRNA 设计 通过Ambion 网站数据针对TLR4 基因设计3 条特异性siRNA 序列:TLR4⁃siRNA⁃001(上游:CCUGGUGAGUGUGACUAUUTT;下游:AAUAGUCACACUCACCAGGTT)、TLR4⁃siR⁃NA⁃002(上游:CCUGAACCCUAUGAACUUUTT;下游:AAAGUUCAUAGGGUUCAGGTT)、TLR4⁃siRNA⁃003(上游:GGACCUCUCUCAGUGUCAATT;下游:UUGACACUGAGAGAGGUCCTT)。随机设计阴性对照siRNA(negative siRNA),上游:UUCUCCGAA⁃CGUGUCACGUTT;下游:ACGUGACACGUUCGGA⁃GAATT。
1.3 细胞培养和转染 将宫颈癌Hela 细胞以每孔2×105个接种于6 孔板,细胞培养至70%~80%融合度时,进行Lipo 转染。实验分为3 组:空白对照组(control 组)、阴性siRNA 组(negative siRNA组)和TLR4⁃siRNAs 组(siRNA⁃001 组,siRNA⁃002组和siRNA⁃003 组)。
1.4 qRT⁃PCR 检测 siRNA 转染24 h 后收集细胞,Trizol 法提取总RNA,反转录合成cDNA,进行PCR 扩增。TLR4 引物的上游为AGCACTTGGACC⁃TTTCCAGC,下游为TAGGGTTCAGGGACAGGTCT。内参GAPDH 引物的上游为TGTTGCCATCAAT⁃GACCCCTT,下游 为CTCCACGACGTACTCAGCG。反应条件为95 ℃5 min,95 ℃15 s,60 ℃20 s,72 ℃40 s,共40 个循环。
1.5 Western检测 siRNA转染8 h后收集细胞,提取总蛋白,BCA 法定量。取40 μg 蛋白上样,进行10%的SDS⁃PAGE,浓缩胶80 V、分离胶120 V 恒压电泳,300 mA 恒流转膜1.5 h。加入兔抗人TLR4 或GAPDH抗体过夜,次日羊抗兔IgG孵育,显色曝光,采集图像。使用Gel⁃Pro32 软件对结果进行灰度分析。
1.6 MTT 法描绘细胞生长曲线 收集转染24 h细胞,消化、计数、配制成浓度为3×104个/mL 的细胞悬液,分别培养0、24、48 和72 h;进行MTT 染色,测定OD值,计算抑制率描绘生长曲线。
1.7 Transwell 小室评价细胞迁移能力检测 Hela密度1 × 105个/mL 细胞悬液100 μL 加入Transwell小室,下室加入500 μL 含20%FBS 的培养基,常规培养24 h,进行固定、染色。直径上取3 个视野照相(×200),计数。
1.8 荧光TUNEL 法检测细胞凋亡 自然晾干细胞样本(细胞涂片或爬片),多聚甲醛固定。在样本上加1%的Triton⁃100,洗涤、灭活酶、洗涤、蛋白酶K 修复后进行TUNEL 反应1 h,DAPI 复染,荧光显微镜观察。细胞凋亡指数(AI)=(凋亡细胞数÷细胞总数)×100%,凋亡细胞的细胞核为棕色,正常细胞的细胞核为蓝紫色。
1.9 统计学方法 采用SPSS 23.0软件对数据进行分析,以均数±标准差形式表述数据,组间比较采用student⁃t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 转染效率分析及目标TLR4⁃siRNA 筛选 转染24 h,随机选取10 个低倍视野,计数转染细胞占总细胞数的百分比,结果显示转染效率达到(90.55 ± 5.19)%。3 组TLR4⁃siRNA 均可以有效沉默TLR4 的表达,分别为57.2%、74.0%和55.6%(P<0.05),siRNA⁃002 下调最为明显故将siRNA⁃002 选为目标siRNA 进行后续实验。
2.2 不同浓度小檗碱对宫颈癌Hela 细胞增殖水平影响 见图1,小檗碱(5、10 和40 μg/mL)呈浓度依耐性抑制Hela 细胞增殖,其中40 μg/mL 最为明显,24、48 和72 h 的抑制率分别为20.15%、32.21%和39.82%(P<0.05)。增加阴性siNRA 干预后,Hela 细胞增殖抑制率未见明显改变。增加siRNA⁃002 干预后,可明显增加三种浓度小檗碱对于Hela 细胞增殖的抑制作用,其中40 μg/mL 小檗碱+siRNA⁃002 最为明显,24、48 和72 h 的抑制率分别为28.04%、65.87%和78.55%(P<0.05)。

图1 不同浓度小檗碱对宫颈癌Hela 细胞增殖水平影响Fig.1 Effects of different concentrations of berberine on the proliferation level of Hela cells in cervical carcinoma
2.3 不同浓度小檗碱对宫颈癌Hela 细胞迁移水平影响 见图2,小檗碱(5、10 和40 μg/mL)可呈浓度依耐性抑制Hela 细胞迁移,迁移细胞数分别为141.00 ± 3.61、106.33 ± 3.51 和65.33 ± 3.51(P<0.05)。增加阴性siNRA 干预后,Hela 细胞增殖抑制率未见明显改变(P>0.05)。增加siRNA⁃002 干预后,可见siRNA⁃002 可明显增加3 种浓度小檗碱对于Hela 细胞增殖的抑制作用,其中40 μg/mL 小檗碱+siRNA⁃002 最为明显(P<0.05),迁移细胞数为43.67±3.79。
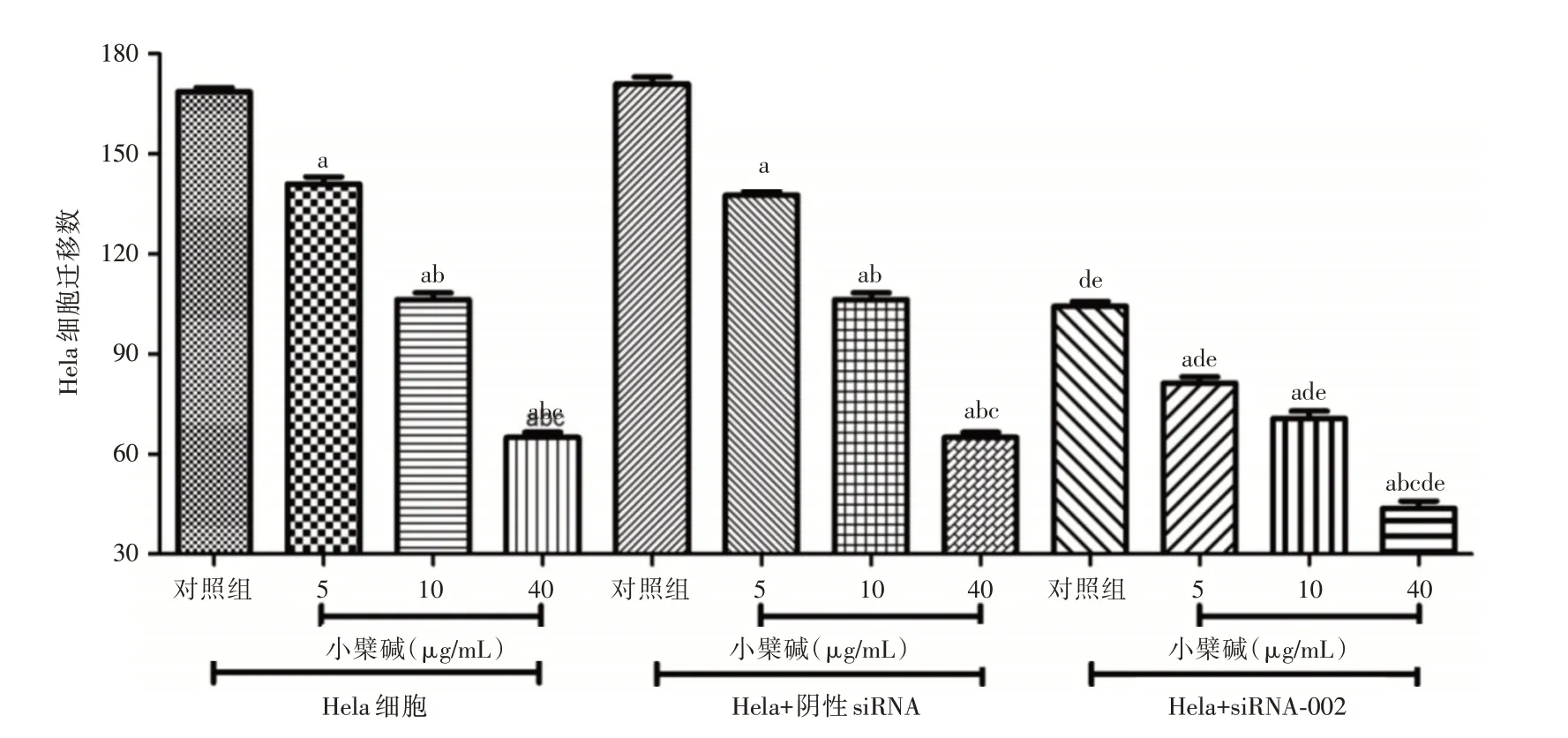
图2 不同浓度小檗碱对宫颈癌Hela 细胞迁移水平影响Fig.2 Effects of different concentrations of berberine on migration levels of Hela cells in cervical carcinoma
2.4 不同浓度小檗碱对宫颈癌Hela 细胞凋亡水平影响 见图3,小檗碱(5、10 和40 μg/mL)可明显抑制Hela 细胞凋亡程度,凋亡率分别为(3.8 ±0.3)%、(7.2±0.5)%和(9.1±0.9)%。增加阴性siN⁃RA 干预后,Hela 细胞凋亡率未见明显改变。加用siRNA⁃002 后可进一步增加Hela 细胞凋亡程度,凋亡率分别为(6.4 ± 0.8)%、(12.2 ± 1.1)%和(15.2 ±1.2)%。
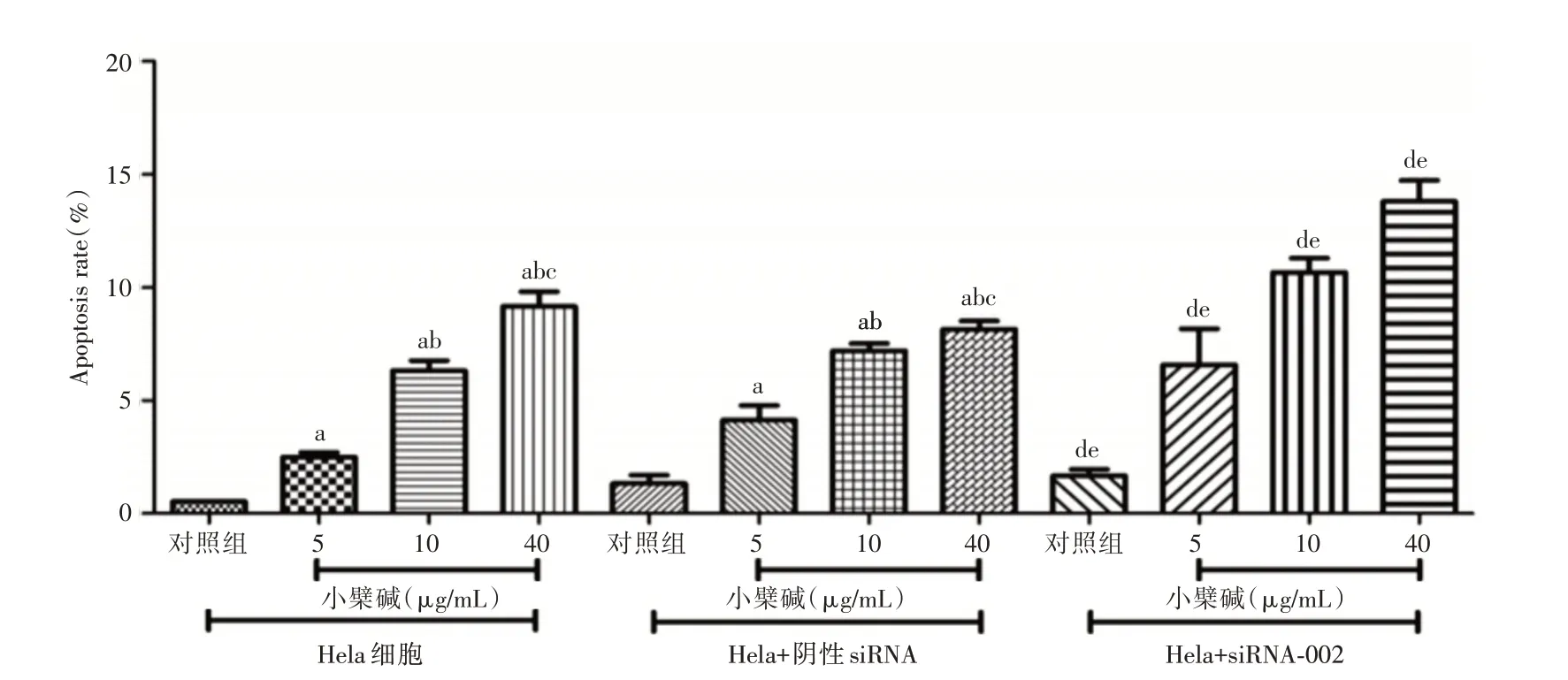
图3 TUNEL 评价不同浓度小檗碱对宫颈癌Hela 细胞凋亡水平影响Fig.3 Evaluation of different concentrations of berberine on the apoptosis level of Hela cells in cervical carcinoma by TUNEL
2.5 不同浓度小檗碱对宫颈癌Hela 细胞p65、Bcl⁃2 和TLR⁃4 mRNA 水平表达影响 见图4,小檗碱可呈浓度依赖性抑制Hela 细胞p65、Bcl⁃2 和TLR4 的mRNA 表达水平(P<0.05)。增加阴性siNRA 干预后,p65、Bcl⁃2 和TLR4 的mRNA 水平未见明显改变。而加用siRNA⁃002 后可进一步加强小檗碱对于Hela 细胞p65、Bcl⁃2 和TLR4 mRNA 水平的下调作用(P<0.05)。
2.6 不同浓度小檗碱对宫颈癌Hela 细胞p65、Bcl⁃2 和TLR4 蛋白水平表达影响 见图5,小檗碱均可呈浓度依赖性抑制Hela 细胞p65、Bcl⁃2 和TLR⁃4蛋白表达(P<0.05)。增加阴性siNRA 干预后,p65、Bcl⁃2 和TLR4 蛋白未见明显改变。而加用siRNA⁃002 后可进一步加强小檗碱对于p65、Bcl⁃2和TLR 蛋白的下调作用(P<0.05)。

图4 不同浓度小檗碱对宫颈癌Hela 细胞p65、Bcl⁃2 和TLR4 mRNA 水平表达影响Fig.4 Effects of different concentrations of berberine on the mRNA levels of p65,bcl⁃2 and TLR4 mRNA in Hela cells of cervical carcinoma

图5 不同浓度小檗碱对宫颈癌Hela 细胞p65、Bcl⁃2 和TLR⁃4 蛋白水平表达影响Fig.5 Effects of different concentrations of berberine on the expression protein levels of p65,bcl⁃2 and tlr⁃4 in Hela cells of cervical carcinoma
3 讨论
TLRs 作为一种新的模式识别受体,是天然免疫和获得性免疫之间的纽带,也是细胞内信号通道的起始部位[8]。本研究选择的TLR4 主要表达于结肠癌、乳腺癌和宫颈癌等多种细胞膜表面,与细胞增殖程度呈正相关[9]。本研究结果提示小檗碱成浓度依耐性抑制细胞增殖,促进凋亡,减低迁移能力,说明小檗碱具有明显的抗宫颈癌效果。小檗碱能够抑制宫颈癌细胞增殖,促进凋亡,阻滞细胞周期,增加宫颈癌细胞的放射敏感性[10]。小檗碱作为我国传统中药黄连等的有效成分,亦有许多国外研究报道其对于宫颈癌有效。比如RAGHAV 等[4]通过傅里叶变换红外光谱发现小檗碱可改变Hela 细胞内微管蛋白异构体构象,抑制细胞内骨架的搭建,从而发挥抗肿瘤作用。本研究结果与上述研究相符,均证实小檗碱对于Hela细胞具有抑制作用。
对于小檗碱抗宫颈癌的相关具体机制研究报道较少,小檗碱可能通过降低金属基质蛋白酶-9和NF⁃κBp65 水平,对Hela 细胞体外增殖具有明显的抑制作用,能够减弱Hela 细胞的侵袭和转移能力[11]。本研究发现,小檗碱可以明显抑制Hela 细胞中TLR4mRNA 和蛋白的表达水平,并进一步下调p65 和Bcl⁃2 表达。p65 是NF⁃κB 家族的组分之一,静息状态下p65 与IκB 结合固定,当受到核外刺激后,IκB 被磷酸化而降解,从而释放p65 与κB位点基因特异性结合,发挥下游调节作用,其中Bcl⁃2 家族就是下游调节靶点之一[12-14]。Bcl⁃2 家族蛋白可通过与其他凋亡调节蛋白之间的相互作用,其主要发挥抗凋亡作用[15-16]。因此本研究中小檗碱可明显下调Bcl⁃2 表达,即抑制Hela 细胞自身的抗凋亡能力。已有研究证实TLR4⁃NF⁃κB为宫颈癌细胞的重要代谢通路,比如有研究发现TLR4⁃siRNA可进一步通过调控NF⁃κB通路下调Bcl⁃2水平,显著抑制细胞增殖,促进细胞凋亡[17]。本研究结果与之相符,并进一步证明小檗碱与TLR4⁃siRNA 作用相同,均可抑制TLR4表达,发挥抗宫颈癌作用。
综上所述,本研究发现小檗碱可调控TLR4⁃NF⁃κB 信号通路下调Bcl⁃2 表达,显著抑制Hela 细胞的增殖,促进其凋亡,为小檗碱治疗宫颈癌提供新的理论依据。
