宫颈癌容积旋转调强放疗中患者腹围变化对摆位误差的影响
2019-03-21成肇杰梁卫学韦顺文王占宇
王 甜,成肇杰,梁卫学,韦顺文,王占宇
(柳州市工人医院肿瘤科,广西柳州 545005)
0 引言
宫颈癌是女性常见的恶性肿瘤,早期宫颈癌术后联合辅助放疗可明显减少复发,提高患者生存率[1]。容积旋转调强放疗(volumetric-modulated arc therapy,VMAT)使照射野形状与靶区高度适形,对肿瘤高剂量照射的同时提高了治疗效率,有效降低了肠道等器官受照体积[2],减少了不良放疗反应。然而,调强放疗对放疗摆位的准确性及重复性要求较高,摆位误差控制是重要的质控内容[3]。宫颈癌患者放化疗过程中不良反应如腹泻等可使患者体质量下降,从而使腹围发生变化,影响摆位精度。因此,本研究利用锥形束 CT(cone beam CT,CBCT)分析腹围变化与摆位误差的关系,以期了解摆位误差与腹围变化的规律,为宫颈癌临床放射治疗提供一定的参考。
1 材料与方法
1.1 一般资料
选取2017年10月至2018年4月柳州市工人医院肿瘤科宫颈癌术后患者30例,年龄35~64岁(中位年龄52岁),按国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期标准分期在Ⅰb至Ⅲb期之间,患者行宫颈癌根治术后进行辅助放化疗,入组患者均签署放疗知情同意书。
1.2 方法
1.2.1 模拟定位
嘱患者定位前排空肠道,定位前1h排空小便,喝300 ml温开水,保证膀胱充盈度。患者仰卧位,双手上举抱头,用热塑体膜固定。采用西门子Biograph mCT S20 PET-CT机扫描定位,扫描条件为管电压120 kV、管电流200 mAs,层厚5 mm,扫描范围为胸椎10至闭孔下缘2~3 cm,所得CT图像传输至RayStation三维治疗计划系统。
1.2.2 靶区勾画及计划设计
按照ICRU 50、62号报告勾画术后宫颈癌临床靶区(clinical target volume,CTV),将 CTV 在三维方向外扩5 mm得到计划靶区(planning target volume,PTV),并勾画小肠、股骨头、直肠及膀胱等危及器官(organ at risk,OAR)。膀胱为充盈状态下的整个膀胱,直肠的上界为直肠乙状结肠交界处、下界至肛门[4]。采用瓦里安Trilogy直线加速器,射线能量均为6 MV,处方剂量为50.4Gy,治疗次数为28次,照射的体积≥95%,PTV接受处方剂量110%的体积小于5%,靶区外无剂量热点,CTV内无剂量冷点;OAR的限量为:直肠V50<50%(V50表示接受50 Gy剂量照射的体积百分比),小肠V50<10%,股骨头V50<5%,膀胱V50<50%。用RayStation计划系统设计6 MV X线非均整模式下的VMAT计划[5]。
1.2.3 治疗方法
患者每个分次治疗前,放疗技师进行腹围测量:用软尺在呼气末、吸气未开始时经髂嵴点测量腹部水平围长并记录,入组患者在同等条件下测量(同一患者同一时间进行测量并治疗,嘱患者提前排空肠道,空腹,治疗前1 h排空小便,喝300 ml水,保证与定位时相同膀胱充盈度。排除患者身体不适、腹部胀气影响腹围测量者)。对患者摆位后,行CBCT位置验证:患者治疗前行CBCT图像验证,所得图像与计划CT图像配准后,记录患者治疗床上下、前后、左右方向摆位误差,3个方向误差≤5 mm时,即行放疗;如若某方向摆位误差>5 mm,则调整治疗床位置或重新摆位(调整后再次行CBCT验证扫描)。按中华医学会放射治疗技术学组制定的图像引导放疗(image guide radiation therapy,IGRT)技术操作指南:第 1 周为5次/周,每次治疗前行CBCT验证;第2~6周为1次/周,治疗前行CBCT验证;当发现腹围变化大且任一方向摆位误差>5 mm时,后续每次治疗前行CBCT验证,配准并纠正三维方向位移,使整个疗程精确实施。
1.2.4 摆位误差与剂量学分析
计算3个方向上每位患者摆位误差,并分析与腹围变化的关系。统计位移后(标记为产生位移后组)与治疗计划(标记为治疗计划组)靶区及正常组织受量,包括PTV的95%体积剂量(D95)、最大剂量(Dmax)、最小剂量(Dmin)、平均剂量(Dmean);直肠、膀胱接受 45 Gy剂量体积(V45)。
1.2.5 统计学方法
采用SPSS 17.0统计学软件进行数据分析。计数资料用均数±标准差(±s)表示,采用配对样本t检验分析差异。采用Pearson法分析腹围变化与摆位误差的关系,P<0.05为差异有统计学意义。
2 结果
2.1 腹围变化与摆位误差
随着治疗周次的深入,其中16例患者第5周腹围下降>3 cm,结束时平均腹围下降4.3 cm,在线配准后发现治疗床有一个或多个方向摆位误差>5 mm,记录上下、前后、左右方向摆位误差数据及与之相对应的腹围测量数据,具体见表1。其余14例患者腹围下降≤2 cm,上下、前后、左右方向摆位误差均能达到精准性放疗要求。16例患者摆位误差校正前后比较,差异有统计学意义(P<0.05)。详见表2。
表1 16例宫颈癌患者不同治疗周次腹围下降与3个方向摆位误差统计(±s)
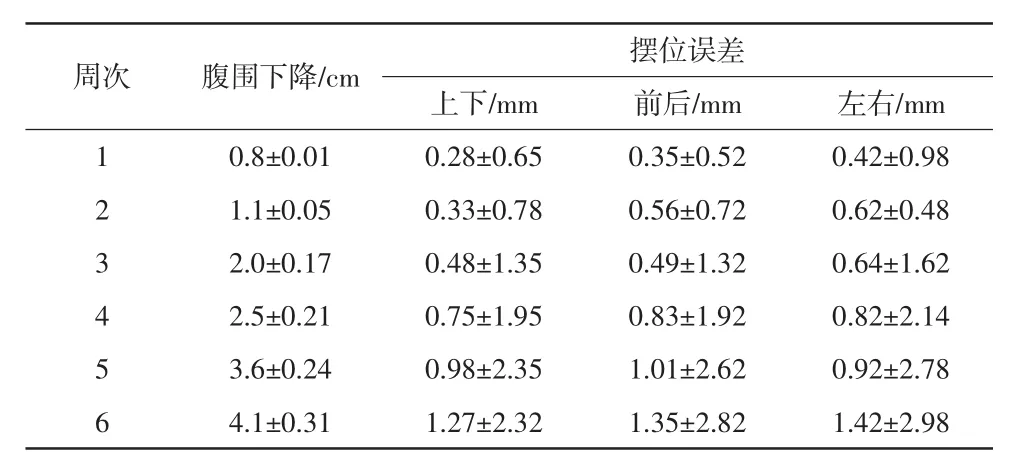
表1 16例宫颈癌患者不同治疗周次腹围下降与3个方向摆位误差统计(±s)
周次 腹围下降/cm 摆位误差上下/mm 前后/mm 左右/mm 1 0.8±0.01 0.28±0.65 0.35±0.52 0.42±0.98 2 1.1±0.05 0.33±0.78 0.56±0.72 0.62±0.48 3 2.0±0.17 0.48±1.35 0.49±1.32 0.64±1.62 4 2.5±0.21 0.75±1.95 0.83±1.92 0.82±2.14 5 3.6±0.24 0.98±2.35 1.01±2.62 0.92±2.78 6 4.1±0.31 1.27±2.32 1.35±2.82 1.42±2.98
表2 16例患者摆位误差校正前后比较(±s)mm

表2 16例患者摆位误差校正前后比较(±s)mm
分组 上下 前后 左右校正前 1.52±2.85 1.75±3.12 1.82±2.99校正后 0.37±0.84 0.45±0.62 0.67±0.72 t 3.084 4.014 3.927 P<0.05 <0.05 <0.05
2.2 腹围下降和摆位误差绝对值的Pearson相关性分析
16例患者上下、前后、左右方向摆位误差行绝对值转换后与腹围下降进行Pearson相关性分析,r分别为 0.785、0.817、0.851,P分别为 0.048、0.043、0.040,差异均有统计学意义(P<0.05)。说明患者摆位误差随着腹围下降而增大,特别是最后一周放疗腹围下降(4.1±0.31)cm,摆位误差上下、前后、左右方向分别为(1.27±2.32)、(1.35±2.82)、(1.42±2.98)mm。
2.3 剂量差异
未进行配准并纠正三维方向位移情况下,治疗计划组和产生位移后组剂量差异见表3。产生位移后组PTV 的D95明显小于治疗计划组(P<0.05);膀胱V45、直肠V45与治疗计划组相比无明显变化(P>0.05)。
表3 位移误差引起靶区剂量及正常组织剂量差异比较(±s)
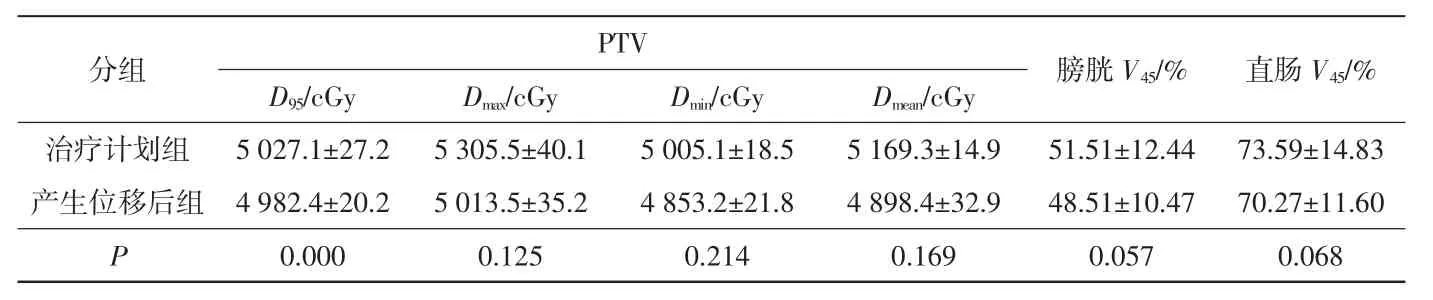
表3 位移误差引起靶区剂量及正常组织剂量差异比较(±s)
分组 PTV D95/cGy Dmax/cGy Dmin/cGy Dmean/cGy 膀胱V45/% 直肠V45/%治疗计划组 5 027.1±27.2 5 305.5±40.1 5 005.1±18.5 5 169.3±14.9 51.51±12.44 73.59±14.83产生位移后组 4 982.4±20.2 5 013.5±35.2 4 853.2±21.8 4 898.4±32.9 48.51±10.47 70.27±11.60 P 0.000 0.125 0.214 0.169 0.057 0.068
3 讨论
VMAT作为一种新型放疗技术,能通过单弧或多弧对机架旋转角度进行改良,动态调整多叶准直器(multi-leaf collimator,MLC),以达到优化输出剂量率和保证靶区精准照射目的[6]。VMAT方案在具有与调强放疗(intensity modulated radiation therapy,IMRT)相近的放射均匀性和周围组织受量的同时,还可有效缩短放疗时间,保护重要器官功能[7]。国外学者报道,VMAT在小肠、直肠及股骨头照射受量方面均低于IMRT[8],且在重要器官照射剂量分布方面具有明显优势[9]。本研究用RayStation计划系统设计6 MV X线非均整模式下的VMAT计划[5],在OAR保护以及正常组织低剂量照射上,非均整模式散射线更少。非均整模式下的VMAT计划相较均整模式下的VMAT计划更具优势,出束时间下降,治疗效率提高,有利于降低二次癌症的发生率。
Qin等[10]Meta分析显示术后同期放化疗较术后单纯放疗有利于提高早期高危宫颈癌总生存期(overall survival,OS)[风险比(hazard ratio,HR)=0.47,P=0.000]和无进展生存期(progression-free survival,PFS)(HR=0.5,P=0.000)。因此,本研究患者均为宫颈癌根治术后行辅助放化疗。据报道,早期宫颈癌术后同期放化疗胃肠道不良反应发生率为13%[11],如腹泻、食欲减退等会引起体质量下降。大多数宫颈癌患者皮下脂肪较多,尤其是腹围脂肪含量较高,当体质量下降时,消瘦部位往往集中在腹部、盆部及大腿,且腹围测量点在宫颈癌靶区上,故监测腹围变化较为方便实用。当患者体质量下降明显时,放疗技师与医师在精确治疗与摆位过程中须注意到患者治疗中心的误差,通过CBCT扫描验证以达到患者治疗的重复性及最优性[12]。本研究利用CBCT研究摆位误差与腹围变化的关系,发现患者在相同固定条件下,治疗重复性能得到较好保证,且在放疗实施前行CBCT验证可准确发现摆位误差并能予以在线纠正。患者腹围保持良好或腹围变化≤2 cm时,CBCT验证图像与计划CT图像骨性配准后,摆位误差在上下、前后、左右方向均能达到精准性放疗要求。本研究结果显示,由于不良反应可导致部分患者体质量下降,从而造成腹围下降,当腹围降低>3 cm时,患者3个方向上平均摆位误差均>3 mm,且有一个或多个方向误差>5 mm,需要进行在线配准并纠正三维方向位移,产生位移后组PTV的D95明显小于治疗计划组,P<0.05,差异有统计学意义。证明当腹围下降明显时,需进行在线校正后方能治疗,从而达到治疗的精准化。叶志雄等[13]通过研究直肠癌体质量下降与位移误差相关性中发现,患者体质量下降>3 kg时,摆位误差在3个方向上均>3 mm,且靶区剂量和周围正常组织剂量均存在一定差异。本研究与之结果相近,Pearson相关性分析显示,腹围下降时患者摆位误差相应增大,二者高度相关。当腹围下降过大时,务必进行CBCT图像引导放疗或重新摆位。
CBCT呈现的三维图像具有横断面上观察解剖结构,了解CTV、PTV外包边界,与计划CT图像高度适配等优势,在达到靶区内肿瘤组织精准剂量的同时,还保护了周围正常组织[14]。但是,CBCT在实现精准放疗的同时也存在一些问题,如无法测量治疗过程中肿瘤及周围正常组织动态变化的全过程[15]、价格昂贵、操作复杂、消耗时间较多、患者所受辐射剂量增大等。因此,明确CBCT优劣势,合理安排CBCT引导策略,使患者体位重复性得到最大保证的同时,可有效减少CBCT引导次数。当患者后期腹围变化明显时,应隔日或每日行1次CBCT配准以纠正摆位误差,如相差太大需重新更换体膜并更改治疗计划,保证治疗精准性。当然,治疗过程中存在随机性和系统性误差,如患者自身不可抗拒的皮肤组织松弛、基于CBCT的直肠蠕动引起的位移变化[16]、膀胱充盈程度和呼吸运动等情况引起的误差。
综上所述,宫颈癌患者放疗过程中,腹围下降时会影响摆位误差,从而影响靶区,因此应密切关注患者腹围变化情况,特别是后8次治疗;当腹围变化过大时,应适当增加CBCT引导次数,或重新更换体膜并更改治疗计划以达到精准放疗的目的。
