腐败梭菌α毒素和产气荚膜梭菌ε毒素的共表达及其免疫效力评价
2019-03-12彭国瑞彭小兵李旭妮董令赢蒋玉文
彭国瑞,彭小兵,李旭妮,董令赢,蒋玉文
(中国兽医药品监察所,北京100081)
腐败梭菌(Clostridium septium)可引起人和多种动物的恶性水肿、肌肉坏死、气性坏疽和坏死性肠炎以及羊快疫等疾病,该菌可分泌α、β、γ和δ等多种外毒素,其中α毒素是主要的致病性毒力因子和免疫保护性抗原[1-3]。产气荚膜梭菌(Clostridium perfringens)也是一种重要的人畜共患病源菌[4],根据产生外毒素 α、β、ε、ι种类的不同分为 A、B、C、D、E 5个型,其中D型常引起新生羔羊痢疾和山羊、牛等家畜的肠毒血症,致死性强,ε毒素是该型主要致死性毒力因子和保护性抗原[5-6]。由这两种病原菌引发的疾病往往发病急,病程短,来不及治疗动物即发生死亡,故免疫接种是预防这两种病最为有效的途径之一。目前,国内用于预防羊快疫和肠毒血症的疫苗有羊梭菌病多联干粉灭活疫苗、羊快疫、猝狙、肠毒血症三联灭活疫苗和羊快疫、猝狙、羔羊痢疾、肠毒血症三联四防灭活疫苗,近年来随着养羊业的快速发展,该类疫苗的需求逐年增加,但疫苗的检验合格率和实际免疫效果却并不十分理想[7]。诸多研究表明,通过基因工程大肠杆菌制备的有毒性或是无毒性的重组 α毒素[8-9]和 ε毒素[10-12]均具有很好的免疫原性。本实验构建了可以共表达腐败梭菌α毒素和产气荚膜梭菌ε毒素的双基因表达载体,探究了共表达产物的反应原性、毒性和相互作用等生物学特性,并将其制成基因工程灭活疫苗,评价了该疫苗的免疫效力,为羊快疫和肠毒血症基因工程多联疫苗的研制提供了试验基础。
1 材料与方法
1.1 实验材料 腐败梭菌C55-1株、D型气荚膜梭菌C60-3株、腐败梭菌毒素和D型产气荚膜梭菌毒素及其抗毒素羊血清均由中国兽医药品监察所保存,自诱导培养基由中国兽医药品监察所配制。pETDuet-1 购自 EMD Biosciences,Inc;E.coli BL21(DE3)购自北京康为世纪生物有限公司。HRP标记兔抗羊IgG购自Sigma公司,酶标二抗显色试剂盒购自Vector公司。PCR mix购自艾德莱生物公司、限制性内切酶EcoRⅠ、SalⅠ、EcoRⅤ、XhoⅠ和 DNA分子量标准等购自宝生生物(大连)公司,T4 DNA连接酶购自NEB公司。LB肉汤、TG培养基、TSB培养基等由北京中海生物科技有限公司提供,氢氧化铝胶佐剂由中牧实业有限公司兰州生物药厂提供,其他试剂均为国产或进口分析纯或试剂纯。体重16~18 g ICR小鼠购自北京维通利华实验动物公司,1.5~2.0 kg家兔购自北京隆安实验动物中心。
1.2 共表达载体的构建
1.2.1 引物设计 根据GenBank腐败梭菌α毒素和产气荚膜梭菌ε毒素的基因序列设计2对引物(表1),由中美泰和生物技术(北京)有限公司合成。

表1 扩增α毒素和ε毒素引物Tab 1 Primers amplifying C.septium α-toxin and C.perfringens ε-toxin genes
1.2.2 PCR 扩增 反应体系(25 μL):10×PCR 缓冲液2.5 μL,dNTP 2 μL,上下游引物(20 pmol/μL)各 0.5 μL,模板 1 μL,5 U/μL Taq DNA 聚合酶0.5 μL,ddH2O 18 μL。分别以腐败梭菌 C55-1株和D型产气荚膜梭菌C60-3株基因组为模板PCR扩增。Gcsa反应条件:94℃10 min;94℃ 1 min,50℃1 min,72 ℃ 1.5 min,30 个循环;72 ℃延伸 10 min。Gcpe反应条件:94℃ 5 min;94℃ 30 s,50℃ 40 s,72℃ 2 min,30个循环;最后72℃延伸10 min。
1.2.3 pETDuet-Gcsa-Gcpe 的构建 EcoRⅠ、SalⅠ双酶切Gcsa PCR产物和pETDuet-1质粒,胶回收后,16℃连接过夜,转化感受态E.coli BL21(DE3),涂布Amp+LB平板,挑取单菌落,PCR和双酶切鉴定。EcoRⅤ、XhoⅠ双酶切经鉴定阳性的重组质粒pETDuet-Gcsa和Gcpe PCR产物,胶回收后连接,转化感受态 E.coli BL21(DE3),涂布 Amp+LB平板,挑取单菌落,进行PCR和双酶切鉴定,同时送上海生工生物公司测序。
1.3 自诱导共表达及产物的鉴定
1.3.1 SDS-PAGE 分析 鉴定合格的 E.coli BL21(pETDuet-Gcsa-Gcpe)接种 Amp+自诱导培养基,28℃ 220 r/min震荡诱导表达24 h收获,SDSPAGE电泳和灰度扫描分析表达量。
1.3.2 Western-blot鉴定 以腐败梭菌抗毒素和产气荚膜梭菌抗毒素血清分别作为一抗,HRP标记兔抗羊IgG作为二抗进行Western-blot检测。
1.3.3 毒性和毒性中和试验 自诱导收获的E.coli BL21(pETDuet-Gcsa-Gcpe)菌液经超声波裂解,0.2 mL/只腹腔注射小鼠5只,鉴定表达产物的毒性。将腐败梭菌抗毒素血清和D型产气荚膜梭菌抗毒素血清分别与裂解菌液1∶1(V/V)混合,37℃孵育40 min,0.4 mL/只腹腔注射小鼠各5只;将两种抗毒素一同与裂解菌液1∶1∶1混合,37℃孵育40 min,0.6 mL/只腹腔注射小鼠5只,进行毒性中和试验。同时设E.coli BL21(DE3)裂解菌液、2种抗毒素血清和自诱导培养基对照,观察7 d。
1.4 共表达产物的免疫效力评价
1.4.1 灭活疫苗的制备 自诱导收获的 E.coli BL21(pETDuet-Gcsa-Gcpe)菌液,加 0.4%甲醛溶液,密封,37℃灭活3 d,每天轻摇4~5次。灭活完全后加20%灭菌氢氧化铝胶混匀,作为灭活菌苗备用。
1.4.2 无菌检验与安全检验 疫苗按照《中国兽药典》2015版三部规定的方法进行无菌检验[13]。家兔4只各皮下注射疫苗5.0 mL,观察10 d,进行安全检验。
1.4.3 免疫效力评价 疫苗1.0 mL/只颈背部皮下注射免疫家兔10只,对照组10只注射20%铝胶PBS,21 d后以同样的方法进行二免。按照《中国兽药典》相关疫苗规定的方法,测定免疫血清中和效价并用毒素攻击,分别采集一免21 d后和二免14 d后血清,将同组同次采集的血清等量混合制成混合血清,与经适当稀释的腐败梭菌和产气荚膜梭菌毒素分别 1 ∶2 混合,37 ℃孵育40 min,0.3 mL/只尾静脉注射小鼠各2只,观察3 d,直到血清刚好能中和毒素。二免14 d后取免疫组家兔5只和对照组5只耳缘静脉注射1 MLD腐败梭菌毒素,另取免疫组5只和对照组5只注射1 MLD的D型产气荚膜梭菌毒素,观察7 d。
2 结果
2.1 共表达载体的鉴定 提取待鉴定菌落的质粒经EcoRⅠ、SalⅠ双酶切,用引物Fcsa和Rcsa PCR鉴定,见大小约1330 bp的片段与Gcsa预期大小接近;用 EcoR V、XhoⅠ双酶切,引物 Fcpe和 Rcpe PCR鉴定,见大小约900 bp片段与Gcpe预期大小接近(图1);测序结果显示,Gcsa和Gcpe序列和阅读框正确。以上结果表明,共表达载体pETDuet-Gcsa-Gcpe构建成功。
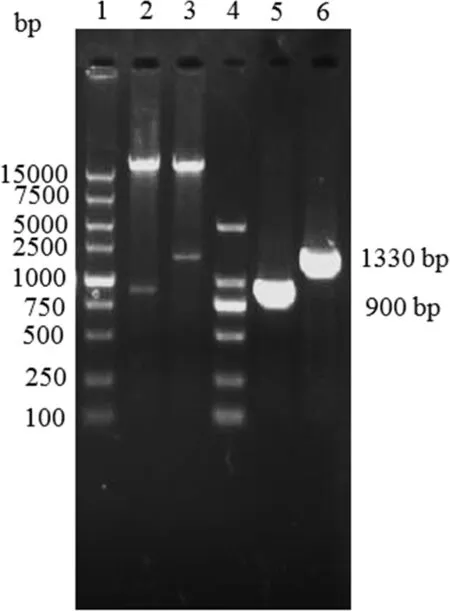
图1 共表达载体的鉴定Fig 1 Identification of the co-expression vector
2.2 SDS-PAGE 和 Western-blot鉴定 自诱导E.coli BL21(pETDuet-Gcsa-Gcpe)表达产物经 SDSPAGE分析,以腐败梭菌抗毒素血清和D型产气荚膜梭菌抗毒素血清分别为一抗Western-blot检测。结果显示,在约49 ku处见特异条带能够与腐败梭菌抗毒素血清反应条带,表达量为0.28 mg/mL,在约33 ku处见可与产气荚膜梭菌抗毒素血清反应的条带,表达量为0.39 mg/mL(图 2)。结果表明,Gcsa和Gcpe实现了共表达,且均具有反应原性。
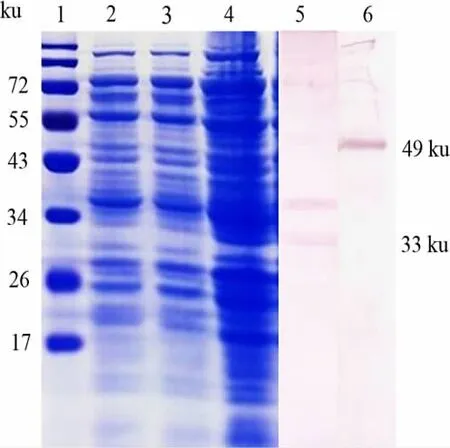
图2 共表达产物的SDS-PAGE和Western-blot鉴定Fig 2 Identification of the co-expression by SDS-PAGE and Western blot
2.3 毒性和毒性中和试验 小鼠注射了没有中和和用单一抗毒素血清中和的裂解菌液后,在观察期内全部死亡;注射了用2种抗毒素中和的菌液以及E.coli BL21(DE3)菌液、抗毒素血清和自诱导培养基小鼠,均存活(表2)。结果表明,共表达产物同时具有2种毒素的毒性,进一步证实Gcsa和Gcpe获得了共表达。
2.4 疫苗的无菌检验和安全检验 疫苗接种培养基均无菌生长,接种家兔后在观察期内全部健活。结果表明,所制备的疫苗无菌检验和安全检验合格,可以用于免疫效力评价。

表2 共表达产物的的毒性及其中和试验Tab 2 Result of toxicity and neutralization test of co-expression
2.5 免疫效力评价 疫苗免疫家兔,一免血清对腐败梭菌毒素的中和效价为1 MLD/0.1 mL,对D型产气荚膜梭菌毒素的中和效价为 5 MLD/0.1 mL;二免血清对腐败梭菌毒素的中和效价为2 MLD/0.1 mL,对D型产气荚膜梭菌毒素的中和效价≥50 MLD/0.1 mL。二免后用1 MLD腐败梭菌毒素和D型产气荚膜梭菌毒素分别攻击,观察期内免疫组均100%保护,对照组均全部死亡(表3)。结果表明,Gcsa和Gcpe的共表达产物具有免疫原性,其灭活菌苗免疫家兔可以同时抵抗腐败梭菌和D型产气荚膜梭菌毒素攻击。

表3 免疫血清中和试验和攻毒保护试验结果Tab 3 Results of immune serum neutralization and immune protection tests
3 分析与讨论
许多研究将共表达方法应用于目的蛋白与分子伴侣一同表达,其目的或是为了改变蛋白的表达形式,或是为了提高表达量,亦或是为了优化蛋白质空间构象和增强生物活性等。Zhang Y[14]等用共表达载体pETDuet-1将霍乱毒素B亚单位CTB与分子伴侣SKP一同表达,提高了CTB的可溶性表达比例和生物活性;Liu XL[15]等将影响莽草酸代谢通路的多种蛋白酶进行不同形式的组合共表达,比较了不同蛋白酶的不同组合以及顺序的差异对莽草酸产量的影响;Lu XY[16]等尝试了多种分子伴侣以不同方式组合共表达用于提高1,2,4丁三醇的产量。共表达方法在新型疫苗的应用研究方面,Yu YZ[17]等将破伤风毒素受体蛋白(THc)与硫氧还原(Trx)共表达,优化了蛋白构想,提高了THc的免疫原性。另外,也有将抗原基因与免疫刺激因子共表达增强了免疫效果[18]。
很多梭菌外毒素是主要的致病性毒力因子和免疫保护性抗原,研究表明,通过基因工程大肠杆菌可以获得具有免疫活性的重组外毒素。而将共表达方法应用于羊梭菌多联新型候选疫苗的研制,可以实现多种抗原同步生产。韩广伟[18]等共表达了同一种梭菌D型产气荚膜梭菌α毒素和ε毒素两种外毒素,纯化后免疫小鼠,证实二者能同时发挥很好的免疫原性。本实验获得了2种梭菌,分别是腐败梭菌α毒素和D型产气荚膜梭菌ε毒素的共表达,两者同时保持其各自的生物活性,表达产物的免疫原性良好,一次免疫血清中和效价即可以达到《中国兽药典》效力检验标准。在疫苗制备工艺方面,将含有重组抗原的工程菌菌液用甲醛灭活制成灭活疫苗,一方面甲醛在对工程菌灭活的同时,对毒素做了脱毒处理,保证了疫苗的安全;另一方面重组大肠杆菌本身在疫苗免疫过程中发挥了佐剂的作用,克服亚单位疫苗蛋白质分子量小免疫刺激弱的不足[19];同时简化了疫苗制备的工艺,省去了细菌裂解、蛋白质纯化和包涵体复性等工序。此外,采用含乳糖的自诱导培养基诱导基因表达,代替了有毒性的IPTG,提高了疫苗的安全性。综上,本试验为梭菌病基因工程多价和多联疫苗的开发提供了实验基础。
