BPV1贵州株L1基因序列分析及原核表达
2019-03-12周碧君王开功程振涛罗引幸刘丽娟丁尊俄赵大杰
张 旭,张 海,周碧君* ,王开功,文 明,程振涛,罗引幸,刘丽娟,丁尊俄,赵大杰
(1.贵州大学动物科学学院,贵阳550025;2.贵州省动物生物制品工程技术研究中心,贵阳550025;3.贵阳市动物疫病预防控制中心,贵阳550081)
牛乳头状瘤(bovine papillomatosis,BP)是由牛乳头状病毒(bovine papillomavirus,BPV)引起牛体表或黏膜的肿瘤性疾病,可引起良性和恶性肿瘤[1-2]。良性肿瘤在一般情况下可自行消退,但当环境因素和遗传因素协同作用时会导致恶性肿瘤,导致牛死亡[3-4]。在集约化饲养场牛乳头状瘤十分普遍,其发病率较高,到目前为止依旧没有有效的的疫苗来预防牛乳头状瘤病的发生[5],在一定程度上造成了较大的经济损失。
BPV为无囊膜病毒,直径为55~60 nm的正二十面体,其遗传物质的长度约为7000~8000 bp双链闭环DNA分子[6]。BPV基因组含有3个区域:早期转录区(E区)、晚期转录区(L区)和非编码区(NCR)[7],L区编码主要衣壳蛋白L1和次要衣壳蛋白L2。BPV L1基因编码的衣壳蛋白暴露在病毒粒子表面,可能与病毒感染及免疫有关[8];研究表明BPV L1蛋白具有B细胞特异性抗原表位,可诱导机体产生中和性抗体,激发保护性免疫,是进行预防免疫的主要抗原[9-10]。因此,BPV L1 蛋白是研制预防性疫苗的候选基因,也是临床上诊断BPV理想抗原[11],对牛乳头状瘤的诊断方法的建立具有重要价值。本试验通过对BPV1贵州株(BPV1-GZLZ株)L1基因进行克隆、测序分析、构建重组质粒pCold-BPV1-L1,并进行IPTG诱导表达L1重组蛋白,经 SDS-PAGE和 Western blotting分析,为BPV1诊断试剂和基因工程疫苗的研制奠定基础。
1 材料与方法
1.1 材料 牛乳头状瘤病毒1型贵州株(BPV1-GZLZ株)、大肠杆菌DH5α感受态细胞、大肠杆菌BL21感受态细胞、pColdⅠ原核表达载体均由贵州省动物疫病与兽医公共卫生重点实验室保存;Eco RⅠ、XhoⅠ、异丙基硫基半乳糖苷购自宝生物工程(大连)有限公司;兔源BPV1 L1多克隆抗体由贵州省动物生物制品工程技术研究中心制备;2×Taq PCR MasterMix、DNA Marker、DNA 提取试剂盒、His单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(H+L)、DAB辣根过氧化物酶显色试剂盒均购自天根生化科技(北京)有限公司;琼脂糖凝胶电泳回收试剂盒购自上海生物工程公司;Tween-20、PVDF膜购自北京索莱宝科技有限公司,其他均为分析纯化。
1.2 引物设计与合成 根据 GenBank公布的BPV1 L1基因序列,设计特异性引物,上游引物P1:5'-CCGCTCGAGATGGCGTTGTGGCAACAAGGCCAGAAGCTG-3';下游引物 P2:5'-CGGAATTCTTATTTTTTTTTTTTTTTTGCAGGCTTACTGG-3';预期扩增片段长1488 bp,引物由上海英潍捷基公司合成。
1.3 目的片段扩增及纯化 采用DNA提取试剂盒对病料组织总DNA进行提取,以此为模板进行PCR扩增。PCR反应体系50μL:上、下游引物(10μmol/L)各2 μL,2×Taq PCR MasterMix 25 μL,模板2 μL,灭菌双蒸水19μL。PCR反应程序:95℃预变性5 min;95℃变性 45 s,52 ℃退火 45 s,72 ℃延伸 45 s,35个循环;72℃终延伸10 min。扩增产物进行1.2%琼脂糖凝胶电泳检测。
1.4 BPV1-GZLZ株L1基因克隆及序列分析 回收纯化目的DNA并连接至pMD19-T载体上,再转化至大肠杆菌DH5α感受态细胞,利用含氨苄青霉素(100μg/mL)抗性的LB平板筛选阳性重组子。提取质粒,进行PCR鉴定。将产物于1.2%琼脂糖凝胶电泳检测,鉴定为阳性的重组质粒命名为pMD19-T-L1,送往赛默飞世尔科技(中国)有限公司测序。利用DNAStar、Mega 5.0等软件对BPV1-GZLZ株与国内外主要的BPV参考毒株(表1)的核苷酸及其推导的氨基酸序列进行比对分析,并绘制系统进化树。

表1 GenBank中登陆的BPV参考株序列信息Tab 1 GenBank landing BPV reference strains in sequence
1.5 BPV1-GZLZ株L1基因生物信息学分析 采用在线软件 ExPASy(http://web.expasy.org/cgi-bin/protparam/protparam)分析预测编码蛋白质的理化性质及氨基酸组成。采用SPOMA在线服务器(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测蛋白质二级结构;采用DNAStar软件Protean程序预测B细胞表位多参数;采用NCBI服务器上的Conserved Domain Architecture Retrieval Tool(CDART)工具(http://blast.ncbi.nlm.nih.gov.Blast)预测保守结构域;采用 TMHMM2.0 Server在线服务器(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测跨膜结构域;采用 SignalP4.1 在线服务器(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽。利用 SWISSMODEL(http://www.swissmodel.expasy.org)在线预测蛋白质的三级结构。
1.6 原核表达载体构建
1.6.1 酶切与连接 用Eco RⅠ和 XhoⅠ对构建的质粒pMD19-T-L1和原核表达载体pColdⅠ进行双酶切,37℃水浴过夜,酶切体系为40μL:10×H Buffer 4 μL,Eco RⅠ、XhoⅠ各 2 μL,pColdⅠ/pMD19-T-L1 20μL、ddH2O 12μL。酶切后采用胶回收试剂盒进行纯化回收,将目的片段与线性pColdⅠ16℃连接过夜,连接体系为 10μL:目的片段 4μL、线性pColdⅠ 4 μL、SolutionⅠ 5 μL。
1.6.2 重组质粒转化 将连接产物转化至大肠杆菌DH5α感受态细胞,利用含氨苄青霉素(100μg/mL)抗性的LB平板筛选阳性重组子。提取质粒,进行PCR鉴定。将PCR产物于1.2%琼脂糖凝胶电泳检测,鉴定为阳性的重组质粒命名为pColdⅠ-BPV1-L1,送往赛默飞世尔科技(中国)有限公司测序。
1.7 重组蛋白诱导表达与鉴定 首先对含有阳性重组质粒的BL21表达宿主菌进行诱导,再进行温度和诱导条件的优化,按1∶100的比例接种于含氨苄青霉素抗性的LB培养液中,37℃振荡培养至OD600≌0.6 左右,加入 IPTG(终浓度为 1.0 mmol/L),同时设立无IPTG诱导对照组,37℃继续震荡培养5 h。取诱导表达菌液,离心取沉淀,用PBS洗涤一次,用 PBS悬浮沉淀,吹匀置于冰上超声破碎处理,12000 r/min 4℃离心10 min,分别收集上清和沉淀,并对上清、沉淀和无 IPTG诱导组用 5×SDS蛋白上样缓冲液沸水浴4 min制样,用12%SDSPAGE鉴定。之后对重组原核表达蛋白进行Western blotting鉴定,一抗为His-tag抗体(稀释度为1 ∶1000),二抗为辣根过氧化物酶(HRP)标记山羊抗小鼠IgG(H+L)(稀释度为1∶1000),最后加入二氨基联苯胺(DAB)-H2O2避光显色,分析结果。
2 结果与分析
2.1 BPV1-GZLZ株L1基因PCR扩增 以提取的BPV1-GZLZ株阳性组织病料DNA为模板,进行L1基因特异性PCR扩增,经1.2%琼脂糖凝胶电泳分析,得到大小为1488 bp的条带,与预期结果相符,结果见图1。
2.2 测序结果 将鉴定的阳性重组质粒进行测序,测序结果采用DNAStar软件进行序列拼接,获得BPV1-GZLZ株L1基因核苷酸序列。由图2可知,L1基因核苷酸序列长为1488 bp,编码495个氨基酸。
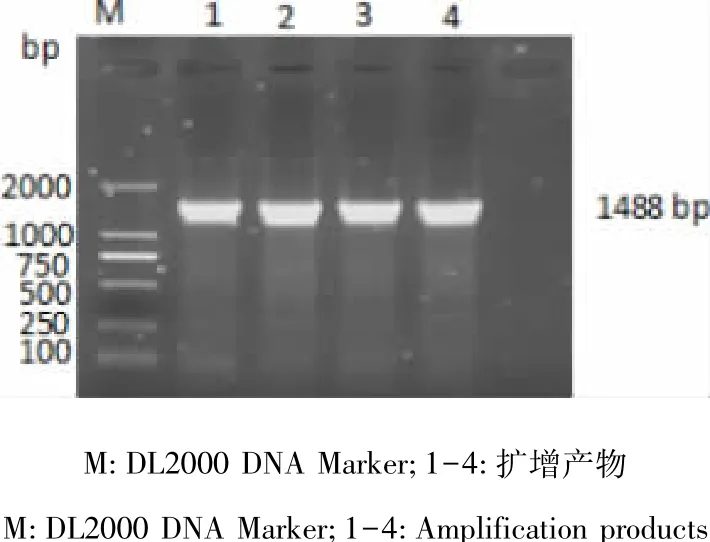
图1 BPV1-GZLZ株L1基因PCR扩增电泳图Fig 1 Amplification of L1 gene of BPV1-GZLZ by PCR

图2 BPV1-GZLZ株L1基因测序结果Fig 2 Secquencing result of L1 gene of BPV1-GZLZ
2.2.1 BPV1-GZLZ 株 L1 基因核苷酸同源性分析将克隆的BPV1-GZLZ L1基因序列与GenBank上公布的15株牛乳头状瘤病毒14个基因型的L1基因进行核苷酸比对分析。由图3可知,BPV1-GZLZ L1基因序列与牛乳头状瘤病毒1型BPV1(登录号:X02346)的核苷酸序列同源性为99.8%,与 NCBI收录的另外两株BPV2(登录号:JQ79817)、BPV2-GZ01(登录号:KX113620)的同源性分别为82.9%、82.8%,与NCBI收录1株BPV13(登录号:JQ79817)的同源性为83.9%。

图3 BPV1-GZLZ株L1基因的核苷酸同源性分析Fig 3 Nucleotide homology analysis of L1 gene of BPV1-GZLZ
2.2.2 BPV1-GZLZ 株 L1 基因编码蛋白氨基酸同源性分析 采用DNAStar软件分析出BPV1-GZLZ L1基因的氨基酸序列,并与GenBank中公布的15株牛乳头状瘤病毒14个基因型的L1基因编码氨基酸序列作同源性分析。由图4可知,BPV1-GZLZ L1基因氨基酸序列与牛乳头状瘤病毒1型BPV1(登录号:X02346)的氨基酸序列同源性为99.8%;与NCBI收录的另外两株 BPV2(登录号:JQ79817)、BPV2-GZ01(登录号:KX113620)的同源性分别为 92.1%、91.3%,与 NCBI收录 1株 BPV13(登录号:JQ79817)的同源性为92.7%。

图4 BPV1-GZLZ株L1基因编码蛋白的氨基酸同源性分析Fig 4 Amino acid homology analysis of L1 gene of BPV1-GZLZ
2.2.3 BPV1-GZLZ 株 L1 基因系统进化树分析将BPV1-GZLZ株L1基因与国内外发表的BPV不同毒株L1基因的核苷酸序列采用DNAStar软件绘制遗传进化树。结果显示,BPV1-GZLZ株与BPV1(登录号:X02346)处在同一遗传进化分支(图5)。由图5可知,BPV1-GZLZ株与 BPV13(登录号:JQ79817)和 BPV2(登录号:JQ79817)、BPV2-GZ01(登录号:KX113620)的亲缘关系较近。
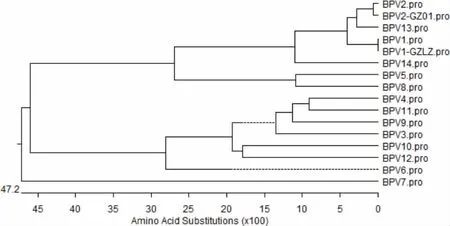
图5 BPV1-GZLZ株L1基因核苷酸序列的系统进化树Fig 5 Phylogenetic tree of L1 gene BPV1-GZLZ on nucleotide sequence
2.3 BPV1-GZLZ株L1蛋白质理化性质的分析使用ExPASy(Compute PI/MW)、ProtParam在线分析软件预测蛋白质的理化性质及氨基酸组成。L1蛋白分子质量为55.55122 ku,分子结构式为C2484H3884N678O737S16,理论等电点(PI)为 8.68。其氨基酸组成中Leu最多,占到9.1%,不含Pyl(0)和Sec(U)。在该蛋白的氨基酸中,碱性氨基酸有3种(Arg、Lys、His),共 68 个,占 11.7%;酸性氨基酸有2 种(Asp、Glu),共 52 个,占 10.5%;亲水性氨基酸有 6 种(Asp、Glu、His、Lys、Ser、Thr),共 165 个,占33.33%;疏水性氨基酸 9 种(Ala、Ile、Pht、Leu、Met、Pro、Val、Trp、Tyr),共 217 个,占 43.84%,推测 L1蛋白为碱性蛋白。L1蛋白在哺乳动物网状细胞、酵母和埃希氏大肠杆菌中表达的半衰期分别大于30 h、20 h 和10 h,在溶液中的不稳定指数为 39.38,低于阈值40,属于稳定类蛋白。
2.4 BPV1-GZLZ株L1基因B细胞表位预测
2.4.1 L1基因编码蛋白二级结构预测 采用SOPMA在线服务器预测L1基因编码蛋白的二级结构(图6)。由图6可知,BPV1-GZLZ株L1基因编码蛋白的二级结构主要包括α-螺旋、β-转角、无规则卷曲和β-折叠,所占比例分别为 21.01%、12.12%、38.59%和28.28%。在整个蛋白二级结构中无规则卷曲、β-折叠和α-螺旋区域出现相对较多,而此序列中β-转角所占比例相对较少。
2.4.2 L1基因编码蛋白B细胞多参数分析 采用DNAStar程序包中的Protean软件综合分析预测L1基因编码蛋白B细胞表位各参数。采用 Kyte-D00little法分析亲水性,Karplus-Schulz法分析柔韧性Jameson-Wolf法分析抗原指数和Emini法分析氨基酸表面可及性进行分析,以高于阈值的氨基酸残基作为候选参考区域(图7)。由图7可知,该蛋白在整个氨基酸区域中,都具有良好的亲水性,柔韧性分布较均匀,抗原性和表面可及性较高。
2.5 BPV1-GZLZ株L1基因编码蛋白保守结构域预测 采用NCBI服务器上的CDART工具分析L1基因氨基酸序列保守结构域(图8),由图8可知,没有发现具有明显特征的保守结构域。

图6 BPV1-GZLZ L1基因编码蛋白二级结构预测Fig 6 Secondary structure prediction of BPV1-GZLZ L1 protein

图7 BPV1-GZLZ L1蛋白B细胞表位参数预测Fig 7 B cell epitope prediction for L1 protein of BPV1-GZLZ by the DNAStar method

图8 BPV1-GZLZ L1基因编码蛋白保守结构域分析Fig 8 Conserved domain analysis of L1 protein of BPV1-GZLZ
2.6 BPV1-GZLZ株L1基因编码蛋白的跨膜结构预测 采用TMHMM2.0 Server在线服务器对L1蛋白跨膜结构域进行预测和分析(图9)。由图9可知,BPV1-GZLZ L1基因编码蛋白发现无跨膜结构域。
2.7 BPV1-GZLZ株L1基因编码蛋白信号肽预测采用SignalP4.1在线服务器对BPV1-GZLZ株L1蛋白序列中是否存在潜在的信号肽进行预测。结果显示,此蛋白无信号肽,即为非分泌蛋白(图10)。

图9 L1蛋白跨膜结构域预测Fig 9 Prediction of trans membrane domains of L1 protein

图10 L1蛋白信号肽预测Fig 10 The signal peptide analysis of L1 protein
2.8 原核表达载体构建 将克隆的质粒pMD19-TBPV1-L1与原核表达载体pCold I同时用Eco RⅠ和XhoⅠ进行双酶切,酶切产物用1.2%的琼脂糖凝胶电泳检测,均能扩增出相应的目的条带(图11),将回收的目的片段进行纯化回收,构建原核表达载体pColdI-BPV1-L1,将构建的质粒进行菌液PCR鉴定(图12),送公司测序。

图11 质粒pMD19-T-BPV1-L1双酶切Fig 11 Plasmid pMD19-T-BPV1-L1 double digestion

图12 原核表达载体pCold I双酶切Fig 12 Prokaryotic expression vector pCold I double digestion
2.9 pColdI-BPV1-L1原核表达及鉴定结果 对含有阳性重组质粒 pColdI-BPV1-L1的BL21表达宿主菌进行温度和诱导表达,12%的SDS-PAGE电泳鉴定结果(图13)显示,重组表达蛋白主要以包涵体形式存在,重组蛋白分子量约为55.6 kD,与理论值一致。

图13 重组 pCold I-BPV1-L1蛋白表达产物的鉴定Fig 13 Identification of recombinant p Cold I-BPV1-L1 protein expression product
2.10 pColdI-BPV1-L1 重组原核表达蛋白的鉴定结果 Western blotting结果显示,经IPTG诱导的重组表达蛋白能与His单抗和已制备好的兔源BPV1 LI多克隆抗体产生特异性反应产生特异性反应,条带为55.6 kD左右,与SDS-PAGE结果一致,结果见图14和图15。
3 讨论与结论
牛乳头状瘤病在1929年被首次报道,现在世界各地都广泛流行并传播[12]。在我国新疆、东北和海南地区近两年也有该病的报道[13]。BPV会影响牛产奶量出现下降和皮革质量、生长性能等,严重的会导致牛死亡[14]。贵州省为快速发展养牛业,从外地引进优质牛种,牛交易过于频繁,给BPV的感染带来了巨大的潜在风险,也给该省持续健康发展的养牛业带来巨大的挑战。

图14 重组蛋白pColdI-BPV1-L1的Western blotting鉴定Fig 14 Western blotting identification of recombinant protein pColdI-BPV1-L1

图15 重组蛋白r His-L1的Western blotting鉴定Fig 15 Identification of recombinant protein r His-L1 by Western blotting
本研究应用PCR扩增、克隆测序、生物信息学分析,构建了pCold I-BPV1-L1原核表达质粒并且成功诱导表达。结果显示BPV1-GZLZ株L1基因序列全长是1488 bp,编码495个的氨基酸,分子结构式为C2484H3884N678O737S16,二级结构主要包括α-螺旋、无规则卷曲和β-折叠为主。彭昊等[15]研究结果显示,BPV-GX-LA150909与 BPV1参考株无论是基因组还是 L1基因同源性非常高,而本研究中BPV1-GZLZ L1基因序列与牛乳头状瘤病毒1型参考株BPV1的核苷酸和氨基酸同源性均为为99.8%,BPV1-GZLZ株与BPV1参考株处在同一遗传进化分支,说明 BPV1-GZLZ株与 BPV-GXLA150909株可能均来自相同的来源。本研究采用外源基因常用的大肠杆菌表达系统,与酵母、昆虫、细胞等原核表达系统相比,大肠杆菌表达系统具有培养简单、成本低、生长繁殖快、表达量高等优点。实验选用了具有良好表达效果的pColdⅠ原核载体,该载体为氨苄抗性,载体带有His-tag标签,为方便进行后续的蛋白纯化实验。SDS-PAGE和Western blotting检测结果显示,重组表达蛋白主要以包涵体的形式存在,且与His单抗产生特异性反应,与预期结果相同,证明 L1基因在大肠杆菌BL21中得到了有效的表达;该蛋白具有均匀的柔韧性和良好的亲水性,其抗原性和表面可及性也较高,但能否刺激机体产生体液免疫、产生特异性抗体,还需进一步研究验证。
