辣蓼总黄酮提取工艺筛选及优化
2019-03-12何立美陈文露袁明贵罗胜军徐志宏彭新宇
向 蓉,何立美,陈文露,高 彪,袁明贵,罗胜军,徐志宏,彭新宇
(广东省农业科学院动物卫生研究所农业部兽用药物与诊断技术广东科学观测实验站/广东省畜禽疫病防治研究重点实验室广东省中兽药工程技术研究中心,广州510640)
辣蓼(Polygonum hydropiper Linn.) 为蓼科(Polygonaceae)蓼属(Polygonum)植物,别名蓼子草、红辣蓼、斑蕉草等。全国各地均有分布,但主产于广东、广西及南方各省,生长在水边潮湿的地方[1]。全草均可入药,本品味辛,性温;具有祛风利湿、消肿解毒、散淤止痛、止痒杀虫等功效;用于肠胃炎、痢疾、腹泻、跌打肿痛、风湿关节痛、功能性子宫出血等;外用治皮肤湿疹、毒蛇咬伤等症状[2]。临床研究表明,辣蓼具有杀虫、抑菌、消炎、抗病毒、抗氧化、抑肿瘤、镇痛止血等多种生物活性[3-5]。因此在农药、医药、兽药、食品及饲料添加剂等方面都有着良好的开发前景,特别在畜禽安全健康养殖业和生产安全畜禽产品中有广泛的应用前景[6]。
黄酮类是辣蓼的主要活性成分,目前已从辣蓼的不同部位中分离得到金丝桃苷、芦丁、槲皮素、3'-甲基槲皮素、7,4'-二甲基槲皮素、异鼠李素、山萘酚、儿茶素、表儿茶素等[7-10]。根据设备与操作方式不同,总黄酮的提取方法可分为:渗漉法、浸渍法、索氏提取法、加热回流提取法等,不同操作方法各有优劣。本文分别比较热水提取法、超声提取法、乙醇加热回流法、索氏提取法对辣蓼总黄酮的提取效率,并在此基础上优化提取工艺,获得最佳工艺参数。
1 材料与方法
1.1 材料 芦丁对照品(批号:100080-200707,中国食品药品鉴定研究院,纯度≥98%);亚硝酸钠(分析纯,批号20120314,上海凌峰化学试剂有限公司);硝酸铝(分析纯,批号 20120304-2,广州化学试剂厂);氢氧化钠(分析纯,批号12082311422,南京化学试剂有限公司);甲醇(分析醇,批号2013062005,广州市东红化工厂);辣蓼(广东广州,批次201309)经广东药学院李书渊教授鉴定为蓼科植物水辣蓼Polygonum hydropiper Linn.。药材经低温干燥后,粉碎,过20目筛,备用。
1.2 仪器 UV-3100PC紫外-可见分光光度计(上海美谱达仪器有限公司);BS 123S Sartorius万分之一电子天平(北京赛多利斯仪器有限公司);SHZD-D(Ⅲ)循环式水泵(巩义市予华仪器有限责任公司);RE-5299旋转蒸发仪(上海亚荣生化仪器厂);DL-720A超声波清洗器(600 w,上海之信仪器有限公司);KQ-100B型超声波清洗器(100 w,控温0~85℃,昆山市超声仪器有限公司);HH-2数显恒温水浴锅(常州奥华仪器有限公司)。
1.3 总黄酮测定方法建立
1.3.1 线性关系考察
1.3.1.1 对照品溶液的制备 取芦丁对照品10 mg,精密称量,置于10 mL容量瓶中,加60%乙醇适量,水浴40℃使溶解,放冷至室温,加60%乙醇至刻度,摇匀,得芦丁储备液。精密量取5.0 mL,置于25 mL容量瓶中,加60%乙醇稀释至刻度,摇匀,即得对照品溶液(每1 mL含芦丁0.2 mg)。按NaNO2-Al(NO3)3-NaOH显色体系进行显色,精密量取对照品溶液 1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于25 mL容量瓶中,各加30%乙醇至6 mL,加5% 亚硝酸钠溶液1.00 mL,混匀,放置6min;再加10%硝酸铝溶液1.00 mL,摇匀,放置6min;加氢氧化钠溶液10.00 mL,再加30%乙醇至刻度,摇匀,放置15 min,以相应试剂为空白。
1.3.1.2 供试品溶液的制备 取样品 1.0 g,精密称定,提取次数为2次,过滤,合并两次滤液。取滤液1.0 mL置于 25 mL容量瓶中,按上述 NaNO2-Al(NO3)3-NaOH显色方法进行显色,扣除背景后测定吸光度。
1.3.1.3 检测波长的选择 对照品溶液及供试液按以上显色方法显色后,按各自空白对照进行校准,在200~700 nm波长范围内扫描。
1.3.1.4 标准曲线的建立 以吸光度为纵坐标,芦丁标准液的浓度为横坐标,绘制标准曲线。
1.3.2 方法学考察
1.3.2.1 精密度试验 日内精密度:取供试液1.25 mL于25 mL容量瓶中,显色后于同一条件下测定6次吸光度,代入标准曲线,求得总黄酮浓度,计算总黄酮含量的变异系数RSD来考察仪器日内精密度。
日间精密度:取供试液1.25 mL于25 mL容量瓶中显色后平行操作3份,测定吸光度,代入标准曲线,求得总黄酮浓度,同法连续操作3天,计算总黄酮含量的变异系数RSD来考察仪器日间精密度。
1.3.2.2 稳定性试验 取供试液1.25 mL于25 mL容量瓶中,显色后,定容,放置15 min后开始计时,于 0、10、20、30、40、50、60 min 后,测定吸光度值,利用标准曲线计算总黄酮含量的变异系数RSD来考察样品显色后的稳定时间。
1.3.2.3 重复性试验 取供试品溶液1.25 mL于25 mL容量瓶中,显色后平行操作6份,分别测定吸光度,代入标准曲线方程,计算总黄酮含量的变异系数RSD来考察供试品的重复性。
1.3.2.4 加样回收率试验 平行取9份辣蓼粉末样品,每份1.0g,精密称定,平均分成3组,按供试品处理方法处理后,各取5.0 mL分别加入一定量的对照品,使加入量分别约为化合物原始含量的80%(低浓度组)、100%(中浓度组)、和 120%(高浓度组),显色后测定其吸光度,计算加标回收率及相应的RSD值。
1.4 提取方法的筛选
1.4.1 热水提取法 取辣蓼粉末100.00 g,第1次加8倍水浸泡2 h后,煎煮1.5 h,过滤,滤渣继续加6倍水煎煮1 h,过滤,合并2次滤液,于旋转蒸发仪浓缩后,离心(3500 r/min,10 min)取上清液,浓缩至 1000 mL(生药浓度 0.1 g/mL)。
1.4.2 超声提取法 精密称取辣蓼样品10.0 g置于具塞锥形瓶中,加入200.0 mL 60%乙醇,浸泡2 h,80 ℃超声处理30 min,离心,滤渣继续加200.0 mL 60%乙醇,超声30 min,离心,合并两次滤液,于旋转蒸发仪减压浓缩至100 mL(生药浓度0.1 g/mL)。
1.4.3 加热回流提取法 精密称取辣蓼样品10.0 g置于500 mL圆底烧瓶中,精密加入200.0 mL 60%乙醇,88℃水浴加热回流4 h,离心,滤渣继续加200.0 mL 60%乙醇,回流4 h,离心,合并两次滤液,于旋转蒸发仪减压浓缩至100 mL(生药浓度0.1 g/mL)。
1.4.4 索氏提取法 精密称取辣蓼样品10.0 g于500 mL索氏回流管中,加入200.0 mL 60%乙醇,88℃水浴加热回流4 h,离心,滤渣继续加200.0 mL 60%乙醇,回流4 h,离心,合并两次滤液,于旋转蒸发仪减压浓缩至100 mL(生药浓度0.1 g/mL)。
1.5 提取工艺的优化 以辣蓼总黄酮含量为考察指标,选择乙醇浓度、料液比、提取时间及提取温度作为考察超声提取法的四个影响因素,按4因素3水平进行L9(34)正交试验设计,因素水平见表1。

表1 辣蓼总黄酮提取工艺正交实验因素水平Tab 1 The orthogonal experiment factor level of extraction of total Flavonoids from Polygonum hydropiper
1.6 验证实验 按照最佳工艺条件乙醇浓度60%,料液比1∶30,超声提取时间50 min,超声提取温度80℃,进行重复实验验证。
2 结果与分析
2.1 总黄酮测定方法建立
2.1.1 线性关系考察
2.1.1.1 检测波长的选择 由芦丁和样品的光谱图可知,在波长为345 nm、510 nm处,溶液的吸光度达到两个峰值,考虑到许多物质(溶剂等非黄酮类物质)在345 nm左右均有吸收,杂质干扰较大,故选择510 nm作为最大吸收波长。芦丁、供试品经显色后吸收曲线如图1、2。
2.1.1.2 标准曲线的建立 以吸光度为纵坐标,芦丁标准液的浓度为横坐标,绘制标准曲线,用最小二乘法进行线性回归,回归方程为 y=12.003x+0.0037,相关系数R2=0.9999。芦丁的标准曲线如图3。

图1 芦丁显色后吸收光谱图Fig 1 Absorption spectra of Rutin after coloration
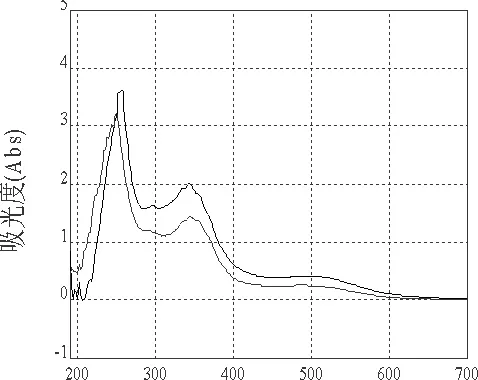
图2 辣蓼供试品显色后吸收光谱图Fig 2 Absorption spectra of Polygonum hydropiper after coloration

图3 芦丁标准曲线图Fig 3 Standard Curves of Rutin
2.1.2 方法学考察
2.1.2.1 精密度试验 日内精密度:同一条件下测定6次吸光度,代入标准曲线,求得总黄酮浓度,计算总黄酮含量的变异系数RSD。日内RSD=1.01%,试验结果见表2。
2.1.2.2 日间精密度 平行操作3份,测定吸光度,同法连续操作3 d,计算总黄酮含量的变异系数RSD。日间RSD=0.58%,试验结果见表3。

表2 日内精密性试验结果Tab 2 The result of within-day precision test

表3 日间精密度试验结果Tab 3 The result of intraday precision test
2.1.2.2 稳定性试验 分别于 0、10、20、30、40、50、60 min测定的吸光度值,利用标准曲线计算总黄酮含量的变异系数RSD。结果显示显色后的供试品在40 min内是稳定的,超过 40 min后,RSD>2.0%,吸光度明显降低,结果见表4。

表4 稳定性试验结果Tab 4 The result of stability test
2.1.2.3 重复性试验 平行操作6份,分别测定吸光度,代入标准曲线方程,计算总黄酮含量的变异系数RSD。结果见表5,RSD为1.45%,说明该方法的重复性良好。

表5 重复性试验结果Tab 5 The result of reproducibility test
2.1.2.4 加样回收率试验 低浓度组、中浓度组和高浓度组分别显色后测定其吸光度,计算加标回收率及相应的RSD值。结果见表6,以芦丁为对照品,检测样品的平均回收率,RSD<2%(n=3),均符合要求。
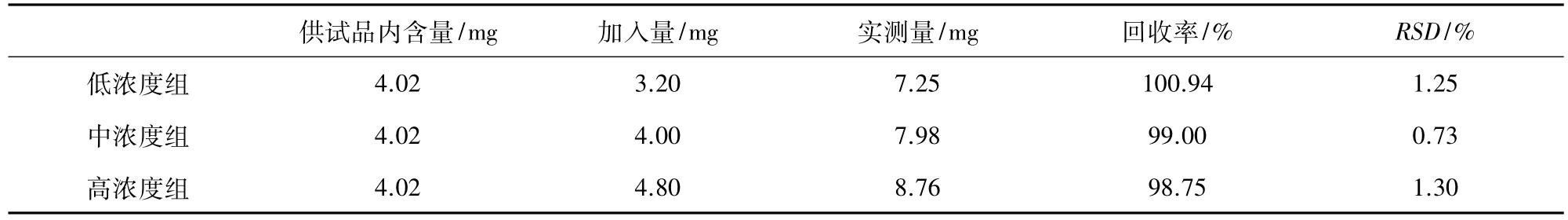
表6 加样回收试验结果(n=3)Tab 6 The result of recovery test
2.2 提取方法的筛选 不同提取方法的总黄酮含量总黄酮含量结果详见表7,提取率从大到小依次为:超声提取法>加热回流提取法>索氏提取法>热水提取法,超声提取法与加热回流提取法总黄酮得率相差不大,但加热回流提取时间长,能耗较大,所以本研究选用超声提取法。
2.3 提取工艺的优化 正交试验中各因素和水平之间的9种组合方式及每组结果见表8。由表8可知,最佳提取工艺条件组合为:A2B3C3D3,考虑到工业生产成本,可选择A2B2C3D3即乙醇浓度为60%,料液比为1∶30,超声提取时间为50 min,超声提取温度为80℃。由RB>RA>RD>RC得其因素影响顺序为料液比>乙醇浓度>提取温度>提取时间。
2.4 验证实验 按照最佳工艺条件乙醇浓度60%,料液比1∶30,超声提取时间50 min,超声提取温度80℃,进行重复实验验证,验证试验结果见表9。从表9可看出,最佳提取工艺条件下RSD为0.68%,具有较好的重复性。

表7 辣蓼不同提取方法的总黄酮含量(单位:mg/g)Tab 7 The total flavonoid content of four kinds of method(unit:mg/g)

表8 辣蓼超声提取法正交实验k(34)设计及结果Tab 8 Design and result of orthogonal experiment of ultrasonic extraction

表9 辣蓼提取工艺最佳条件验证(单位:mg/g)Tab 9 The result of verifying test(unit:mg/g)
3 讨论与结论
根据设备与操作方式不同,总黄酮的提取方法可分为:渗漉法、浸渍法、索氏提取法、加热回流提取法等,不同操作方法各有优劣[11-14]。辣蓼中总黄酮的不同提取方法也有很多文献报道,罗文涓[15]等采用浸提法、水煎醇沉法、超声法、超声酶解法(加纤维素酶)、超声酶解法(加果胶酶)和超声配合酶解法进行辣蓼总黄酮的提取,结果表明,超声法能耗低、得率高,所得的黄酮种类多于浸提法与水煎醇沉法。利用超声提取配合酶解法对辣蓼总黄酮进行提取,得到的黄酮母体结构具有多样性,因此,采用超声提取配合酶解法获得的辣蓼总黄酮得率最高。
实验采用热水提取法、超声提取法、乙醇加热回流法、索氏提取法分别对辣蓼总黄酮进行提取,最终总黄酮含量从大到小依次为超声提取法(52.90 mg/g)>加热回流提取法(50.97 mg/g)>索氏提取法(41.80 mg/g)>热水提取法(17.97 mg/g)。其中热水提取法为最传统的水煎煮法,不借助任何仪器,也无需添加任何溶剂,因此提取率最低;超声提取法为超声辅助醇提法,无论是有效物质的释放,还是释放后的溶解性都比水煎煮法要显著高出很多;而加热回流法和索氏提取法都是借用不同装置和处理进行的醇提法,提取总黄酮含量比超声提取法略低。热水提取法操作简便,试剂廉价易得,但提取率太低;索氏提取法无论在提取率方面还是节约资源方面都并不理想;加热回流提取法与超声提取法总黄酮得率相差不大,但加热回流法两次提取共耗时超过8 h,且能耗大,超声提取大大缩短了提取时间(只需1 h),提取充分,能耗低,操作方便,是较为理想的提取辣蓼总黄酮的方法,所以本次研究最终选用超声提取法进行优化。
正交实验结果显示因素影响顺序为料液比>乙醇浓度>提取温度>提取时间,乙醇浓度为60%,料液比为1∶30,超声提取时间为50 min,超声提取温度为80℃时,总黄酮提取浓度最高,为53.3 mg/g。这与张晶[16]等人利用单因素试验和正交试验得出的超声波辅助提取辣蓼中总黄酮条件略有不同,但与其可提取到的黄酮类化合物含量(55.8 mg/g)相差不大,这可能是因为不同产地的辣蓼对不同条件的适应性不一样,但超声处理均可有助于辣蓼中总黄酮的释放和提取。
