黄芪汤对肾脏集合管细胞ENaC活性的影响作用研究
2019-03-10陈骏良王利臧赢君王浩
陈骏良 王利 臧赢君 王浩

摘 要 目的:研究黄芪汤对肾集合管上皮钠离子通道(ENaC)活性的影响,探索其治疗肾病综合征(NS)水肿的药理机制。方法:将体外培养的小鼠肾集合管M-1细胞分为空白对照组、黄芪汤组和阿米洛利组,分别予纯化的纤溶酶刺激后,以膜片钳测定其膜电流变化。结果:纤溶酶刺激后,空白对照组的膜电流显著增强(P<0.001),黄芪汤组和阿米洛利组的膜电流虽也有升高趋势,但幅度均未达统计学显著水平(P>0.05)。该两组的膜电流增幅间无显著差异(P>0.05),但均显著低于空白对照组(P<0.05)。结论:黄芪汤可抑制肾集合管细胞的ENaC活性,该方治疗NS水肿的药理机制可能与此有关。
关键词 黄芪汤 上皮钠离子通道 膜片钳
中图分类号:R289.5; R256.51 文献标志码:A 文章编号:1006-1533(2019)03-0034-04
Study on the effect of Huangqi decoction on ENaC activity in renal collecting duct cell*
CHEN Junliang**, WANG Li, ZANG Yingjun, WANG Hao(Department of Nephrology, Putuo Hospital, Shanghai University of Traditional Chinese Medicine, Shanghai 200062, China)
ABSTRACT Objective: To investigate the effect of Huangqi decoction on epithelial sodium channel (ENaC) activity in renal collecting duct cell, and to explore the pharmacological mechanism of Huangqi decoction in ameliorating nephrotic edema. Methods: The cultured M-1 mouse collecting duct cells were divided into a blank control group, a Huangqi decoction group and an amiloride group. The changes of their membrane current intensity were measured by patch clamp after stimulation by purified plasmin. Results: After plasmin stimulation, the cell membrane current intensity increased significantly in the blank control group (P<0.001) and increased in the Huangqi decoction group and the amiloride group, however their changes did not reach statistically significant level in the latter two groups (P>0.05). There were no significant differences in the increase of cell membrane current between the Huangqi decoction group and the amiloride group (P>0.05), but they both were significantly lower than that of the blank control group (P<0.05). Conclusion: Huangqi decoction can inhibit ENaC activity in renal collecting duct cell, which may be related to its pharmacological mechanism in ameliorating nephrotic edema.
KEy WORDS Huangqi decoction; epithelial sodium channel (ENaC); patch clamp
水肿是肾病综合征(nephrotic syndrome, NS)的常见临床表现,严重时可危及生命。传统观点多用“低灌注假说”来解释其发病机制:大量蛋白尿引起低蛋白血症,导致血浆胶体渗透压下降,组织间隙发生水肿[1]。但在临床实践中,人们发现许多现象往往与该假说相悖[2-3],故进一步深入探索并发现了NS水肿的新型发病机制:NS时蛋白尿可通过肾内原发机制引起钠潴留,导致有效血容量增加和水腫形成,其核心环节是肾脏集合管顶膜侧的上皮钠离子通道(epithelial sodium channel, ENaC)激活[4-5]。ENaC由α、β、γ三亚基组成,其中γ亚基含有纤溶酶的剪切位点,负责调节通道开闭[6]。NS发病时肾小球滤过膜受损,纤溶酶的前体纤溶酶原可自血循环异常滤过进入原尿,转化为纤溶酶并通过蛋白剪切作用去除ENaC γ亚基上的抑制性肽段,从而大幅提高通道的开放率,促进钠离子重吸收,导致水钠潴留和水肿形成[7-8]。
黄芪汤始载于北宋杨士嬴的《仁斋直指方论》卷十七,方中黄芪益气固表、利水消肿;茯苓利水渗湿、健脾和胃;麦门冬滋阴生津、清心除烦;五味子收敛固涩、补肾宁心;生地黄清热生津、滋阴养血;瓜蒌根清热润肺、消肿排脓;炙甘草益气补中、调和诸药。诸药合而成方,有益气扶正之功,又兼具养阴之效,可治“消渴”,是临床上治疗糖尿病肾病的良方。我们在临床实践中发现,黄芪汤对于NS水肿也具有良好的治疗效果,但其现代药理学机制尚不明确。本研究基于体外细胞实验,研究黄芪汤对ENaC活性的干预作用,以初步探索其利水作用的药理机制,为改善NS水肿的临床疗效提供研究基础和启示。
1 对象与方法
1.1 研究对象和分组
选用M-1细胞(小鼠肾皮质集合管上皮细胞,购自美国菌种保藏中心ATCC)作为研究对象,培养于37 ℃、5% CO2环境下含有5%胎牛血清和5 mmol/L 地塞米松的DMEM:F12中。将M-1细胞分为空白对照组、黄芪汤组和阿米洛利阳性对照组,其中阿米洛利是ENaC的特异性抑制剂。开始检测前,用胰蛋白酶分离M-1细胞并转移至含有5 mmol/L 地塞米松的DMEM:F12中,在37 ℃、5% CO2环境下进行培养,其中黄芪汤组予1 000 mg/ml黄芪汤提取物预孵,阿米洛利组予2 μmol/L 阿米洛利(英国Abcam公司)预孵,24 h后开始检测。三组细胞分别给予纯化的纤溶酶(美国Sigma公司)刺激后,采用膜片钳技术测定其膜电流强度变化。
1.2 含黄芪汤培养基的制备
黄芪汤方剂组成(kg):黄芪2、茯苓2、麦门冬2、五味子1、生地黄3、瓜蒌根2和炙甘草1,共计13 kg。加4倍量水,热回流提取2 h后过滤,挤干滤渣内水分,再重复上述提取、过滤流程2次。合并总共3次所得提取液,减压浓缩为稠浸膏,以95%乙醇调节含醇量为70%,静置过夜。吸取上清液,置于减压干燥箱中,105℃下减压干燥48 h,得干粉提取物。每克提取物相当于7.5 g处方量。称取适量黄芪汤干粉提取物,经涡旋、超声、水浴等方法使其充分溶解于前述培养基中,经0.22 mm滤器过滤并配制成1 000 mg/ml的溶液。
1.3 膜片钳实验方法
细胞内液组成:135 mmol/L 谷氨酸钾,10 mmol/L 氯化钾,10 mmol/L 氯化钠,1 mmol/L氯化镁,10 mmol/L 4-羟乙基哌嗪乙磺酸(HEPES),0.3 mmol/L 三磷酸鸟苷钠, 0.5 mmol/L 三磷酸腺苷镁,2 mmol/L 乙二醇二乙醚二胺四乙酸(EGTA)。
细胞外液组成:10 mmol/L HEPES-氢氧化钠,140 mmol/L 氯化钠,2.8 mmol/L氯化钾,1 mmol/L 氯化镁,2 mmol/L 氯化钙,11 mmol/L 葡萄糖,10 mmol/L 蔗糖。
在室温下进行检测,采用全细胞记录模式。拉制、抛光微玻管电极。低通滤波频率设为2.9 kHz,采样频率设为20 kHz。钳制电位设为–60 mV,钳制时间设为200 ms,由–60 mV向–150 mV给予10 mV步阶电压的脉冲刺激,频率为1次/s,记录–150 mV时的细胞膜电流。经软件处理,计算细胞膜电流强度的变化。
用给药系统将10 μg/ml 纤溶酶缓慢加入至待测M-1细胞附近的细胞外液中,30~60 s后重复检测细胞膜电流,从而计算纤溶酶对M-1细胞膜电流强度的影响。每项测定均取3个不同的细胞重复进行。
1.4 统计学方法
使用PASW Statistics 18.0(IBM,美国)软件。计量资料中符合正态分布的使用独立样本t检验,用均数±标准差表示结果;不符合正态分布的使用独立样本非参数检验,用中位数(下限,上限)表示结果。P<0.05时认为差异达到统计学显著水平。
2 结果
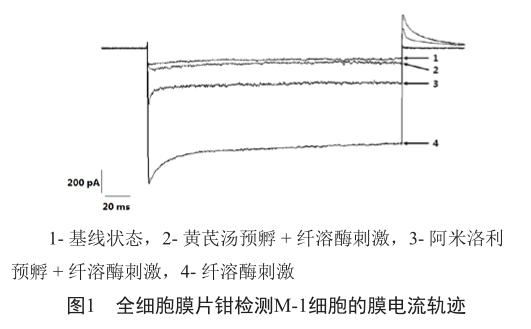
采用全细胞记录模式对M-1细胞的膜电流强度进行测定。在基线状态下,M-1细胞膜上可测得内向电流,予纤溶酶刺激后,膜电流强度明显升高。若予黄芪汤或阿米洛利预孵后再予纤溶酶刺激,其膜电流强度也有小幅增加,但均较预孵前明显减弱(图1)。
分别检测空白对照组、黄芪汤组和阿米洛利阳性对照組的M-1细胞在加入纤溶酶前、后的膜电流强度,并计算其增幅大小。结果显示,予纤溶酶刺激后,空白对照组的膜电流强度显著升高(P<0.001),而黄芪汤组和阿米洛利阳性对照组的膜电流虽也有升高趋势,但其强度变化均未达统计学显著水平(P>0.05)。黄芪汤组和阿米洛利阳性对照组的膜电流增幅间无显著差异(P>0.05),但均显著低于空白对照组(P<0.05)(表1,图2)。
3 讨论
中医理论认为水肿的形成与正气不足、气水失运有关。《黄帝内经》曰“气为血帅,血为气母,气行则血行,气滞则血瘀”;《金匮要略》曰“血不利则为水”。若正气不足,气运失调,则水液气化不利,再加诸外邪因素,可致水液潴留,泛溢肌肤,从而形成水肿[9]。在水肿的治法上,张景岳认为“凡治肿者,必先治水,治水者必先治气”。临床上以益气扶正为治法,气行则水行,水肿自消,是中医治疗水肿的重要原则和方法。本研究中的黄芪汤具有益气扶正之功,又兼具养阴之效,可生精化气,气行则水行,故有利水消肿之效。其治疗NS水肿的作用符合中医理论的相关认知,值得进一步深入研究以探索其现代药理学作用机制。
本研究显示,纤溶酶刺激M-1细胞后其膜电流强度可显著增强,而若予阿米洛利预孵后再予纤溶酶刺激,膜电流强度则较预孵前明显减弱,说明纤溶酶刺激M-1细胞所产生的膜电流可被阿米洛利——ENaC的特异性阻断剂所抑制,证实了该膜电流主要来源于ENaC,纤溶酶对肾脏集合管细胞ENaC具有激活作用,与既往的研究结果相符[4,7]。M-1细胞予黄芪汤预孵后再予纤溶酶刺激,膜电流强度同样较预孵前大幅下降,说明黄芪汤可显著减弱纤溶酶对ENaC电流的刺激效应,其作用强度与阳性对照药物阿米洛利相类似,提示黄芪汤具有对ENaC活性的强效抑制作用。ENaC受抑后肾脏集合管重吸收钠离子减少,可减轻水钠潴留,促进NS水肿消退,这可能是该方利水消肿作用的现代药理学机制所在。
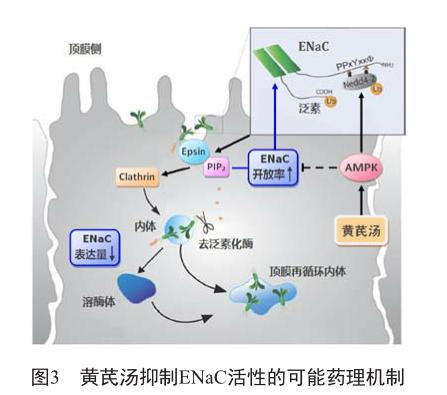
关于黄芪汤抑制ENaC的具體内在机制,既往研究显示其成分之一茯苓可抑制肾脏集合管ENaC的表达水平,使NS大鼠的腹水量减少[10],但黄芪汤整体方剂的作用机制目前尚未完全明确。ENaC的活性取决于其在肾脏集合管顶膜上的表达量和开放率。研究发现,ENaC的膜表达量与泛素通路和网格蛋白(clathrin)依赖性内吞通路有关[11]。肾脏集合管细胞中的泛素连接酶Nedd4-2可与ENaC各亚基的PPxY模体特异性结合,使ENaC发生泛素化并转入clathrin依赖性内吞通路,在clathrin的介导下形成内体囊泡,并最终转运至溶酶体内降解,从而下调其膜表达量[12]。在这一过程中,Epsin蛋白和磷脂酰肌醇-4,5-二磷酸(PIP2)是联系泛素通路和clathrin依赖性内吞通路的核心“桥梁”因子,其中PIP2还可直接结合ENaC从而影响通道开闭,对ENaC的表达量和开放率均具有调控作用。
进一步的研究发现,上述调控机制的上游影响因子是腺苷酸激活蛋白激酶(AMP-activated protein kinase, AMPK)。AMPK可使Nedd4-2发生磷酸化,增强其与ENaC间的结合作用,促使ENaC发生泛素化并经Epsin、PIP2承接转入内吞降解通路,导致其膜表达量下降。同时AMPK也可干扰ENaC和PIP2间的结合作用,从而直接下调ENaC的开放率[13-14]。由此形成了AMPK-泛素-PIP2/clathrin通路,是引起ENaC活性下降的重要调控机制。
本科室研究团队的前期研究发现,黄芪汤可激活AMPK[15]。由此推测,黄芪汤可通过激活AMPK-泛素-PIP2/clathrin通路以下调肾脏集合管ENaC的表达量和开放率,这可能是黄芪汤抑制ENaC活性的药理机制所在(图3),但尚须进一步深入研究以资明确。
本研究以膜片钳(全细胞模式)测定了黄芪汤对肾脏集合管细胞ENaC总体活性的影响,后续研究将进一步采用Western Blot、PCR及免疫荧光测定ENaC的表达分布情况,并采用膜片钳(外面向外模式)检测ENaC的开放率,以进一步探索黄芪汤影响ENaC活性的具体机制。
综上所述,本研究基于体外细胞实验,发现黄芪汤具有对肾脏集合管细胞ENaC活性的强效抑制作用,提示该方利水作用的现代药理学机制可能与此有关,为临床上应用黄芪汤治疗NS水肿提供了一定的研究基础和启示。
参考文献
[1] Siddall EC, Radhakrishnan J. The pathophysiology of edema formation in the nephrotic syndrome[J]. Kidney Int, 2012, 82(6): 635-642.
[2] Bistrup C, Thiesson HC, Jensen BL, et al. Reduced activity of 11beta-hydroxysteroid dehydrogenase type 2 is not responsible for sodium retention in nephrotic rats[J]. Acta Physiol Scand, 2005, 184(2): 161-169.
[3] Brown EA, Markandu N, Sagnella GA, et al. Sodium retention in nephrotic syndrome is due to an intrarenal defect: evidence from steroid-induced remission[J]. Nephron, 1985, 39(4): 290-295.
[4] Svenningsen P, Bistrup C, Friis UG, et al. Plasmin in nephrotic urine activates the epithelial sodium channel[J]. J Am Soc Nephrol, 2009, 20(2): 299-310.
[5] Teoh CW, Robinson LA, Noone D. Perspectives on edema in childhood nephrotic syndrome[J]. Am J Physiol Renal Physiol, 2015, 309(7): F575-F582.
[6] Svenningsen P, Andersen H, Nielsen LH, et al. Urinary serine proteases and activation of ENaC in kidney--implications for physiological renal salt handling and hypertensive disorders with albuminuria[J]. Pflugers Arch, 2015, 467(3): 531-542.
[7] Zachar RM, Skj?dt K, Marcussen N, et al. The epithelial sodium channel γ-subunit is processed proteolytically in human kidney[J]. J Am Soc Nephrol, 2015, 26(1): 95-106.
[8] Svenningsen P, Friis UG, Versland JB, et al. Mechanisms of renal NaCl retention in proteinuric disease[J]. Acta Physiol(Oxf), 2013, 207(3): 536-545.
[9] 李卫国, 马鸿斌. 中医药治疗肾病综合征的研究进展[J].亚太传统医药, 2012, 8(2): 166-167.
[10] Lee SM, Lee YJ, Yoon JJ, et al. Effect of poria cocos on puromycin aminonucleoside-induced nephrotic syndrome in rats[J/OL]. Evid Based Complement Alternat Med, 2014, 2014: 570420. doi: 10.1155/2014/570420.
[11] Wang H, Traub LM, Weixel KM, et al. Clathrin-mediated endocytosis of the epithelial sodium channel. Role of Epsin[J]. J Biol Chem, 2006, 281(20): 14129-14135.
[12] Kabra R, Knight KK, Zhou R, et al. Nedd4-2 induces endocytosis and degradation of proteolytically cleaved epithelial Na+ channels[J]. J Biol Chem, 2008, 283(10): 6033-6039.
[13] Mace OJ, Woollhead AM, Baines DL. AICAR activates AMPK and alters PIP2 association with the epithelial sodium channel ENaC to inhibit Na+ transport in H441 lung epithelial cells[J]. J Physiol, 2008, 586(18): 4541-4557.
[14] Baines D. Kinases as Targets for ENaC Regulation[J]. Curr Mol Pharmacol, 2013, 6(1): 50-64.
[15] 陳霞, 彭文, 曹爱丽. 黄芪汤对糖尿病肾病小鼠AMPKCamkkβ(LKB1)信号通路的影响[J]. 上海中医药大学学报, 2016, 30(5): 46-50.
