激活视网膜水平细胞NMDA受体抑制内向整流钾通道活动
2015-02-26姜晓东阎政礼汪耀珠周桂凤
姜晓东,阎政礼,汪耀珠,周桂凤
(湖南师范大学医学院预防医学系,湖南长沙 410013)
激活视网膜水平细胞NMDA受体抑制内向整流钾通道活动
姜晓东,阎政礼,汪耀珠,周桂凤
(湖南师范大学医学院预防医学系,湖南长沙 410013)
中国图书分类号:R322.91;R329.24;R348.1;R392.11
摘要:目的 探讨视网膜水平细胞上激活NMDA受体对其内向整流钾通道的调控作用。方法 采用酶解分离的视网膜水平细胞进行膜片钳全细胞记录,在给药激活NMDA受体前后,分别记录内向整流钾通道的电流大小;另外在无钙及螯合胞内钙条件下,观察NMDA受体对内向整流钾通道的作用。结果 激活NMDA受体后,内向整流钾通道电流减小,灌流洗脱后电流恢复;在无钙和螯合胞内钙的条件下,激活NMDA受体不能改变内向整流钾通道活动。结论 激活视网膜水平细胞NMDA受体可以通过胞内钙信号抑制内向整流钾通道电流。
关键词:视网膜;内向整流钾通道;钙,胞内钙库;NMDA受体;膜片钳
网络出版时间:2015-9-14 14:53 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150914.1453.056.html
视网膜水平细胞是视网膜外网状层的抑制性中间神经元,其接受来自光感受器细胞的谷氨酸能输入,释放抑制性神经递质γ-氨基丁酸(GABA),反馈抑制光感受器细胞。同时水平细胞的突起广泛伸展于外网状层,横向调节视网膜信息传递,参与双极细胞和神经节细胞的感受野的形成[1]。
水平细胞膜上表达丰富的内向整流钾通道,在细胞超极化时开放,促进钾离子内流,使得细胞恢复在静息电位,对于细胞兴奋性的调节非常重要。同时,也有研究表明,内向整流钾通道的开放可以提升水平细胞对光反应的速率,参与调节视觉信息调控[2]。视网膜内向整流钾通道的下调同时也参与缺血、糖尿病视网膜病变等很多病理调节过程[3-4]。
离子型谷氨酸受体可以分为NMDA受体和非NMDA受体(如AMPA受体)。过去认为NMDA受体主要分布在神经节细胞上,水平细胞上表达的谷氨酸受体是AMPA受体。随后也发现在水平细胞上也同时表达NMDA受体,但其功能缺少研究[5-6]。NMDA受体在神经节细胞上的功能主要是接受突触前的谷氨酸输入,形成动作电位[7]。而水平细胞作为中间神经元,不发放动作电位,作者前期工作表明,激活水平细胞NMDA受体可以抑制GA-BA转运体活动[8]。在视网膜神经胶质细胞(Müller细胞)上NMDA受体的激活,可以抑制内向整流钾通道的活动[9]。在水平细胞上NMDA的该功能尚无研究,基于在鲫鱼视网膜水平细胞上的研究基础,本文NMDA受体的激活对内向整流钾通道是否有调节作用及相关机制进行了研究。
1 材料与方法
1.1细胞分离 根据文献[5],分离的视网膜水平细胞取自成年鲫鱼(carassius auratus,体长15~20 cm)。在通O2的Hank′s液中,将鲫鱼眼球巩膜剪开。分离出视网膜,剪成8~12片,置于含有木瓜蛋白酶(2×104U·L-1)和L-半胱氨酸(5 mmol· L-1)的Hanks′s液体中,在室温下消化20 min。然后用玻璃吸管轻柔吹打视网膜片至溶液浑浊。静置沉降5 min后,取细胞悬浮液于培养皿内镜下依据特异形态观察H1型水平细胞。
1.2全细胞记录和给药 水平细胞的全细胞记录采用Axon 200B膜片钳系统(Axon Instruments,USA),钳制电压为-60mV。记录电极(Sutter In-struments,USA)采用水平拉制仪器拉制,电极电阻在5~8 MΩ。灌充电极内液后,将电极安装在膜片钳夹持器上,之后采用微动操作仪(SD Instruments,USA)操作。参考电极采用Ag/AgCl电极。补偿细胞快、慢电容,并适当补偿串联电阻。数据采集软件采用AxoScope(Axon Instruments,USA),采样率1kHz。数据分析采用Clampfit 9.2(Axon Instru-ments,USA)。
NMDA的快速给药,采用DAD-12给药系统(ALA Scientific,USA)。在所有实验中,NMDA (100 μmol·L-1)与glycine(100 μmol·L-1)共同给药。
1.3溶液 Hank′s液包括(mmol·L-1):NaCl
120,MgSO41.0,KCl 3.0,CaCl20.5,HEPES 20.0,Na-pyruvate 1.0,NaH2PO41.0,NaHCO30.5,glu-cose 16.0。无Mg2+的Ringer′s液含有(mmol· L-1):NaCl 120.0,KCl 5.0,CaCl22.0,HEPES 10.0,glucose 16.0。Ryanodine和thapsigargin采用DMSO配成母液,临用前加入Ringer′s液,DMSO终浓度<0.5%。NMDA和AP-5采用Ringer′s液溶解。Hank′s液和Ringer′s液的pH值采用NaOH调整至7.4。膜片钳记录电极内液包含(mmol· L-1):KCl 140.0,MgSO41.0,EGTA 0.5,CaCl20.05,HEPES 10.0。pH值用KOH调整至7.3。所用药品购买于Sigma公司(St.Louis,MO,USA)。
2 结果
2.1视网膜水平细胞上的NMDA受体和内向整流钾通道 采用急性分离的H1型视网膜水平细胞(Fig 1A)进行全细胞电压钳记录,钳制电压为-60 mV。当快速给予NMDA(100 μmol·L-1)和Gly-cine(100 μmol·L-1)时,可以记录到明显的内向电流,即NMDA受体激活引发的电流,此电流可以被NMDA受体阻断剂AP5所阻断(Fig 1B)。
视网膜水平细胞上的内向整流钾通道可以随细胞膜的超极化而激活。内向整流钾通道可以被溶液中的Cs+所抑制。当灌流液中加入Cs+后,在-120mV超极化所记录的电流由正常时的-1241.1 pA下降到-185.3 pA(Fig 1C)。
2.2激活视网膜水平细胞上的NMDA受体抑制内向整流钾通道的活动 Fig 2A所示1例细胞在全细胞记录模式下,给予-40 mV到-120 mV的阶梯电压,可以观测到内向整流钾通道电流逐渐增强。在-120mV下的电流为-1136.1 pA。当在灌流液中加入NMDA(100 μmol·L-1)和Glycine(100 μmol·L-1),预灌流10 s后,待电流恢复到基线,再改变钳制电压观察内向整流钾通道活动,发现在各电压下,内向电流均有减弱,在-120mV下,内向电流为-583.5 pA。灌流冲洗5 min后,内向电流的幅度得以恢复。以-120mV处的内向为-954.8 pA。Fig 2B所示5个细胞在不同电压下的电流变化,其中的条形图显示5例细胞在-120mV处以正常条件作为归一化标准(100%),在激活NMDA受体后,内向整流钾通道电流下降到正常水平的64.1%±6.2%(P<0.05,paired t-test),灌流冲洗后,恢复到正常水平的84.3%±6.3%(P>0.05,paired t-test)。Fig 2C所示,在100 μmol·L-1的NMDA受体阻断剂AP5存在的情况下,给予NMDA后,内向整流钾通道电流为对照水平的95.1%± 2.7%(P>0.05,paired t-test);灌流冲洗后,恢复到正常水平的92.5%±6.5%(P>0.05,paired t-test),AP5阻断了NMDA对内向整流钾通道电流的调控作用。Fig 3所示不同浓度NMDA对内向整流钾通道抑制效应,剂量-效应曲线采用希尔方程拟合,半效浓度为86.0 μmol·L-1,希尔系数(n)为0.9。
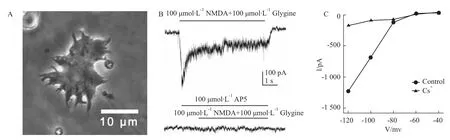
Fig 1 NMDA receptors and inward rectifying potassium channels on a retinal horizontal cell
2.3细胞内钙信号参与NMDA受体对内向整流钾通道的调控 由于NMDA受体激活时,可以向胞内通透钙离子。而钙离子作为细胞的第二信使,参与胞内信号通路调控。为了研究NMDA受体激活所介导的胞内钙浓度增高是否参与对内向整流钾通道的调控,采用无钙离子的细胞外液灌流,并在电极内液中添加BAPTA螯合胞内钙离子。Fig 4所示1例细胞,在-120mV下测定的内向整流钾通道电流为-1467.2 pA,在给予NMDA(100 μmol·L-1)和Glycine(100 μmol·L-1)3 min后,电流为1439.5
pA,灌流冲洗后,电流为1353.8 pA。Fig 4的条形小图表示5例细胞在-120mV处以正常条件作为归一化标准(100%),在激活NMDA受体后,内向整流钾通道电流为到正常水平的96.4%±2.0%(P>0.05,paired t-test),灌流冲洗后,恢复到正常水平的88.0%±4.2%(P>0.05,paired t-test)。
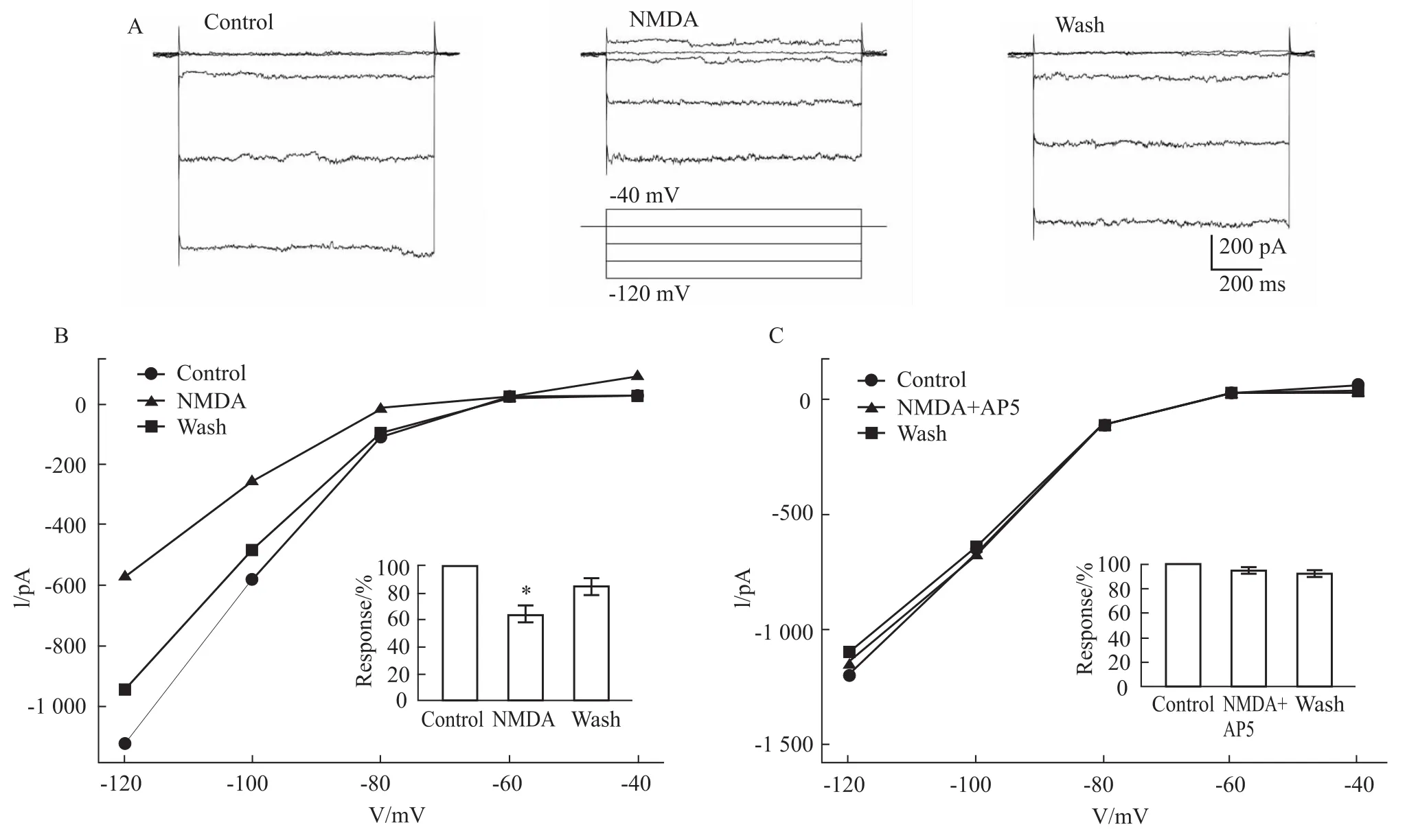
Fig 2 Inhibition of inward potassium currents by activation of NMDA receptors
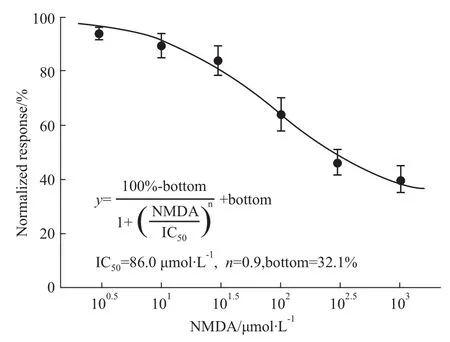
Fig 3 Dose-effect curve of NMDA on inward potassium currents was fitted by Hill equation,in which each point with 5 cells
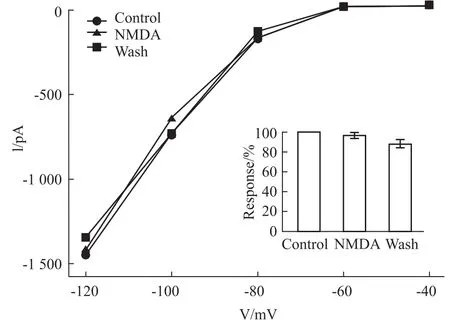
Fig 4 When calcium was removed,I-V curves of a horizontal cell were established under control,application of NMDA and wash con-ditions.Small figure showed NMDA modulation of normalized cur-rents from 5 cells under-120mV.
3 讨论
在视网膜水平细胞上的谷氨酸受体,早期研究集中于AMPA受体的研究,后来发现NMDA受体也共同表达在水平细胞上,但功能尚需缺乏研究[6]。本文在鲫鱼视网膜水平细胞上发现,激活NMDA受体后,内向整流钾通道电流受到抑制。由于NMDA
受体是钙离子通透的,为了验证该离子作为第二信是否参与NMDA受体对内向整流钾通道的调控,在去除灌流液的钙离子的同时,在电极内液中加入钙离子的快速螯合剂BAPTA后,发现激活NMDA受体对内向整流钾通道的抑制作用消失,表明钙信号参与了这个调控过程。根据前期工作,激活视网膜水平细胞NMDA受体的内流钙离子可以通过触发胞内钙库的以钙释钙过程,提升胞内钙离子浓度。钙作为第二信使,进而通过钙调蛋白及其依赖的蛋白激酶信号通路,调节钠离子通道和钙离子通道的功能。在视网膜胶质细胞(Müller细胞)上,激活NMDA受体也是通过钙离子信号途径调节内向整流钾通道活动的[9]。因此,在本文研究的水平细胞上,激活NMDA受体后,钙信号参与了对内向整流钾通道的抑制调控过程。
神经系统中,内向整流钾通道对于细胞内外的钾离子平衡很重要。内向整流是指该通道在细胞膜超极化时候的内向电流大于去极化时的外向电流。内向整流钾通道在视网膜水平细胞上当膜电位负于-30 mV时开放,并随着超极化程度的增强,电流增大。而在细胞去极化时,内向整理钾通道关闭。在视网膜水平细胞上,同时表达延迟整流钾通道、电压门控钠通道和钙通道,这些通道分别处于膜电位高于-20 mV、-30 mV及-40 mV的去极化状态才开放[10]。本文中内向整流钾通道的电流在-120 mV下的超极化下测定,可以排除这些电压门控通道的影响。
在生理条件下,水平细胞内向整流钾通道在去极化(高于-40 mV)时,内向整流钾通道几乎关闭,在-60mV以下开放,钾离子内流,避免细胞过度超极化,有助于细胞稳定在静息电位,参与细胞兴奋性的调控。也有文献报道[2],内向整流钾通道的开放可以提高水平细胞的对光反应速率,调节水平细胞的生理功能。本文中,谷氨酸可以通过激活NMDA受体抑制内向整流钾通道。可以推测,在暗中,光感受器细胞持续释放谷氨酸,通过抑制内向整流钾通道,降低水平细胞对光反应速率,来提高暗中的敏感度;在明亮中,光感受器释放谷氨酸降低,水平细胞内向整流钾通道的抑制解除,对光反应速率提高,进而提升在明亮环境下的视觉的时间分辨率。
在病理条件下,内向整流钾通道促进钾内流,具有保护作用。视网膜在缺血/再灌注条件下[11],Müller细胞内向整理钾通道电流下降;在大鼠糖尿病视网膜病变中,视网膜内向整流钾通道表达下调,导致神经递质重摄取等功能损害[12-13]。在缺血等状态下,视网膜中谷氨酸累积增加,NMDA受体激活[14],抑制内向整流钾通道,可能会加剧损害作用。而避免NMDA受体的过度激活,减弱其对内向整流钾通道的抑制,可能是缓解视网膜病理损伤的潜在靶点。
参考文献:
[1] Hoon M,Okawa H,Della Santina L,et al.Functional architec-ture of the retina:development and disease[J].Prog Retin Eye Res,2014,42:44-84.
[2] Dong C J,Werblin F S.Inwardly rectifying potassium conductance can accelerate the hyperpolarizing response in retinal horizontal cells[J].J Neurophysiol,1995,74(6):2258-65.
[3] Pannicke T,Frommherz I,Biedermann B,et al.Differential effects of P2Y1 deletion on glial activation and survival of photore-ceptors and amacrine cells in the ischemic mouse retina[J].Cell Death Dis,2014,5:e1353.
[4] Zhang Y,Xu G,Ling Q,et al.Expression of aquaporin 4 and Kir4.1 in diabetic rat retina:treatment with minocycline[J].J Int Med Res,2011,39(2):464-79.
[5] Jiang X D,Sun Y,Wang X L,et al.Suppression of gamma-ami-nobutyric acid transporter current by activation of ionotropic gluta-mate receptors on retinal horizontal cells[J].Sheng Li Xue Bao,2009,61(4):299-304.
[6] Shen Y,Zhang M,Jin Y,et al.Functional N-methyl-D-aspartate receptors are expressed in cone-driven horizontal cells in carp reti-na[J].Neurosignals,2006,15(4):174-9.
[7] Atoji Y.Expression of ionotropic glutamate receptors,AMPA,kainite and NMDA,in the pigeon retina[J].Exp Eye Res,2015,136:72-7.
[8] Jiang X D,Wang X L,Sun Y,et al.NMDA modulation of GABA transporter current in carp retinal horizontal cells[J].Brain Res,2008,1240:105-10.
[9] Puro D G,Yuan J P,Sucher N J.Activation of NMDA receptor-channels in human retinal Muller glial cells inhibits inward-rectif-ying potassium currents[J].Vis Neurosci,1996,13(2):319-26.
[10]Malchow R P,Qian H H,Ripps H,et al.Structural and function-al properties of two types of horizontal cell in the skate retina[J].J Gen Physiol,1990,95(1):177-98.
[11]Wurm A,Iandiev I,Uhlmann S,et al.Effects of ischemiareperfusion on physiological properties of Muller glial cells in the porcine retina[J].Invest Ophthalmol Vis Sci,2011,52(6):3360-7.
[12]Bringmann A,Pannicke T,Uhlmann S,et al.Membrane con-ductance of Muller glial cells in proliferative diabetic retinopathy [J].Can J Ophthalmol,2002,37(4):221-7.
[13]Pannicke T,Iandiev I,Wurm A,et al.Diabetes alters osmotic swelling characteristics and membrane conductance of glial cells in rat retina[J].Diabetes,2006,55(3):633-9.
[14]白 双,于 鑫,杜瑛培,等.枸杞多糖对NMDA致大鼠视网膜损伤保护作用的研究[J].中国药理学通报,2013,29(5):670-4.
◇实验方法学◇
[14]Bai S,Yu X,Du Y P,et al.Protective effect of lycium barbarum polysaccharides against NMDA-induced retinal damage in rats[J].Chin Pharmacol Bull,2013,29(5):670-4.
Inhibition of inward rectifying potassium channels by activation of NMDA receptors on retinal horizontal cell
JIANG Xiao-dong,YAN Zheng-li,WANG Yao-zhu,ZHOU Gui-feng
(Dept of preventive medicine Medical College,Hunan Normal University,Changsha 410013,China)
Abstract:Aim To study modulation of NMDA recep-tors on inward rectifying potassium channels through investigation of retinal horizontal cells.Methods Whole cell recording was conducted on isolated retinal horizontal cells for observation of inward-rectifying po-tassium currents before and after application of NMDA.Modulation of inward-rectifying currents by NMDA re-ceptor was also tested under calcium-free and chelation of intracellular calcium condition.Results Reduction of inward rectifying potassium currents was induced by activation of NMDA receptors.The effect was attenua-ted when calcium was removed.Conclusion Inhibi-tion of inward rectifying potassium channels can be in-duced by activation of NMDA receptors via intracellular calcium signals.
Key words:retina;inward-rectifying channel;calci-um,intracellular calcium store;NMDA receptor;patch clamp
作者简介:姜晓东(1977-),男,博士,讲师,研究方向:神经毒理学,E-mail:mailofjxd@gmail.com;周桂凤(1958-),女,博士,教授,研究方向:神经毒理学,E-mail:56946349@qq.com
基金项目:湖南省教育厅青年基金(No 12B074);湖南省卫生厅基金资助(No B2012-62);湖南师范大学教改课题“基于网络课程《毒理学基础》的PBL教学方法实证研究”
收稿日期:2015-06-10,修回日期:2015-07-20
文献标志码:A
文章编号:1001-1978(2015)10-1469-05
doi:10.3969/j.issn.1001-1978.2015.10.028
