lncRNA PACER促进脓毒症急性肺损伤炎症反应的实验研究
2019-03-06史柳嫣位全芳甘志新胡明冬
史柳嫣 辛 伟 位全芳 甘志新 王 丹 胡明冬
急性肺损伤(acute lung injury, ALI)是常见的、发病率和病死率极高的肺部疾病,以肺部严重的急性炎症性反应为特征,因此,有效地抗炎治疗是防治ALI的重要策略之一[1]。近年来,与炎症反应密切相关的长链非编码RNA(long noncoding RNA, lncRNA)在ALI中的重要作用倍受关注。LncRNA是一类长度大于200nt的非编码RNA,lncRNA的异常表达与多种疾病相关,如炎症、肿瘤、心血管疾病、神经系统疾病、代谢疾病等,并密切参与调节这些疾病的发生、发展[2-7]。最近的研究发现,lncRNA PACER(p50-associated COX-2 extragenic RNA)可被细菌脂多糖(lipopolysaccharide, LPS)显著诱导,通过活化NF-κB 促进重要促炎因子COX-2(环氧合酶2)表达,密切参与并促进炎症反应[8-11]。然而,lncRNA PACER在ALI 发生中的可能作用及相关机制未见报道。因此,本文在脓毒症所致急性肺损伤患者的肺泡巨噬细胞中及LPS致ALI小鼠肺组织中PACER表达均显著升高的基础上,进一步观察PACER对ALI的影响并探讨其意义,旨在为深入阐明lncRNA PACER在ALI中的作用与机制提供实验依据,并为进一步明确PACER作为ALI防治的靶标奠定实验基础。
材料与方法
一、实验材料
SPF级C57BL/6小鼠,8周龄(购于陆军军医大学(第三军医大学)动物中心)。THP-1、RAW264.7细胞(购自中科院上海细胞库)。LPS购自美国 Sigma 公司。real time RT-PCR检测试剂盒(美国Promega公司)。RNA提取试剂购、M-MLV逆转录酶(美国Invtrogen公司)。ELISA检测试剂盒购自R&D公司。过表达及敲低PACER慢病毒由上海吉凯公司合成。PCR引物由上海生工公司合成。
二、实验方法
1. 人肺泡巨噬细胞分离培养: 20例急性肺损伤和健康非吸烟者经支气管肺泡灌洗术,获得肺泡灌洗液,经4 ℃ 1 000×g 离心10 min后,去除清液,PBS重悬细胞、再离心、洗涤2次,细胞再用无血清RPMI 1640 培养液制成细胞悬液,于培养皿中,置于37 ℃ 5% CO2培养箱孵育贴壁2 h,除去未黏附细胞,黏附生长在培养皿壁的细胞即为肺泡巨噬细胞,细胞用含有10% FBS,100 U/ ml 青霉素100 μg/ ml 链霉素的RPMI1640 液培养。
2. ALI 小鼠模型建立与分组、处理: 按照每只小鼠10 mg/kg LPS 的剂量,进行腹腔注射,小鼠注射LPS后出现寒战,呼吸频率加快,活动力降低,毛发耸立、解稀水样粪便等症状。将小鼠随机分为正常组(sham)和模型组,其中模型组又分为对照组(control siRNA)、敲低组(PACER siRNA),每组10只。正常组腹腔注射生理盐水0.2 ml;对照组腹腔注射LPS制备脓毒症小鼠模型,于0.5 h后,生理盐水组尾静脉注射生理盐水0.2 ml;敲低组腹腔注射LPS制备脓毒症小鼠模型,于0.5 h后,尾静脉注射PACER siRNA慢病毒0.2 ml。
3. HE染色观察肺脏组织的病理学改变: 取各处理小鼠肺脏组织,置于4% 的多聚甲醛中固定24 h,然后用石蜡包埋,制成5 μm 切片并做HE 染色,最后在倒置显微镜下观察肺脏组织的病理学变化。
4. Real time PCR: 采用TRizol 试剂RNA提取试剂,根据试剂说明方法,提取人肺泡巨噬细胞和小鼠肺组织的总RNA。经M-MLV逆转录酶,按照试剂说明将RNA逆转录成cDNA后,以 cDNA 为模板,按照试剂说明,进行实时荧光定量 PCR实验,检测人和小鼠PACER、IL-6、TNF-α mRNA的表达。引物如下: hPACER F: 5’-TGTAAATA GTTAATGTGAGCTCCACG-3’,R: 5’-GCAAATTCTGGCCATCGC-3’;hIL-6 F: 5’-CAATGA GGAGACTTGCCTGG-3’,R: 5’-GGCATTTGTGGTTGGGTCAG-3’;hTNF-α F: 5’-TCTGGG CAGGTCTACTTTGG-3’,R: 5’-GGTTGAGGGTGTCTGAAGGA-3’;mPACER F: 5’-TCTGTACTGCGGGTGGAACA-3’,R: 5’-CAATTTGCCTGGTGAATGATTC-3’;mIL-6 F: 5’-AGTTGCCTTCTTGGGACTGA-3’,R: 5’-TCCACGATTTCCCAGAGAAC-3’;mTNF-α F: 5’-CAAACCACCAAGTGGAGGAG-3’,R: 5’-GTGGGTGAGGAGCACGTAGT-3’,内参照β-引物序列如下: hβ-actin F: 5’-GTGAAGGTGACAGCAGTCGGTT-3’,R: 5’-GAAG TGGGGTGGTTTTAGGA-3’;mβ-actin F: 5’-TGTTACCAACTGGGACGACA-3’,R: 5’-GGGG TGTTGAAGGTCTCAAA-3’。
5. 细胞和血清炎性因子的检测: 采用酶联免疫吸附试验(ELISA)检测细胞和小鼠血清TNF-α和IL-6水平,严格按照试剂盒所附说明书的操作步。
三、统计学方法
结 果
一、lncRNA PACER在ALI患者和小鼠模型中表达显著升高
20例脓毒症所致急性肺损伤患者和健康非吸烟者经支气管肺泡灌洗术,获得肺泡巨噬细胞;LPS诱导的小鼠ALI模型(n=10),取肺组织,real-time PCR检测lncRNA PACER的表达,结果显示相对于正常组,ALI患者(见图1A)和小鼠ALI模型组(图1B),lncRNA PACER表达均显著升高。

图1 lncRNA PACER在ALI患者(A)和小鼠(B)模型中的表达;与Control 组比较,**P<0.01
二、lncRNA PACER促进细胞炎症因子表达,
过表达PACER慢病毒感染人单核THP-1和鼠巨噬细胞RAW264.7细胞后,与对照组比较,过表达组细胞炎症因子TNF-α、IL-6的表达均升高,其靶基COX-2的表达也显著升高,见图2 A-C;而细胞转染PACER siRNA 后,炎症因子TNF-α、IL-6的表达均降低,COX-2的表达也显著降低,见图2D-F。
三、敲低lncRNA PACER减弱ALI小鼠炎症反应
LPS致ALI小鼠,尾静脉注射PACER siRNA慢病毒后,检测小鼠肺组织和血清炎性因子TNF-α、IL-6的表达,结果显示,与对照组比较,PACER敲低组小鼠肺组织和血清中炎性因子TNF-α、IL-6的表达均显著降低,见图3A,3B,同时,PACER敲低组小鼠肺组织损伤程度明显减弱,见图3C-E。
讨论
本研究首次发现,在脓毒症所致急性肺损伤患者的肺泡巨噬细胞中及LPS致ALI小鼠肺组织中PACER表达均显著升高,进一步研究发现PACER可促进炎性细胞因子表达,以及ALI小鼠的炎症反应和肺损伤,为进一步明确PACER作为ALI防治的靶标奠定了实验基础。
ALI是各种直接和间接因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,形成弥漫性肺间质及肺泡水肿,所导致的急性低氧性呼吸功能不全,其发展至严重阶段为死亡极其高的急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)[12]。ALI/ ARDS的发生与体内一系列基因表达调控的失调密切相关,因此进一步探讨其病理过程中基因表达的调控机制对ALI/ARDS的防治具有重要的理论意义和临床价值。
炎症及其更为严重的脓毒症(sepsis)是导致ALI/ARDS的主要因素之一。因此,有效地抗炎治疗是防治ALI/ARDS的重要策略之一。近年来,与炎症反应密切相关的lncRNA在ALI中的重要作用倍受关注。目前大量的研究发现,lncRNA在生物学过程中充当多种媒介(如充当分子支架、分子向导、分子诱饵、信号通路的调节剂等),其通过影响染色质结构、可变剪接调控、表观遗传修饰、转录后和翻译调控等多种机制参与机体正常和病理生理过程[13-17]。研究发现lncRNA也密切参与了ALI的发生发展过程。据报道lncRNA CASC2通过调节miR-144-3p/AQP1轴减少肺泡上皮细胞促进ALI的发展[18-21]。抑制LncRNA MALAT1可上调miR-146a进而减弱ALI 的炎症反应[22]。脂质受体激动剂BML-111可通过抑制lncRNA MALAT1的表达减弱ALI[23]。在本实验中发现,在脓毒症所致ALI患者和小鼠ALI模型中lncRNA PACER表达均显著升高,提示lncRNA PACER参与了ALI的炎症反应。

图2 lncRNA PACER促进细胞炎症因子的表达结果;注:与NC,Control 组比较,**P<0.01
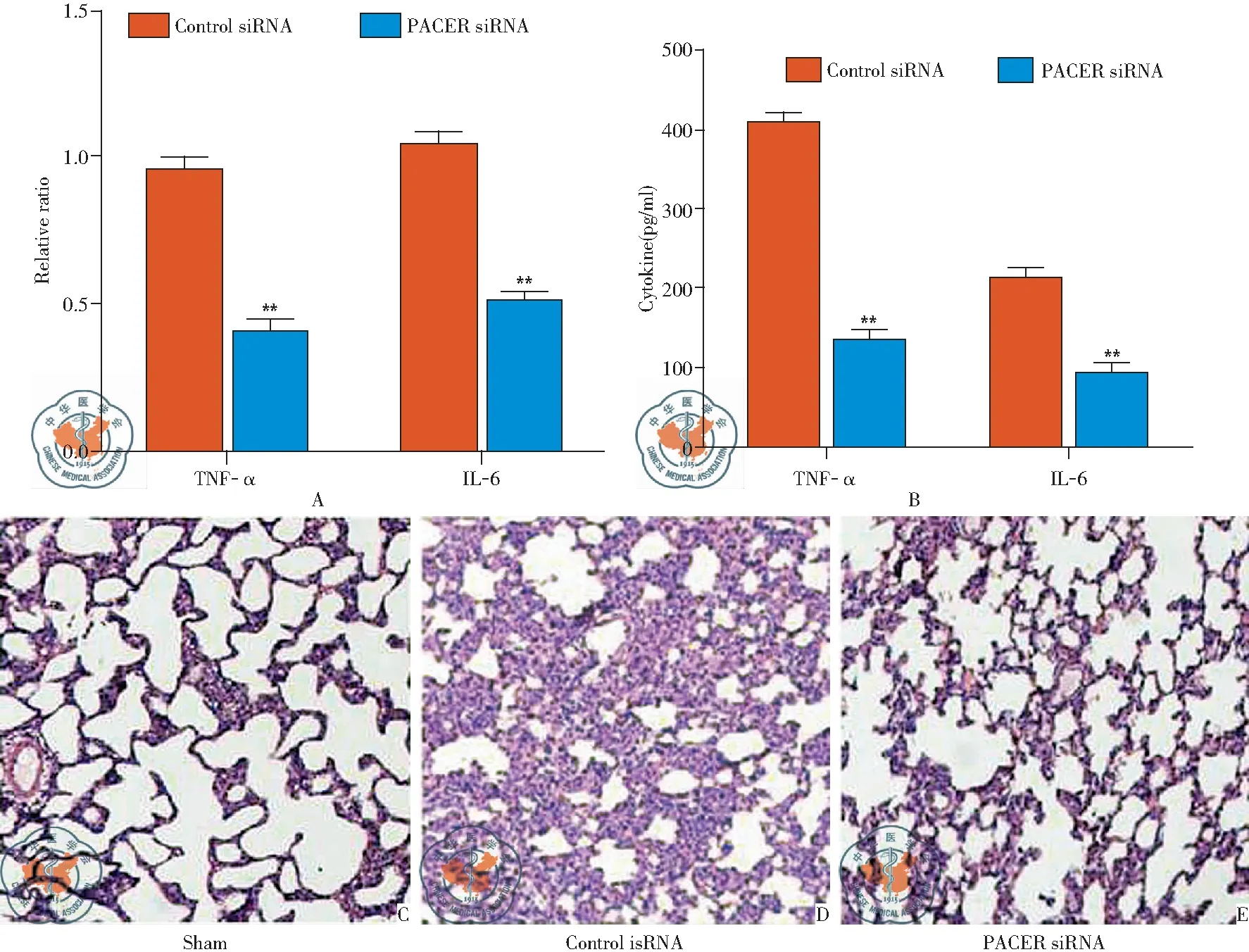
图3 敲低lncRNA PACER减弱ALI小鼠炎症反应(HE×100);注:与Control 组比较,**P<0.01
PACER是新近发现的一个可激活环氧酶-2(COX-2)表达的lncRNA。COX-2密切参与炎症、肿瘤等多种病理生理过程。在炎症、损伤和致癌物质等刺激下,COX-2在巨噬细胞、单核细胞、成纤维细胞、内皮细胞等细胞中表达增加,进而促进炎症因子表达,促进肿瘤细胞生长和转移。研究表明,多个通路可诱导COX-2的表达,包括通过激活PKC、Ras和Wnt通路中MAPK激酶(ERK、JNK、p38)[24-28]。此外,在COX-2启动上转录因子如NF-κB、AP1、CREB C/EBP、NF-IL6、MEF2、TCF4/LEF1等也可促进COX-2的转录活化,诱导其表达[29-30]。而新近的研究发现,lncRNA PACER 在COX-2的上游与抑制COX-2的启动子NF-κB p50相结合,转而促进组蛋白乙酰转移酶p300的募集,转而促进COX-2的表达。那么该作用机制是否与ALI的发生发展相关,以及lncRNA PACER在ALI中的具体作用尚不清楚。因此,在我们的实验中发现,在LPS刺激人单核THP-1和鼠巨噬细胞RAW264.7细胞中,PACER可显著诱导炎症因子的表达,且其重要靶基因COX-2的表达也明显被诱导,并且在ALI模型鼠中,PACER的表达升高,且抑制PACER可减弱ALI小鼠的炎症反应。这提示lncRNA PACER能通过诱导COX-2促进炎症反应,进而密切参与ALI的发生发展,但其与ALI的具体作用及机制仍需深入研究。
综上所述,本文在脓毒症所致急性肺损伤患者的肺泡巨噬细胞中及LPS致ALI小鼠肺组织中PACER表达均显著升高的基础上,进一步观察了PACER对ALI的影响并探讨了其意义,为深入阐明lncRNA PACER在ALI中的作用与机制提供了实验依据,并为进一步明确PACER作为ALI防治的靶标奠定了实验基础。
