Cr(VI)盐胁迫对小麦幼苗抗氧化酶活性的影响
2019-02-20李桂玲王金水
王 琦,李桂玲,王金水
(河南工业大学 生物工程学院,河南 郑州 450001)
铬(Chomium,Cr)是重金属污染源中工业五毒(铬、铅、汞、镉和砷)之一,但低浓度Cr对植物生长发育有一定促进作用,而高浓度Cr将导致作物生长受抑制[1]。近年来,随着印染、电镀、化工等行业的发展,过量Cr随被污染的灌溉水进入农田生态系统,对作物种子萌发和幼苗生长造成危害,导致农作物减产,甚至死亡[2-3],直接或间接危害人类健康[4]。由于Cr对农作物的毒害及其在陆地及水体生态系统中的转移转化[5-6],使得Cr的毒害作用逐渐受到重视。六价铬〔Cr (VI)〕对作物的毒性远远超过三价铬〔Cr (III)〕[7-8],有研究表明,Cr (VI)在小麦幼苗中的累积能力大于Cd2+和Pb2+ [9-10]。植物体内的活性氧 (Reactive oxygen species,ROS) 代谢与抗逆性有着密切关系,ROS包括H2O2、超氧阴离子自由基 (O2·-)和OH-等,逆境胁迫下植物体内会产生大量的H2O2、O2·-、OH-等活性氧自由基,导致膜脂过氧化,进而造成膜系统的氧化损伤[11-12]。植物体内也存在着一系列酶促和非酶促抗氧化剂来消除活性氧自由基,保护植物细胞免受活性氧伤害,维持膜系统稳定性,以增强植株抗逆性[13-14]。在小麦抗氧化胁迫中,超氧化物歧化酶(SOD)响应多种胁迫,能够专一地清除超氧阴离子自由基 (O2·-),是一种广泛的保护性抗氧化酶[15];过氧化氢酶(CAT)和过氧化物酶(POD)主要作用是引起H2O2分解成H2O和O2,减少H2O2对植物造成的伤害[16-17]。小麦种子萌发和幼苗生长对于小麦产量至关重要,萌发关键酶α-淀粉酶和抗氧化关键酶SOD、POD和CAT的活性变化则直接影响小麦种子萌发和幼苗正常生长[18]。笔者所在实验室前期研究Cr (VI) 胁迫下小麦种子萌发和萌发关键酶α-淀粉酶的生理响应表明,Cr (VI) 胁迫下,淀粉酶的活性在一定浓度范围内呈剂量效应,Cr (VI) 临界值浓度为18 mg/L,小麦种子萌发关键形态学指标(胚芽和胚根生长)变化可能是通过淀粉酶对铬胁迫响应实现[8,19]。为了进一步揭示小麦种子萌发和幼苗生长过程中抗氧化关键酶SOD、POD和CAT对Cr (VI) 胁迫的生理响应机制,以温麦6号为材料,采用水培法培养,研究不同浓度梯度Cr (VI) 胁迫培养后小麦种子萌发情况以及SOD、POD和CAT酶活性,旨在从抗氧化酶活性角度解释重金属Cr (VI) 胁迫对小麦种子萌发和幼苗生长的影响机理。
1 材料与方法
1.1 试验材料
供试小麦品种温麦6号,种子购于河南省农业科学院。分析纯重铬酸钾〔K2Cr2O7,Cr (VI)〕,购于华美生物工程公司。
1.2 试验方法
1.2.1 小麦种子培养 挑选大小均一、籽粒饱满的小麦种子,先用5%的H2O2处理5 min,用蒸馏水冲洗3~5遍,再加蒸馏水超过种子最上层2 cm左右,浸种12 h。将小麦种子腹沟向下排列在铺有双层滤纸的培养皿中,每皿40粒,每粒种子间距均匀,以防止发霉种子对健康种子的感染。
1.2.2 试验设计 以K2Cr2O7不同培养浓度为试验对象,设置13个浓度梯度处理(3 mg/L、5 mg/L、10 mg/L、15 mg/L、17 mg/L、18 mg/L、19 mg/L、20 mg/L、25 mg/L、30 mg/L、35 mg/L、40 mg/L和45 mg/L)对小麦种子进行培养,每个浓度梯度均设6个重复,对照为蒸馏水培养。在培养皿中加入不同梯度浓度K2Cr2O7溶液各5 mL,置25℃光照培养箱中培养。其中,3个重复培养时间为3 d,用于根长和芽长测量;另外3个重复培养6 d,用于根长和芽长及抗氧化酶活性测定。
1.3 抗氧化酶液的制备和活性测定
1.3.1 超氧化物歧化酶(SOD) 小麦种子培养6 d后,取幼苗叶片0.500±0.005 g,放入预冷研钵,先加PBS缓冲液2.5 mL (pH 7.8,50 mmol/L)研磨匀浆,再加入PBS2.5 mL 混匀。4℃ 10 000 rpm离心30 min,上清液即为粗提取液,低温贮藏备用。采用氮蓝四唑(NBT)光化还原法测定SOD酶活性[20]。
1.3.2 过氧化氢酶(CAT) 称取培养6 d的小麦相同部位的叶片或根,用蒸馏水洗净,吸干水分,称鲜重。称取1 g,置预冷研钵中,加入2~3 mL 4℃下预冷的pH7.8的磷酸缓冲液和少量石英砂研磨成匀浆后,转入10 mL容量瓶中,并用缓冲液冲洗研钵体数次,合并冲洗液,定容至10 mL,4 000 rpm离心15 min,上清液即为CAT酶粗提液,4℃下保存备用。采用紫外吸收法在240 nm处测定CAT酶活性[21]。
1.3.3 过氧化物酶(POD) 称取培养6 d的小麦相同部位的叶片0.5 g,加入0.2 mol/L(pH 6.0)磷酸缓冲液2.5 mL,于研钵中研磨成匀浆,用磷酸缓冲液定容到10 mL,4 000 rpm离心15 min,上清液即为粗酶提取液,低温保存备用。采用愈创木酚法测定POD酶活性[21]。
1.4 数据处理和分析
利用Excel 2016软件将所测得的数据进行成组数据T检验统计分析。
2 结果与分析
2.1 Cr(VI)处理对小麦种子芽长和根长的影响
2.1.1 小麦胚芽 从图1看出,不同浓度Cr (Ⅵ)处理小麦种子3 d后,低浓度处理的小麦胚芽长度略高于对照,高浓度处理比对照低。与对照相比,Cr (Ⅵ) 浓度为3~15 mg/L促进小麦胚芽生长,其中以浓度10 mg/L的处理极显著高于对照;当Cr (Ⅵ) 浓度18 mg/L时,小麦胚芽与对照基本相同;Cr (Ⅵ)浓度为 20 mg/L时,小麦种子胚芽生长受到极显著抑制;随 Cr (Ⅵ) 浓度继续升高,受抑制程度更为严重,当处理浓度在30 mg/L时,小麦种子芽长仅为对照的85%左右。处理6 d与处理3 d的小麦胚芽生长总体趋势一致(图2)。因此,推测18 mg/L的Cr (Ⅵ) 处理浓度为影响小麦种子萌发和幼苗生长的阈值。
2.1.2 小麦胚根 从图1看出,萌发3 d和6 d的小麦胚根生长均受Cr (Ⅵ)抑制,且抑制效果均达极显著水平。说明,不同浓度 Cr (Ⅵ) 处理后,小麦胚根的生长状况与胚芽不同,Cr (Ⅵ) 对小麦种子胚根生长的抑制作用明显大于胚芽。高浓度(18 mg/L以上)Cr (Ⅵ) 处理时,浓度越高,抑制效应越强,Cr (Ⅵ) 浓度在25~30 mg/L时,处理组根长较对照组低60%以上。
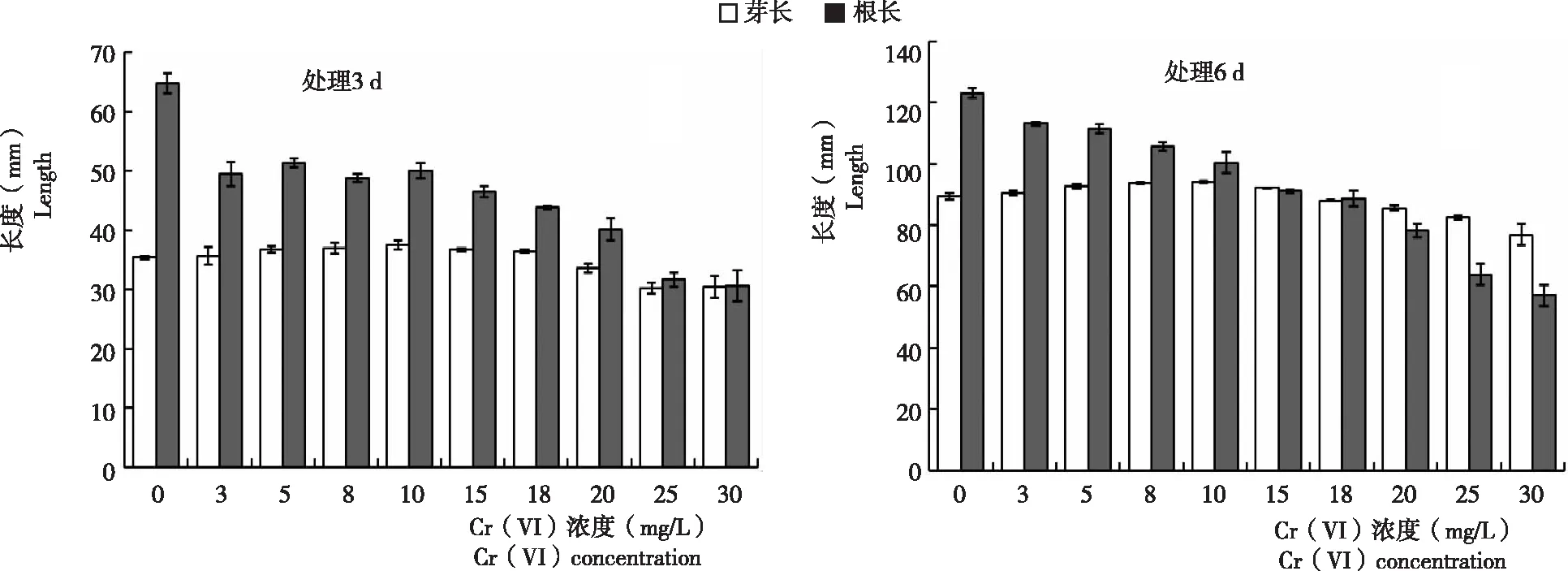
图1 不同浓度Cr(VI)处理小麦种子3 d和6 d小麦胚芽和胚根变化Fig.1 Variation in germ and radicle of wheat seeds treated with different concentration of Cr (Ⅵ) after 3 d and 6 d
2.2 Cr(VI)胁迫培养对小麦幼苗SOD、CAT 和POD 酶活性的影响
从图2可看出,SOD、CAT和POD酶活性随着Cr (VI) 浓度变化而变化。
2.2.1 SOD酶活性 Cr (VI) 浓度为3 mg/L时,小麦叶片SOD活性处理组与对照组无显著变化;15 mg/L时酶活性最高,较对照升高66.91%;随着Cr (VI) 浓度进一步提高,SOD酶活性开始下降,当Cr (VI) 浓度在20 mg/L时,处理组与对照组酶活性几乎相同或略有降低;当Cr (VI) 浓度在25 mg/L以上,SOD酶活性显著下降。Cr (VI) 浓度达45 mg/L时,SOD酶活性仅为对照的68.67%,此时表明植物受到Cr (VI) 胁迫后伤害严重。
2.2.2 CAT酶活性 Cr (VI) 浓度在3~5 mg/L时,小麦叶片CAT酶活性较对照组略有增加,但差异不显著;Cr (VI) 浓度为15 mg/L时,酶活性达最大,比对照增加6.7%;Cr (VI) 浓度为18 mg/L时,酶活性与对照组几乎相同,当Cr (VI) 浓度增加至19 mg/L以上时,CAT酶活性逐渐降低。
2.2.3 POD酶活性 Cr (VI) 浓度3 mg/L时小麦叶片POD酶活性略微下降,随后逐渐上升,在Cr (VI) 浓度15 mg/L时出现峰值,较对照提高52.6%。随着Cr (VI) 浓度继续增大,酶活力逐渐降低,Cr (VI) 浓度在18 mg/L时,POD酶活性与对照组几乎相同,Cr (VI) 浓度在19~45 mg/L时,POD酶活性逐渐降低,此时POD活性受Cr (VI) 胁迫影响最大。
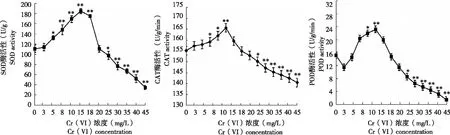
图2 不同浓度 Cr(VI)处理小麦种子6 d小麦叶片的 SOD、CAT和 POD酶活性Fig.2 Leaf SOD,CAT and POD activity of wheat seeds treated with different concentration of Cr (Ⅵ) after 6 d
3 结论与讨论
植物生长过程中不断遭受环境胁迫,在长期的进化过程中,植物通过与环境相互作用,形成相应的防御系统,一方面通过形态结构变化进行防御,另一方面,从生理生化上进行改变以提高防御能力。抗氧化酶系统是研究逆境胁迫下植物抗逆机理的重要内容。本研究以温麦6号为材料,采用水培法研究小麦幼苗生长过程中抗氧化酶(SOD、CAT和POD)对重金属Cr (VI) 胁迫的响应,结果表明,对小麦种子萌发和幼苗生长影响的Cr (VI) 浓度阈值是18 mg/L,即Cr (VI)浓度低于18 mg/L 时促进小麦种子萌发和幼苗生长,高于18 mg/L则起抑制作用;Cr (VI) 对小麦根生长的抑制作用大于对芽生长的抑制。小麦SOD、CAT和 POD酶活性对Cr (VI) 胁迫响应低浓度范围内呈剂量效应,临界值浓度均在18~20 mg/L,即低浓度Cr (VI)促进抗氧化酶活性,高浓度则抑制酶活性。
不同重金属离子对植物的抗氧化酶活性的影响存在差异,这可能与植物对不同重金属离子响应和耐受性程度不同有关。当植物受到重金属胁迫时,通过抗氧化酶系统清除体内过多的活性氧是植物对抗重金属胁迫的重要机制之一[22]。田保华等[2]研究表明,随着Cr6+/Cd2+浓度升高,谷子根和叶片中NADPH氧化酶活性显著增强,高浓度Cd2+、Cr6+可导致POD、CAT和抗坏血酸过氧化物酶(APX)活性显著升高,编码NADPH氧化酶基因SirbohD-F表达升高;而SOD酶活性则表现出低浓度增加高浓度下降趋势,SOD酶活性变化趋势与本研究结果相似。刘凤等[23]研究发现,Cd2+对于小麦根的毒性较强,根对重金属污染胁迫响应较敏感,小麦的根长显著受抑制,Cd2+胁迫时小麦抗氧化酶活性显著升高,这是Cd2+胁迫下小麦的一种防御机制。冯旭等[24]研究表明,Cr3+胁迫显著影响葎草雌雄幼苗的SOD、POD、CAT酶活性,总体上呈低浓度促进、高浓度抑制趋势,与本研究抗氧化酶活性响应重金属Cr (Ⅵ) 变化的趋势一致。赵庆芳等[25]研究认为,Zn2+胁迫下小麦SOD酶活性呈先降低后升高,POD活性则明显受到抑制,CAT活性在Cu2+或Zn2+胁迫下均表现出下降趋势,Cu2+胁迫下小麦SOD活性呈升高的趋势,而POD活性呈先升高后下降的趋势。万永吉等[26]研究表明,秋茄POD活性随着Cr (Ⅵ) 离子浓度提高而逐渐降低。何俊瑜等[27]研究表明,小麦SOD酶活性随着Cd2+浓度升高而升高,CAT和APX酶活性则呈下降趋势。
笔者所在的实验室前期研究发现,低浓度Cr (Ⅲ) 离子和Cr (VI)促进小麦种子萌发和淀粉酶活性提高,高浓度则抑制[8,28]。本研究进一步分析重金属Cr (VI)胁迫对小麦幼苗生长过程中抗氧化酶活性的影响,结果发现,重金属Cr (VI) 在低浓度范围内,促进抗氧化酶活性,使植物免受重金属Cr (VI)的伤害。高浓度重金属Cr (VI) 胁迫时,清除重金属Cr (VI) 胁迫产生ROS的酶活力较低,造成植物受重金属伤害。由此可见,低浓度的Cr (VI) 可提高SOD活性来消除ROS,使其处于相对较低水平,而胁迫后期积累的ROS则由POD和CAT酶分解,这种协调作用在一定程度上可减轻重金属对小麦幼苗造成的伤害。因此,重金属Cr (VI) 对小麦幼苗生长的影响是通过抗氧化酶对重金属的响应实现的。
