不同保存时间对于血液DNA提取质量的影响
2019-02-15
EDTA抗凝血液样本中,经3 000 rpm离心15 min后分为3层,上层为血浆,中间层为白膜层,下层红细胞层。目前生物样本库将血细胞样本统一处理后冻存于-80℃冰箱。如何获取高质量的DNA模板对随后的分子实验成败具有决定作用;为保证DNA结构完整,生理活性正常,一般对采集的新鲜样本进行DNA提取最好,但由于实际情况的限制及课题开展的需要,多数样本需置于冰箱中冻存积攒一定数量后方可取出统一使用[1-3]。随着近年来生物样本库的发展,随着冻存手段及冻存环境的改善,低温冻存生物样本的质量得到了较大提高。本研究旨在通过对不同保存时间血细胞样本的DNA提取质量进行分析,为临床样本的采集方式提供数据支持。
1 材料与方法
1.1 材料
实验仪器:Thermo 台式离心机,Thermo-80℃深低温冰箱,Thermo Nanodrop 2000C超微量紫外分光光度计,天根T Guide M16全自动核酸提取仪,Bio-rad电泳仪(美国),Bio-rad凝胶成像系统。实验试剂:TGuide 血液基因组 DNA 提取试剂盒。
实验材料:2014年1月采集的肘静脉血。
1.2 方法
1.2.1 全血样本前处理 将采集到的5 mL EDTA抗凝血4℃条件下3 000 rpm离心10 min。将其上清(约2.5 mL)吸取后冻存。小心吸取中间白膜500 μL于新的冻存管中。冻存不同时间之后取出白膜,融化后从500 μL白膜中吸取20 μL转入无菌EP管中,并用PBS稀释至200 μL后上机行DNA提取。
1.2.2 DNA提取 根据天根核酸提取仪中配套试剂盒说明书进行DNA提取。
1.2.3 DNA含量和纯度检测 紫外分光光度法测定基因组DNA的含量(ng/μL)以及波长为 260 nm和280 nm的吸光度值(OD260,OD280),根据OD260/OD280的比值来判断DNA的纯度。
1.3 琼脂糖凝胶
利用1×TAE Buffer配置1.5%琼脂糖凝胶。电泳槽中电泳液配置为0.5×TAE Buffer。电泳电压设置为180 V,25 min。
1.4 观察指标
对不同保存方法的DNA得率、DNA完整性进行对比分析。
1.5 统计学分析
每组样品重复4~7份,数据采用SPSS 20.0进行分析,计量资料以(均数±标准差)表示,两个样本均数比较采用t检验,多于两组样本均数的比较,采用方差分析(ANOVA),以P<0.05表示差异具有统计学意义。
2 结果
2.1 Nanodrop 检测相同样本来源不同保存方法所获得DNA得率
新鲜白膜提取的DNA得率最高,为(36.30±4.31)ng/mL。冻存1年后得率显著下降,为(18.84±2.40)ng/mL。随着冻存时间的延长,全血DNA的得率呈下降趋势,冻存1年的全血样本与新鲜的血液样本相比,得率下降幅度较大。而冻存2~4年期间,得率下降趋势较为平缓。冻存2年得率为(14.94±3.73)ng/mL;冻存3年得率为(13.73±1.22)ng/mL;冻存4年得率为(13.85±3.51)ng/mL。通过t检验,分析对比不同冻存时间各组之间得率,差异具有统计学意义(P<0.05)。结果见图1a所示。如图中所示,冻存1年的白膜样本与新鲜全血白膜相比,其得率下降极显著,差异具有显著统计学意义(t=3.624 1,P<0.01);冻存2年的白膜样本与冻存 1 年的白膜样本相比,其得率下降呈显著水平(t=3.185 6,P<0.05);冻存2,3,4年的白膜样本得率比较,差异不具有统计学意义(F=0.521 4,P>0.05),详见图1a。
2.2 Nanodrop检测相同样本来源及不同保存方法DNA的纯度分析
所有抽取的DNA样本OD260/OD280 比值在1.80~1.90之间,说明核酸提取仪提取的样本纯度全部达标。冻存时间对于样本的提取纯度无显著性影响,详见图1b。

图1 不同冻存时间各组得率的差异显著性及纯度分析
2.3 琼脂糖凝胶电泳检测不同保存时间白膜样本的DNA完整性
每孔根据提取 Nanodrop测得的浓度设置不同点样体积,保持点样的DNA总量为50 ng以上。每组样本提取得到的DNA样本条带清晰且单一,均无明显降解现象。4-3条带相对较暗,经回溯对比,是由于4-3样本提取的浓度较低,上样量不够导致,详见图2。
3 讨论
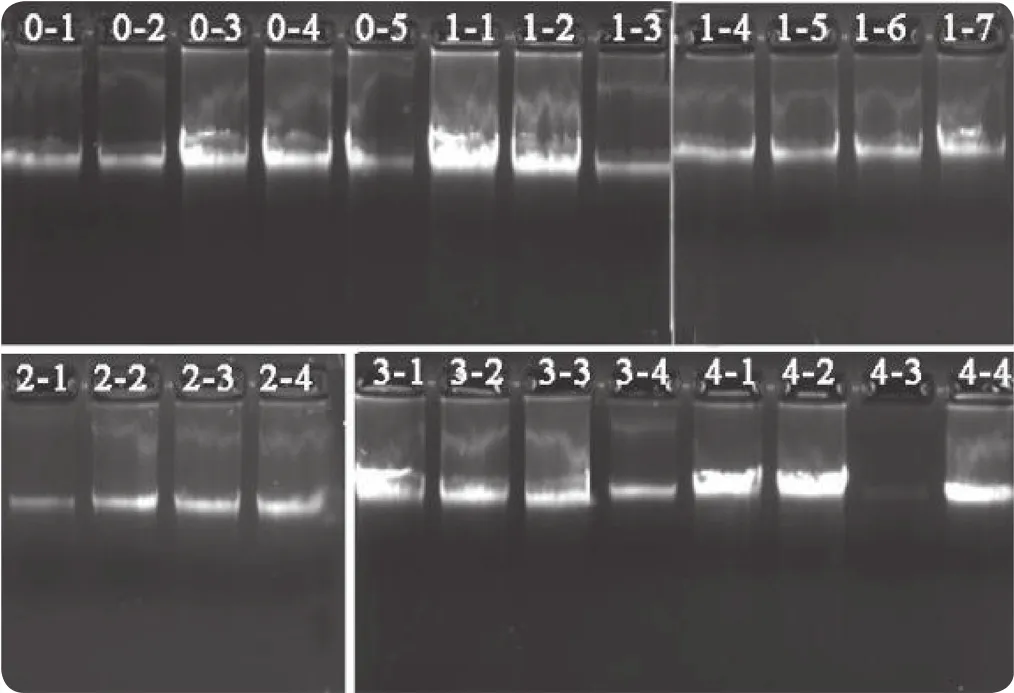
图2 不同冻存时间的白膜样本 DNA 提取琼脂糖凝胶电泳图
血液在离开人体血液循环后会开始发生生理、结构及功能的改变,且血液成分的改变及损伤程度与包括温度、保存液种类、保存时间等多种因素相关;一般情况下,保存血液的损伤程度会随着保存温度的升高、保存时间的延长而递增;且血液成分中损伤较小的是凝血酶原、纤维蛋白原等,损伤较为明显的为白细胞、血小板等[4-6]。保存血液中成分损伤的基础为膜蛋白和膜脂质的含量及构想等方面的改变,导致细胞通透性、细胞形态、细胞活性及细胞功能发生不可逆的改变,进而受损;研究发现,在不改变保存容器和保存液的条件下,血液成分损伤的速度会随着保存温度的改变而得到缓解;有研究发现,在同一保存条件下,4℃和0℃组相比,0℃组的膜收缩蛋白含量、膜的流动性及红细胞形态等指标均显著优于4℃组;由此可见,温度和时间对血液保存至关重要[7-9]。
在实验结果中,发现冻存一年的样本比新鲜白膜样本得率显著下降,有可能是由于冻存过程对于 DNA样本的得率有影响。在生物样本库的管理中,下一步应针对避免反复冻融来制定保护血液样本DNA的冻存措施。本次提取的20 μL白膜其得率已可以满足下一步的实验要求。故后续保存时可以将白膜分装到不同的冻存管中,以避免样本的反复冻融。
经过对不同冻存时间血液白膜样本的 DNA提取发现,新鲜血液的白膜层提取获得的DNA 得率较高,冻存 1 年后提取的得率有明显下降趋势,后续的三年冻存时间对于样本 DNA 的提取得率影响不大,但对所有的样本提取得到的 DNA 纯度及完整性没有显著变化。这与Alexandre Bulla 等的报道一致[10]。分析原因,有可能是对于样本的冻存操作对于DNA 的得率影响较大,冻存-融化过程会对DNA的得率造成一定影响[11],后续实验可以针对冻存-融化次数探究反复冻融对于DNA得率即完整性、纯度的影响。仅仅是得率有所下降,而DNA的纯度及完整性无显著变化,说明样本的质量亦能够满足全基因组测序及下一代测序的要求[12]。
综上所述,在-80℃保存的白膜样本,在最初冻存时有可能会造成DNA数量上的损失,但对于纯度及完整性影响不大。血液样本长期的冻存可以满足目前测序对于DNA质量的要求。
