槲皮素对高糖诱导的脉络膜和视网膜细胞血管生成的影响及其与细胞自噬的关系
2019-02-11李小珩朱巧平
李小珩,李 蓉,朱巧平
(1西北工业大学医院眼科,西安 710072;2西安医学院第一附属医院眼科;3榆林市第一医院眼科;*通讯作者,E-mail:rechelrong198222@163.com)
视网膜和脉络膜新生血管是许多眼病的主要致盲原因,如早产儿视网膜病变、糖尿病视网膜病变(diabetic retinopathy,DR)和年龄相关性黄斑变性,这些疾病分别是儿童致盲、工作年龄成人视力损害以及老年人致盲的首位原因[1-3]。可见,视网膜和脉络膜新生血管危害严重且累及人群广泛,因而近年来眼科领域的研究热点集中于探索抗血管生成的方法与策略。
槲皮素(3,3′,4′,5,7-五羟基黄酮)是在多种水果和蔬菜中发现的一种具有多种生物活性的天然多酚,如洋葱、苹果和草莓等,对人体无毒无害。近年来对槲皮素的研究日益增多,发现其具有抗氧化及清除氧自由基、抗纤维化、抗肿瘤、降血压等许多药理活性[4-6]。在一些实验模型中,已发现这些化合物在体内和体外能抑制肿瘤以及肿瘤血管生长[5-8]。另据报道,槲皮素具有在体内外抑制视网膜和脉络膜血管生成的作用[9,10]。自噬是一种通过溶酶体依赖的降解方式来实现蛋白质和受损细胞器翻转的稳态细胞机制,已有研究提示自噬激活可促进视网膜和脉络膜血管生成[11]。据此推测槲皮素可能通过抑制自噬反应发挥抗视网膜和脉络膜血管生成的作用。已发现槲皮素对糖尿病具有治疗作用[12],但它对DR作用如何还不清楚。基于此,本研究观察槲皮素对高糖诱导的视网膜和脉络膜血管内皮细胞迁移和血管形成过程的影响及其与细胞自噬的关系,旨在为明确槲皮素在治疗DR等视网膜或脉络膜新生血管中的作用提供实验依据。
1 材料和方法
1.1 细胞株、主要试剂与仪器
RF/6A细胞系(中国科学院典型培养物保藏委员会细胞库);DMEM细胞培养基、0.25%胰酶,胎牛血清、青霉素、链霉素、DMSO(美国Gibco公司);槲皮素(美国Sigma公司,溶解于DMSO,浓度为10 mmol/L);LC3抗体、HRP标记二抗(美国Santa Cruz公司);Beclin-1抗体、GAPDH抗体(美国Bioword公司);GFP-LC3质粒(北京义翘神州生物技术有限公司);Lipofectamine 2000、Opti-MEM(美国Invitrogen公司);Matrigel(美国BD公司);CO2培养箱(日本Sanyo公司,MCO-15AC型);酶标仪(美国Thermo公司,Multiskan MK3型);倒置显微镜(日本Olympus公司,IX51型);荧光显微镜(日本Olympus公司,BX53型)。
1.2 细胞处理及分组
将RF/6A细胞置于含有10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素的DMEM培养基中,在37 ℃、5% CO2饱和湿度的培养箱中培养。将处于对数生长期的细胞(5.0×105个/孔)接种于6孔板,待细胞贴壁后,按如下分组处理细胞24 h:对照组(常规培养),高糖组(在DMEM培养基中加入25 mmol/L D-葡萄糖)、高糖+槲皮素组(在DMEM培养基中加入25 mmol/L D-葡萄糖及100 μmol/L槲皮素)。
1.3 Western blot法检测细胞中自噬标志LC3及Beclin-1的表达
裂解细胞提取总蛋白后,将50 μg等量总蛋白加样到SDS-PAGE凝胶上。首先进行电泳分离蛋白,之后将蛋白转移到PVDF膜上。接着在室温下封闭PVDF膜1 h,用稀释的一抗LC3、Beclin-1及GAPDH(均为1 ∶1 000)孵育,4 ℃摇床过夜。充分洗膜后,稀释的HRP标记二抗浸泡PVDF膜,室温下摇床孵育1 h。洗膜后ECL显色,采用ChemiDoc XRS成像系统拍照,并用Quantity One software进行目标蛋白条带灰度信号分析。
1.4 荧光显微镜观察细胞内GFP-LC3融合蛋白的表达
当细胞生长至89%-90%的密度时,根据操作说明,采用Lipofectamine 2000将1 μg GFP-LC3质粒转染RF/6A细胞以瞬时过表达LC3,按照不同分组处理细胞,转染后24 h,在荧光显微镜观察GFP-LC3点状聚集物,计数GFP阳性细胞和GFP阳性斑点细胞(每个细胞中有5个以上明亮的绿色聚集物斑点),在100个细胞里计算GFP阳性斑点细胞占GFP阳性细胞总数的百分比。
1.5 划痕实验检测细胞迁移
用marker笔在6孔板背后画横线,每孔至少穿过5条线,每条线均匀且平行。在每孔内接种约5×105个细胞,过夜后当细胞铺匀培养孔底部后用100 μl灭菌的移液枪头,垂直孔板背后的黑线划痕,使划痕与标记线相交。划线完成后,使用无菌PBS洗涤细胞3次,去除划下的细胞,使留下的间隙肉眼即清晰可见,然后更换新鲜低血清的培养基(1%胎牛血清)。按照不同分组处理细胞,将细胞放入37 ℃、5%CO2培养箱中培养。然后在0 h及24 h取出细胞,在显微镜下观察并拍照。用Image J软件划取6条水平线,计算细胞间距离的均值(划痕宽度)。细胞的相对迁移距离=24 h迁移距离-0 h迁移距离。
1.6 基质胶实验检测细胞管腔形成
实验前24 h将Matrigel置于冰盒中,放入4 ℃冰箱,使胶能过夜缓慢融化,同时准备4 ℃预冷的枪头和96孔板。在超净工作台中,96孔板每孔内缓慢加入200 μl液态Matrigel,37 ℃孵育30 min使基质胶凝固。制备密度为2×105个/ml的单细胞悬液,充分混匀后每孔加入50 μl至96孔板,37 ℃静置8 h,然后在相差显微镜下观察,随机取3个放大200倍的视野采集图像,采用Image J软件对形成的管腔样结构进行计数(3个分叉作为1个血管腔)。
1.7 统计学分析
2 结果
2.1 槲皮素抑制高糖诱导的自噬激活
Western blot实验结果显示,三组RF/6A细胞LC-II/LC3-I比值比较,总体差异有统计学意义(F=60.64,P<0.001)。三组RF/6A细胞Beclin-1的表达比较,总体差异有统计学意义(F=30.90,P<0.01)。进一步组间两两比较发现:与对照组相比,高糖组和高糖+槲皮素组细胞LC3、Beclin-1表达均明显升高(均P<0.05);与高糖组相比,高糖+槲皮素组细胞LC3、Beclin-1表达明显下降(均P<0.05,见图1)。在荧光显微镜下,各组细胞中均可见不同程度的绿色荧光斑点聚集,三组间比较总体差异有统计学意义(F=733.58,P<0.001)。与对照组相比,高糖组和高糖+槲皮素组的GFP阳性斑点细胞比例明显升高,但高糖+槲皮素组比例明显低于高糖组(均P<0.05,见图2,3)。以上实验结果提示,高糖诱导了RF/6A细胞的自噬激活,而槲皮素可在一定程度上抑制高糖诱导的自噬激活。
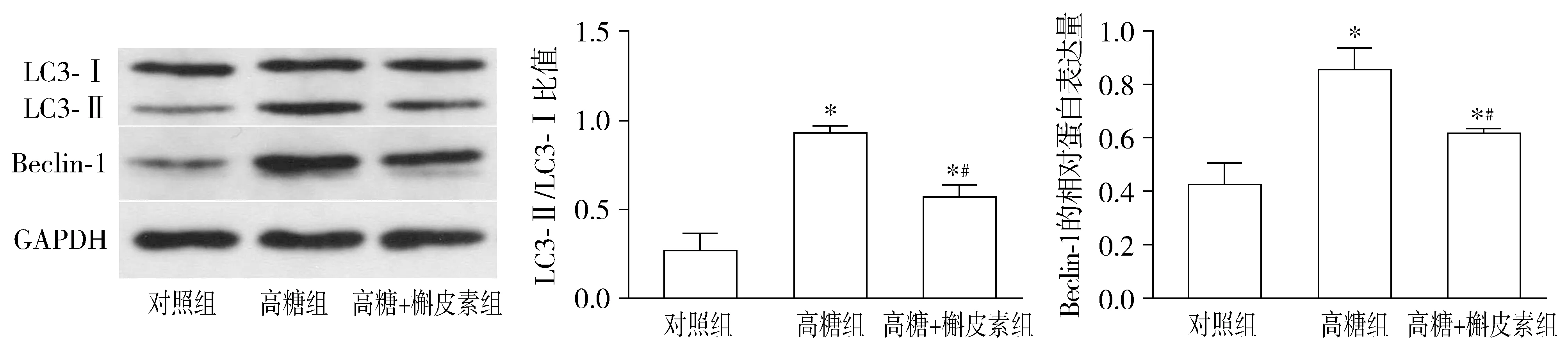
与对照组比较,*P<0.05;与高糖组比较,#P<0.05图1 各组RF/6A细胞LC3、Beclin-1的蛋白表达Figure 1 Expression of LC3 and Beclin-1 in RF/6A cells in each group by Western blot
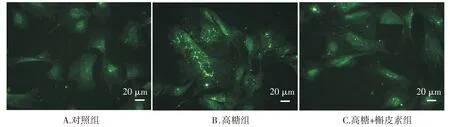
图2 各组RF/6A细胞GFP-LC3融合蛋白的表达Figure 2 Expression of GFP-LC3 fusion protein in RF/6A cells in each group
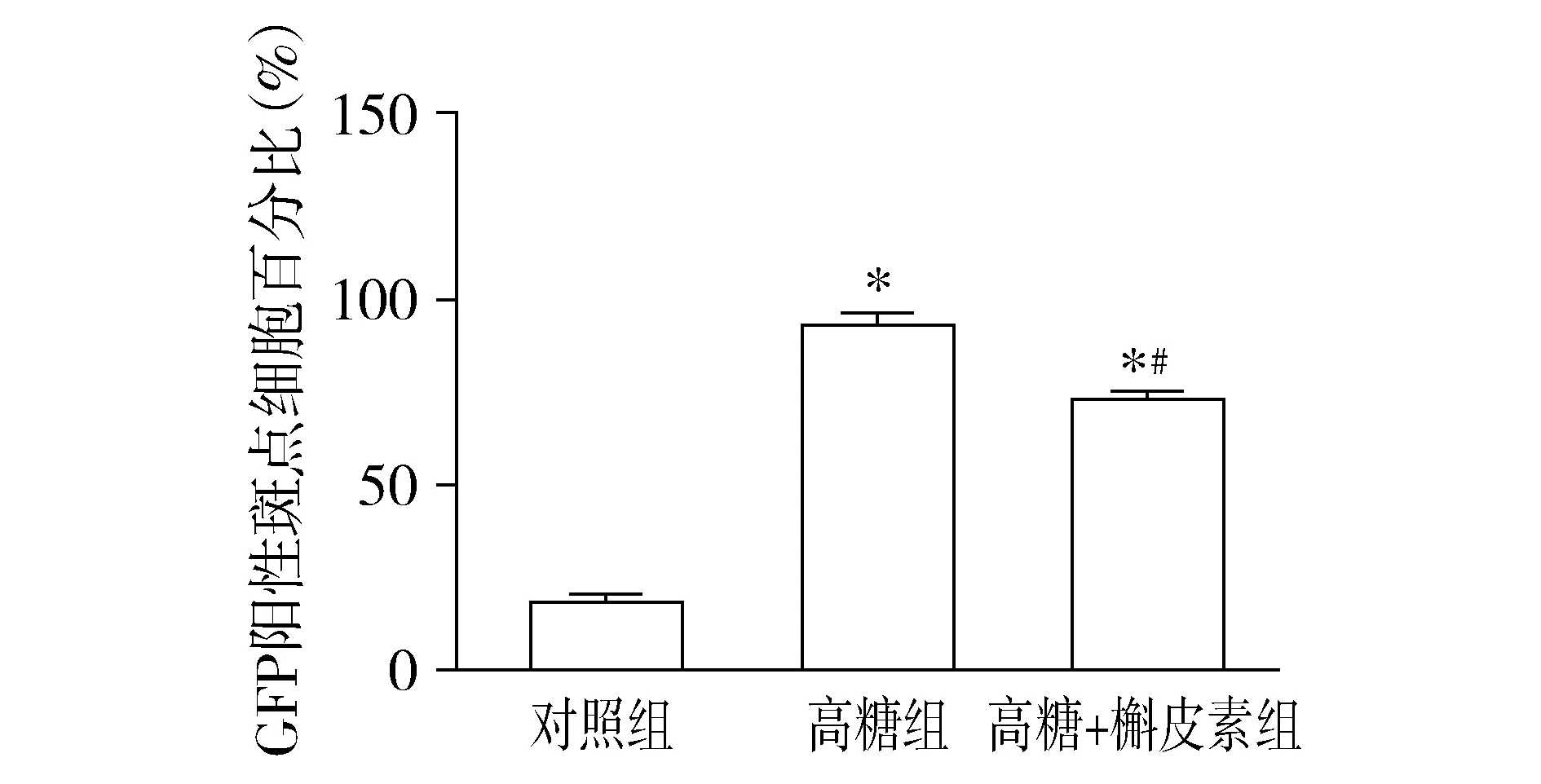
与对照组比较,*P<0.05;与高糖组比较,#P<0.05图3 三组RF/6A细胞中GFP-LC3融合蛋白表达的比较Figure 3 Comparison of GFP-LC3 fusion protein in RF/6A cells among three groups
2.2 槲皮素抑制高糖诱导的细胞迁移
划痕实验结果显示,各处理组细胞均发生不同程度的迁移。3个处理组RF/6A细胞的相对迁移距离比较,总体差异有统计学意义(F=123.89,P<0.001)。与对照组相比,高糖组和高糖+槲皮素组细胞迁移距离均明显增加(均P<0.05)。与高糖组相比,高糖+槲皮素组细胞迁移距离明显减小(P<0.05,见图4)。上述实验结果提示,高糖环境下RF/6A细胞迁移能力明显增强,而槲皮素对高糖诱导的细胞迁移具有一定程度的抑制作用。

图4 细胞划痕实验检测各组RF/6A细胞迁移 (×200)Figure 4 Migration of RF/6A cells in each group by scratch assay (×200)
2.3 槲皮素抑制高糖诱导的管腔形成
Matrigel管腔形成实验结果显示,各处理组细胞均有不同程度的管腔样结构形成。三组RF/6A细胞的血管形成数(个)比较,总体差异有统计学意义(F=32.07,P<0.01)。与对照组相比,高糖组和高糖+槲皮素组细胞管腔形成数明显增多(均P<0.05)。与高糖组相比,高糖+槲皮素组细胞管腔形成数明显减少(P<0.05,见图5,6)。上述实验结果提示,高糖诱导了RF/6A细胞的管腔形成,而槲皮素对高糖条件下的细胞管腔形成能力具有一定程度的抑制作用。
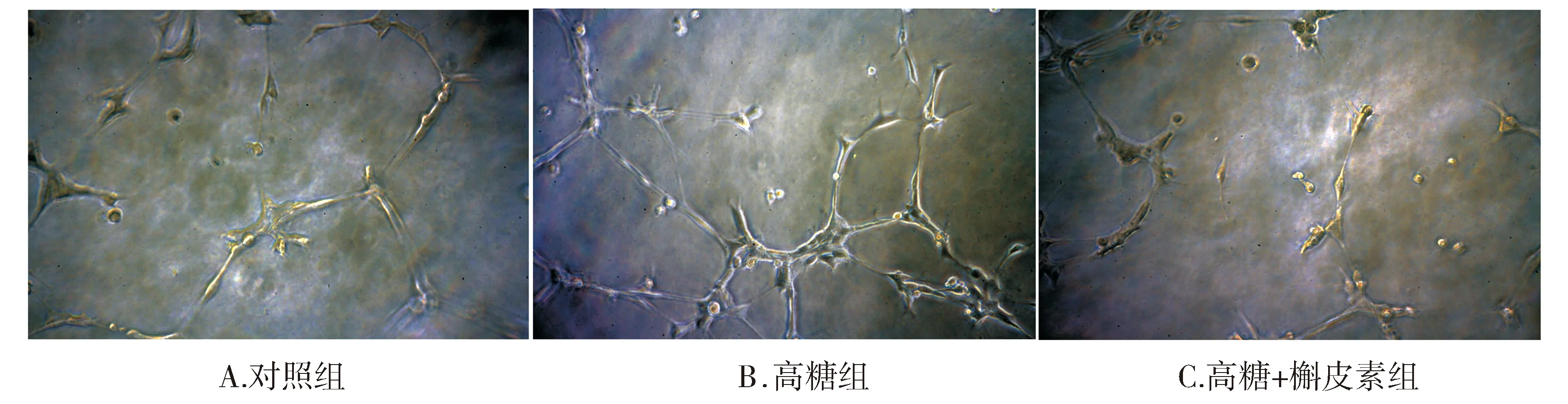
图5 各组RF/6A细胞管腔形成 (×200)Figure 5 Tube formation of RF/6A cells in each group (×200)
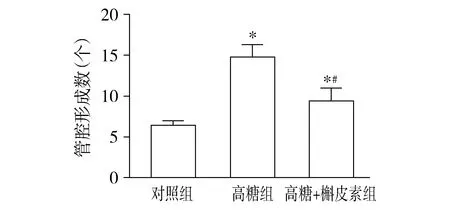
与对照组比较,*P<0.05;与高糖组比较,#P<0.05图6 三组间RF/6A细胞管腔形成的比较Figure 6 Comparison of tube formation in RF/6A cells among three groups
3 讨论
DR是糖尿病进展过程中发生的一个严重微血管并发症,是导致双眼失明最主要的原因[1,13]。长期慢性高血糖导致缺血、氧化应激,炎症激活等病理改变,导致血视网膜屏障破坏,大量促血管生成因子的释放引起视网膜表面渗漏和血管异常增生、出血,最终导致玻璃体积血和视网膜脱离[14,15]。DR导致视网膜的微血管渐进性损伤,从而导致患者视力下降甚至失明,严重影响其身心健康,不仅给个人带来生活上的不便和心理负担,同时带来了沉重的社会负担。虽然现代医疗技术不断进步,但DR的治疗效果仍然欠佳。视网膜血管内皮细胞功能良好是血-视网膜屏障的保障,在高糖环境下,一系列的生化改变导致内皮细胞受损,推进DR的发展。因此认为,在DR的发展过程中,视网膜内皮细胞功能障碍是病情进展的主要因素[16]。
槲皮素是人类饮食的主要生物类黄酮,大量存在于洋葱、苹果、草莓、葡萄、银杏等水果和蔬菜中。研究表明,槲皮素具有很强的抗氧化、抗炎、抗新生血管等性质,在许多疾病中表现出治疗潜能[9,17-20]。肿瘤方面的研究提示,槲皮素抑制肿瘤生长的机制可能与其抑制新生血管生长有很大的关联[7,8,20]。多种内皮细胞被用于研究视网膜血管生成的体外实验,RF/6A细胞是其中常用的一种视网膜特异性细胞,这是一个视网膜和脉络膜结合的细胞系[21],故本研究中使用RF/6A细胞作为实验对象。参考Chen等[9]应用浓度在10-100 μmol/L的槲皮素处理RF/6A细胞后,细胞的增殖、迁移和管腔形成均受到抑制,并且随着槲皮素浓度的增大抑制作用越明显。故本实验采用100 μmol/L槲皮素作用于高糖环境下的RF/6A细胞,结果发现,槲皮素对高糖诱导的RF/6A细胞迁移和管腔结构形成具有明显的抑制作用,提示槲皮素可能有效抑制DR晚期继发的视网膜新生血管形成。
细胞自噬是降解细胞内成分的复杂生理过程,对于维持细胞稳态十分重要[22]。已有研究发现,自噬功能异常在许多疾病的病理机制中发挥重要作用[23-25]。LC3和Beclin-1是自噬形成过程的关键成分,被最常用作自噬分子标记物[26]。LC3以LC3-Ⅰ(胞浆型)和LC3-Ⅱ(膜型)两种形式存在,当自噬发生时,LC3-Ⅰ在泛素样反应酶的作用下与磷脂酰乙醇胺偶联生成LC3-Ⅱ。另外,当自噬激活时,GFP-LC3融合蛋白从胞浆内转移到自噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点。虽然通过电镜检测自噬体及其相关细胞亚结构是检测自噬的金标准,但由于电镜操作及数据分析专业性要求较高,目前最常用的方法是Western blot检测LC3-Ⅰ与LC3-Ⅱ之间的转化和比例变化,以及通过荧光显微镜观察LC3点状聚集物的形成[27]。本研究结合这两种自噬检测经典方法,发现槲皮素作用后,高糖条件下RF/6A细胞表达LC3和Beclin-1蛋白明显降低,GFP-LC3点状聚集物阳性细胞比例也减少,提示槲皮素对高糖诱导的RF/6A细胞自噬激活具有明显的抑制作用。
既往研究已证实,细胞自噬在多种病理情况下可被激活,如缺氧、高糖,进而促进视网膜或脉络膜血管生成过程[11,28]。近年来,国内外研究发现槲皮素的效应与调控自噬存在关联。例如,槲皮素可以减轻高糖对人脐静脉内皮细胞的损伤,而这些有益作用可被自噬抑制剂逆转,提示槲皮素对高糖条件下血管内皮细胞的保护作用是通过激活自噬反应来实现的[29]。槲皮素可抑制肝缺血损伤导致的肝细胞凋亡和自噬,减少炎性细胞因子的释放,从而发挥保护作用[30]。肿瘤方面的系列研究发现,包括槲皮素在内的黄酮类化合物可以诱导自噬,通过非凋亡或非典型凋亡途径直接抑制肿瘤细胞增殖,也可在诱导自噬后进一步引发凋亡等其他致死方式间接抑制肿瘤细胞增殖,或通过抑制保护性自噬从而强化其他形式的杀伤作用[31]。结合本研究结果与文献报道,槲皮素可通过抑制自噬从而对高糖诱导的脉络膜和视网膜血管生成发挥抑制作用,但确切作用机制还需进一步研究证实。
