let-7d抑制剂对海马神经元离体氧糖剥夺/复氧细胞损伤的凋亡抑制作用
2019-02-11李中岩李文媛李雪花
李中岩,李文媛,王 莹,李雪花
(1阜新市中心医院神经外科,阜新 123000;2牡丹江医学院神经组织工程研究所;3阜新市中心医院神经内科;*通讯作者,E-mail:yingwang770224@163.com)
脑缺血/再灌注损伤是一种常见临床疾病,在世界范围内导致高致残率和死亡率。脑缺血/再灌注损伤引起脑损伤能够造成多种神经系统后遗症,包括失语症、偏瘫和痴呆等[1-3]。然而,目前尚缺乏有效的治疗手段。脑缺血再灌注损伤病理过程复杂,目前大量研究证实通过神经生长因子(nerve growth factor,NGF)干预脑缺血/再灌注损伤可能是一种有前景的治疗方法[4]。NGF是神经营养因子家族中最先发现的成员,NGF促进神经元发育和维持细胞表型,保护中枢神经系统胆碱能神经元功能完整性。但目前NGF临床应用仍然存在一些限制,包括NGF有害副作用和应用复杂性[5]。
miRNAs是一组小的非编码RNA,以转录后方式调节基因表达。其通过与目的mRNA的3′非翻译区(3′UTR)结合,导致mRNA降解或翻译抑制。miRNAs通过靶向不同的基因及相关的关键信号通路,参与多种生理和病理过程[6]。大量研究表明miRNAs参与脑缺血/再灌注损伤的病理过程,并调节神经元存活和凋亡过程中各种关键基因的表达,成为脑缺血/再灌注损伤新的生物标记物和治疗靶点[7]。因此探讨miRNA分子表达和功能可以有效揭示脑缺血再灌注损伤的分子机制。
let-7d microRNAs(miRNAs)是let-7 miRNA家族成员。let-7 miRNA最初在秀丽隐杆线虫被发现,其保存在脊椎动物和无脊椎动物中。近来研究发现let-7d能够调节干细胞分化、影响神经变性和神经元再生[8,9],抑制let-7能够促进大鼠心肌缺血再灌注损伤的保护作用[10]。前期研究证实,坐骨神经损伤后let-7d通过直接靶向作用NGF,并抑制其蛋白翻译,显著降低雪旺细胞(Schwann cells,SCs)增殖和迁移[11],但在脑缺血再灌注损伤中let-7d对海马神经元的作用及调控机制国内外尚无报道。研究表明细胞调亡在脑缺血再灌注损伤后神经元细胞的损伤和保护中发挥重要作用,通过氧糖剥夺与复氧(oxygen-glucose deprivation and reoxygenation,OGD/R)模拟体内的脑缺血再灌注病理生理过程,能够诱导神经元细胞凋亡[12]。目前OGD/R海马神经元细胞模型被公认为是最合适的体外模拟脑缺血的模型,常用于从细胞及分子水平研究脑缺血再灌注损伤的机制及药物治疗效果[3,6,7],因此本研究利用OGD/R技术诱导HT22海马神经元损伤模型,模拟“脑缺血”状态。观察转染let-7d模拟物和抑制剂对OGD/R细胞活性和细胞凋亡的作用,探讨let-7d抑制剂对缺血再灌注损伤海马神经元的保护作用机制,为临床脑缺血再灌注损伤治疗提供新的靶点。
1 材料与方法
1.1 细胞培养
小鼠海马神经元HT22细胞系购自广州吉妮欧生物科技有限公司。应用DMEM培养基、10%胎牛血清(FBS)、4.5 g/L葡萄糖和1%青霉素/链霉素培养液培养HT22细胞(均购自美国sigma公司)。
1.2 OGD/R细胞模型制备
将HT22细胞在无糖平衡盐溶液中培养,在三气缺氧细胞培养箱(1% O2、94% N2、5% CO2、37 ℃)培养6 h,用含4.5 g/L葡萄糖的培养基代替无糖平衡盐溶液,在正常条件下复氧培养48 h制备OGD/R模型[1]。未经OGD/R处理的细胞作为正常组,采用HT22细胞完全培养液、正常细胞培养箱(37 ℃、5% CO2)进行培养。
1.3 细胞分组
miRNA-NC、let-7d mimics和let-7d inhibitor购自美国abm公司,应用Lipofectamine 2000(美国Invitrogen公司)按说明书对OGD/R细胞进行转染,将细胞分为正常组、OGD/R+miRNA-NC组、OGD/R+let-7d mimics组和OGD/R+let-7d inhibitor组。
1.4 实时荧光定量PCR(qRT-PCR)
应用Trizol(美国Invitrogen公司)提取总RNA,并用逆转录试剂盒和逆转录酶逆转录cDNA,U6作为let-7d内参照,GAPDH作为NGF内参照。反应体系包括10 ml SYBR Green PCR Master Mix(美国Applied Biosystems公司)、2 ml引物(中国TaKaRa公司)和8 ml cDNA(德国Qiagen公司)。各引物序列为:let-7d上游5′-TGAGGTAGTAGTTTGTACAGTTTGAGG-3′,下游5′-GCAAGGCAGTGGCCTGTACAGTTATC-3′;U6上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。NGF上游5′-CCAAGGACGCAGCTTTCTATC-3′,下游5′-CTGTGTCAAGGGAATGCTGAAG-3′;GAPDH上游5′-TGGTGGGTATGGGTCAGAAGGACTC-3′,下游5′-CATGGCTGGGGTGTTGAAGGTCTCA-3′。利用2-ΔΔCt方法分析。
1.5 细胞活性检测
应用CCK-8细胞计数试剂盒,采用比色法测定细胞活力,即将各组细胞接种在96孔板中并培养过夜,每孔加入10 ml CCK-8溶液在37 ℃下培养2 h,在450 nm波长应用酶标仪测定吸光度值。
1.6 细胞凋亡检测
各组细胞接种在6孔板。加入1 ml Hoechst33342孵育0.5 h,应用50 g/L PI孵育15 min,根据前期研究方法[13]在荧光显微镜下用紫外光激发观察,每组细胞于高倍镜下随机选取视野,计算凋亡细胞数和细胞总数(每组不少于1 000个),计算凋亡率。
1.7 统计学分析
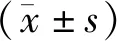
2 结果
2.1 海马神经元细胞OGD/R后let-7d表达降低
qRT-PCR结果表明,与正常组比较,let-7d mRNA在海马神经元细胞OGD/R后6,12,24 h表达显著降低,差异均有统计学意义(P<0.05或P<0.001),在OGD/R后48 h,let-7d mRNA表达升高,与正常组无显著差异(见图1)。
与正常组比较,*P<0.05,***P<0.001图1 qRT-PCR检测海马神经元细胞OGD/R后let-7d mRNA表达Figure 1 The let-7d mRNA expression in hippocampal neurons after OGD/R by qRT-PCR
2.2 let-7d抑制剂降低OGD/R后海马神经元细胞let-7d表达,升高NGF表达
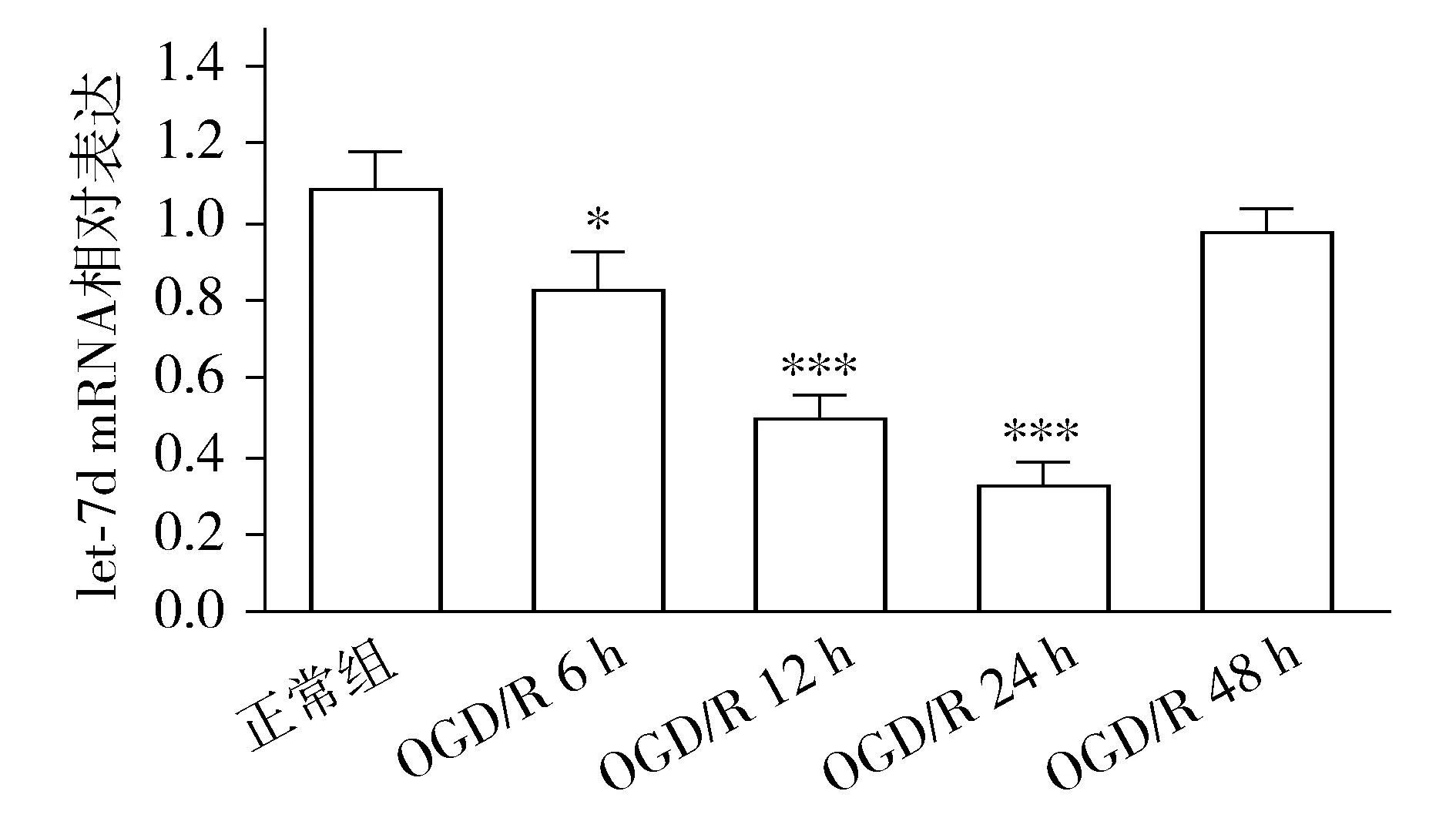
与正常组比较,OGD/R+miRNA-NC组let-7d mRNA表达显著降低。与OGD/R+miRNA-NC组比较,OGD/R+let-7d mimics组let-7d mRNA表达显著增高,而OGD/R+let-7d inhibitor组显著降低(F3,12=165.8,P<0.001)。与之相反,OGD/R+miRNA-NC组NGF mRNA表达较正常组显著升高;与OGD/R+miRNA-NC组比较,OGD/R+let-7d mimics组NGF mRNA表达显著降低,而OGD/R+let-7d inhibitor组NGF mRNA表达则显著升高(F3,12=71.27,P<0.001,见图2)。
与正常组比较,***P<0.001;与NC组比较,###P<0.001图2 qRT-PCR检测各组细胞let-7d和NGF mRNA相对表达Figure 2 The let-7d and NGF mRNA expression in hippocampal neurons in different groups by qRT-PCR
2.3 let-7d抑制剂逆转OGD/R后海马神经元细胞活性降低
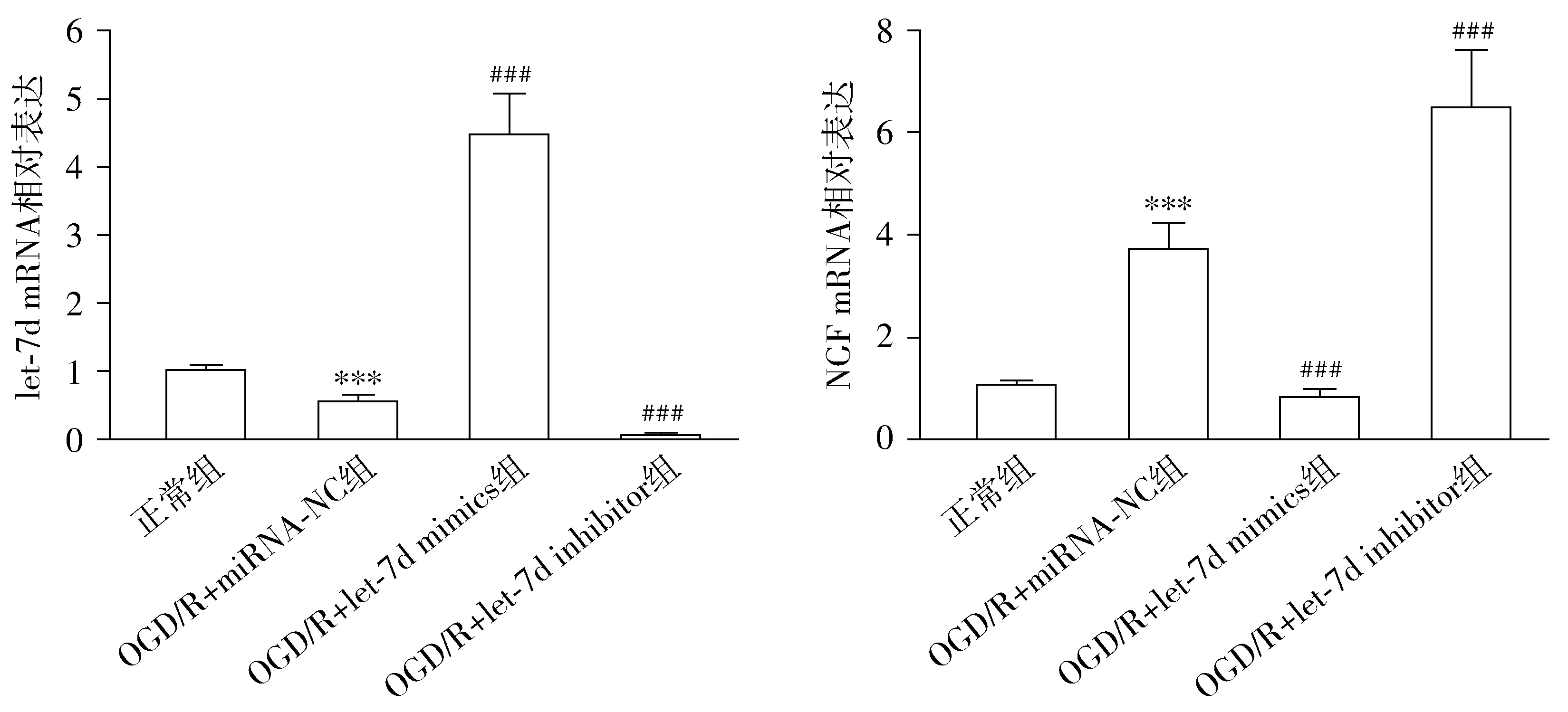
与正常组比较,OGD/R+miRNA-NC组细胞活性显著降低。与OGD/R+miRNA-NC组比较,OGD/R+let-7d mimics组细胞活性显著降低,而OGD/R+let-7d inhibitor组显著增高(F3,12=160.3,P<0.001,见图3)。
2.4 let-7d抑制剂降低OGD/R后海马神经元细胞凋亡率
OGD/R+miRNA-NC组细胞凋亡率较正常组显著增高。与OGD/R+miRNA-NC组比较,OGD/R+let-7d mimics组细胞凋亡率显著增高,而OGD/R+let-7d inhibitor组则显著降低(F3,12=188.0,P<0.001,见图4)。
与正常组比较,***P<0.001;与NC组比较,###P<0.001图3 CCK-8法检测各组细胞活性 (n=3)Figure 3 Cell viability in different groups by CCK8 assay (n=3)
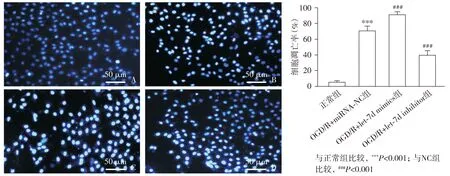
A.正常组; B.OGD/R+miRNA-NC组; C.OGD/R+let-7d mimics组; D.OGD/R+let-7d inhibitor组图4 Hoechst33342/PI双染法检测各组细胞凋亡Figure 4 Cell apoptosis in different groups by Hoechst33342/PI double staining
3 讨论
脑缺血/再灌注损伤是一个普遍存在的全球性临床问题,严重影响患者的生活质量并造成巨大的经济负担,临床治疗促进脑缺血/再灌注损伤神经功能恢复效果有限。microRNAs是内源性编码保守的小RNAs(20-22碱基对),其主要通过促进靶向mRNAs的降解或抑制蛋白质翻译调节基因表达。miRNAs在神经发育、变性和再生中发挥重要调节作用[14]。大量证据表明,miRNAs在脑缺血/再灌注损伤中表达失调,并在调节神经元存活中发挥关键作用[7,15]。
let-7家族由13个成员组成,这些成员在物种间高度保守。它们共享相同的种子序列并靶向不同细胞类型的多个基因[8]。已知let-7家族的多种基因调控Toll样受体4(Toll-like receptor 4,TLR4)、血凝集素样氧化低密度脂蛋白受体(lectin-like oxidized low density lipoprotein receptor-1,LOX-1)、Bcl-xl和AGO1等靶基因,在缺血性心脏病中发挥作用,降低心肌纤维化和心肌细胞凋亡;抑制let-7c可改善心肌梗死后的心脏功能;上调let-7g可通过靶向pik3ip1(急性缺血再灌注损伤时Akt信号通路的抑制剂)保护心肌细胞免受凋亡[16]。上调let-7d可靶向NGF显著降低施万细胞(Schwann cells,SCs)的增殖和迁移,抑制坐骨神经功能恢复[11],但let-7d在脑缺血再灌注损伤中的作用尚未见报道。
let-7d是否参与细胞OGD/R损伤国内外尚无报道,在本研究中首先评估let-7d在海马神经元OGD/R损伤后不同时间点let-7d的表达规律。结果显示OGD/R损伤后6,12,24 h,海马神经元let-7d的表达显著降低,48 h表达水平上调,与对照组无显著差异。表明let-7d可能是参与调节OGD/R诱导的海马神经元损伤的新型miRNA。前期研究证明,坐骨神经损伤后let-7表达降低,并与NGF表达呈负相关。let-7表达降低能够显著促进SCs分泌NGF,促进SCs增殖和迁移,抑制SCs凋亡,对SCs具有显著保护作用[11]。因此本研究推测OGD/R损伤后let-7d表达降低对海马神经元细胞损伤具有同样保护作用,let-7d表达下调可能是OGD/R损伤早期保护性反应,进一步抑制let-7d表达可起到抑制神经元细胞凋亡的作用。为证实这一假说,本研究首先探讨OGD/R与海马神经元细胞凋亡的关系,结果发现,OGD/R组较正常组细胞活性显著降低,细胞凋亡率显著增高,再次证实OGD/R能够诱导神经元细胞凋亡。进一步检测let-7d模拟物和抑制剂对细胞活力和凋亡的影响。结果表明let-7d抑制剂显著降低OGD/R诱导的细胞凋亡,同时显著增加细胞活性。而let-7d模拟物具有相反的效果。这些结果证实抑制let-7d对OGD/R处理的神经元细胞凋亡具有保护作用。
前期研究发现,let-7d miRNA靶向NGF的作用与NGF对中枢神经再生的神经营养作用一致[11]。NGF在神经营养素家族中具有重要地位,其在周围神经系统和中枢神经系统神经元发育和存活中发挥关键作用[17]。同时NGF能够参与免疫和炎症反应[18]。目前重组人神经生长因子(recombinant human nerve growth factor,rhNGF)在临床上应用最为广泛,然而rhNGF对人体的副作用不容忽视,包括肌肉疼痛和注射部位痛觉过敏、半衰期短、不能跨越血脑屏障,以及高剂量时可能的致瘤性[5]。因此,通过神经元细胞分泌NGF的内源性调控可作为外源性NGF的治疗提供替代方案。基于这一考虑,本文研究了let-7d对海马神经元产生NGF的影响,结果表明与OGD/R+miRNA-NC组比较,OGD/R+let-7d mimics组let-7d表达显著增高,NGF表达显著降低。而OGD/R+let-7d inhibitor组作用与之相反。再次证实let-7d在OGD/R细胞模型中靶向调控NGF表达。研究证实NGF作为经典内源性保护因子,能显著抑制细胞凋亡,发挥神经保护作用[19],因此本研究推测let-7d抑制剂调节OGD/R损伤机制可能通过调控NGF信号通路发挥作用。
综上所述,本研究探讨并证实了体外let-7d抑制剂对海马神经元缺血/再灌注损伤的保护作用,其机制可能与上调NGF信号通路,抑制细胞凋亡有关。
