JMJD1A蛋白在宫颈癌细胞增殖中的作用
2019-02-11吴晓玲万秋园樊江波
吴晓玲,万秋园,杨 阳,樊江波
(西安交通大学第二附属医院妇产科,西安 710004;*通讯作者,E-mail:fanjiangbo2004@163.com)
宫颈癌(cervical cancer)是妇女最常见的生殖道肿瘤。我国每年新增病例超过13万,约占全世界总数的1/4,位居妇女生殖道恶性肿瘤的第一位,严重危害妇女的健康和生命[1]。尽管近年来,随着宫颈癌的普查、普治工作的开展,宫颈癌的发病率和死亡率均明显下降,但宫颈癌的发病年龄呈年轻化趋势,且晚期和复发性宫颈癌患者预后较差。因此对宫颈癌发生发展分子机制的深入研究有助于肿瘤的预防和治疗。
组蛋白是真核生物染色体的基本结构蛋白。组蛋白甲基化修饰是表观遗传学的重要研究领域,其在基因调控中起至关重要的作用,并与包括肿瘤在内的多种疾病有关[2,3]。组蛋白去甲基化酶JMJD1A(Jumonji domain containing 1A),又叫JHDM2A、KDM3A,属于JMJD家族,通过羟基化作用使组蛋白赖氨酸去甲基而参与转录调节,是调控H3K9表观遗传学修饰的关键调控因子[4],参与精子生成[5]、能量代谢[6]、干细胞调控,与多种肿瘤的发生和发展相关[7,8],是潜在的抗肿瘤药物的作用靶点。然而目前有关JMJD1A在宫颈癌等女性生殖道肿瘤的研究报道尚不多,因此,本研究旨在探索JMJD1A在宫颈癌发生发展中的作用,期望为宫颈癌的发病机制和防治提供理论依据。
1 材料与方法
1.1 细胞及细胞培养
人宫颈癌细胞株HeLa、SiHa、CaSki和C-33A均购自美国模式培养物集存库(American type culture collection,ATCC)细胞库,为本实验室保存。采用含100 ml/L胎牛血清的DMEM高糖培养基(美国Sigma公司),于37 ℃、5% CO2细胞培养箱中静置培养。取对数生长期的细胞用于后续实验研究使用。
1.2 组织取材与标本处理
48例宫颈鳞状细胞癌组织为2017-01~2018-12间在西安交通大学第二附属医院妇产科住院的宫颈癌住院患者,年龄范围为32-69岁,中位年龄55岁。肿瘤患者术前或取材前均未接受放疗及化疗,早期患者手术行广泛全子宫加/不加双侧附件切除+盆腔淋巴结清扫术,术后进一步病理确诊,于癌灶中心部位切取小块组织。晚期患者在同步放化疗前活检获得癌组织标本。33例正常宫颈组织来自于同时期宫颈HPV及液基细胞学检查均为阴性的子宫肌瘤子宫全切术患者。
所有标本均经查阅病例资料并由本院病理医师复阅HE切片证实。所取组织一部分用新鲜配制40 g/L多聚甲醛(pH 7.4)固定后石蜡包埋处理;另一部分装入已编号的灭菌冻存管中,迅速放入液氮转移罐中,再转至-80 ℃超低温冰箱长期保存,随机抽取8例正常宫颈组织和20例宫颈癌组织进行总蛋白提取待后续实验使用。以上标本的获取均取得患者知情同意。采集程序均符合医学伦理实践的要求。
1.3 免疫组织化学检测JMJD1A蛋白染色情况
采用免疫组织化学SP法检测各组宫颈组织标本中JMJD1A的表达,其中33例正常宫颈组织(NC)和48例宫颈癌(CC)临床标本。所有标本均经常规固定包埋,连续切片后,依次经脱蜡水化、封闭后,加入一抗(鼠抗人单克隆JMJD1A,1 ∶100,美国Santa Cruz公司)4 ℃孵育过夜。次日加入二抗37 ℃孵育30 min后,加入显色剂显色。磷酸盐缓冲液PBS代替一抗作为阴性对照。结果判定:JMJD1A免疫染色采用半定量免疫反应评分(immunoreactivity score,IRS):按染色强度和细胞染色阳性率进行分级。取有代表性的5个高倍视野(×1 000)进行计数。JMJD1A染色阳性者以细胞核呈棕黄色或黄色者为准:未着色为0,淡黄色为1,黄色为2,棕黄色为3;阳性细胞数占细胞总数<10%为0,10%-25%为1,26%-50%为2,51%-75%为3,>75%为4。每张切片染色强度与染色阳性率相乘结果为总评分,大于3分为阳性。
1.4 Western blot检测JMJD1A蛋白表达情况
随机抽取存8例正常宫颈组织和20例宫颈癌组织样本,并将对数生长期的各组宫颈癌细胞提取总蛋白,用BCA法测定蛋白浓度。制备凝胶,样品制备,取等量的蛋白质样品上样,用10%SDS/PAGE电泳后移至PVDF膜,封闭,抗体孵育,其中一抗为鼠抗人JMJD1A单克隆抗体(1 ∶1 000,Santa Cruz)及鼠抗人GAPDH单克隆抗体(1 ∶1 000,Santa Cruz),二抗为HRP-羊抗鼠抗体(1 ∶10 000,PIERCE)。以GAPDH为内参,ECL化学发光显色系统显色,用Image J灰度分析软件进行定量分析。
1.5 细胞转染
取对数生长期的细胞,接种于12孔板,待细胞汇合度至70%-90%,依据Invitrogen公司Lipofectamine 2000转染试剂盒说明进行细胞转染。含JMJD1A的shRNA序列载体购自上海吉玛基因公司。实验设有3个组:空白对照组(HeLa/SiHa):转染时只加入无血清DMEM;阴性对照组:加入negative control shRNA(HeLa-Ctrl/SiHa-Ctrl);实验组:加入JMJD1A特异性shRNA(HeLa-shJMJD1A/SiHa-shJMJD1A)。将转染后的细胞中加入适宜的G418筛选阳性克隆细胞株,经Western blot法鉴定。
1.6 MTT实验
采用MTT分析法检测阴性对照组(HeLa-Ctrl/SiHa-Ctrl)和实验组(HeLa-shJMJD1A/SiHa-shJMJD1A)的细胞活力。将上述各组细胞以8×104/孔细胞密度种植于96孔板中常规培养7 d,每隔一天(即分别于培养的第1,3,5,7天)取出加入MTT溶液(Sigma公司,5 mg/ml)20 μl,继续孵育4 h后,弃去上清,加入DMSO 150 μl/孔,震荡10 min,活细胞数量用分光光度计测定各孔在490 nm的吸光度值,根据结果绘制细胞生长曲线(每次实验每组设置6个复孔实验重复3次)。
1.7 裸鼠成瘤实验
分别取对数生长期的阴性对照组(HeLa-Ctrl/SiHa-Ctrl)和实验组(HeLa-shJMJD1A/SiHa-shJMJD1A)细胞(1×106个),在4-6周龄的雌性BALB/c裸鼠(上海SLAC公司)背部皮下注射接种,每隔3 d观察记录一次成瘤情况,共观察33 d。按公式V=ab2/2(a为长,b为宽)计算移植瘤体积,绘制生长曲线图。整个动物实验操作流程经西安交通大学医学院动物保护与使用委员会批准。实验结束,处死裸鼠,完整取出移植瘤并称重记录。
1.8 统计学分析
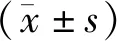
2 结果
2.1 JMJD1A在正常宫颈组织与宫颈癌中的表达情况
与正常宫颈组织比较,JMJD1A表达在宫颈癌组织中显著升高(见图1A)。免疫组化染色半定量免疫反应评分(IRS)示:JMJD1A染色在宫颈癌组织中的表达评分为7.4,明显高于正常组织中的2.7(P<0.001,见图1B)。
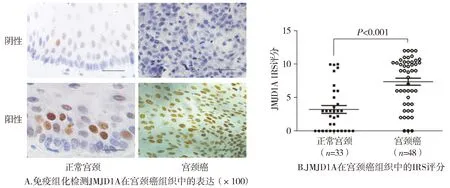
图1 JMJD1A在宫颈癌组织中的表达情况Figure 1 The expression and IRS of JMJD1A in normal cervix and cervical carcinoma specimen using IHC
2.2 正常宫颈组织及宫颈癌组织中JMJD1A的Western blot检测结果
Western blot结果显示,相对于正常宫颈组织,宫颈癌组织中JMJD1A蛋白水平显著升高,蛋白水平定量分析其差异具有统计学意义(P<0.01,见图2)。
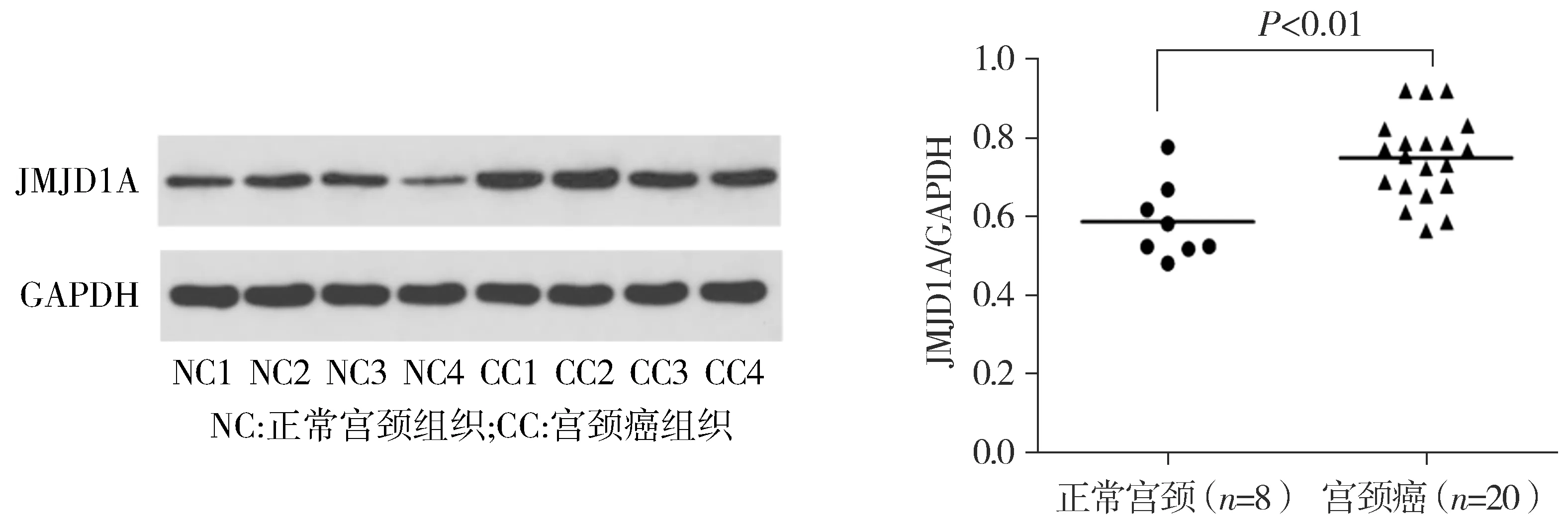
图2 Western blot检测JMJD1A在正常宫颈和宫颈癌组织中的表达Figure 2 JMJD1A expression in normal cervix and cervical carcinoma tissues by Western blot
2.3 shRNA干扰对宫颈癌细胞中JMJD1A表达的影响
Western blot结果显示,JMJD1A蛋白高表达于各宫颈癌细胞株中,其中以CaSki细胞中表达最高。利用JMJD1A-shRNA质粒稳定干扰宫颈癌细胞系HeLa和SiHa中JMJD1A的表达,结果显示,与对照组细胞(Ctrl)相比,shRNA可显著降低细胞中JMJD1A蛋白表达水平(见图3)。

图3 Western blot检测JMJD1A在宫颈癌细胞系中的表达及干扰效率Figure 3 The expression of JMJD1A in cervical cancer cell lines and interference efficiency by Western blot
2.4 干扰JMJD1A表达显著抑制宫颈癌细胞增殖能力
MTT实验结果显示,HeLa细胞中,与对照组(Ctrl)相比,随着时间延长,干扰JMJD1A表达后明显抑制了宫颈癌细胞的生长速度及细胞活性,于培养第5天及第7天时各干扰组与对照组间差异均有统计学意义(P<0.001,见图4),说明JMJD1A下调可以显著抑制宫颈癌细胞的体外增殖能力。在SiHa细胞中,我们得到与HeLa细胞相一致的结果。
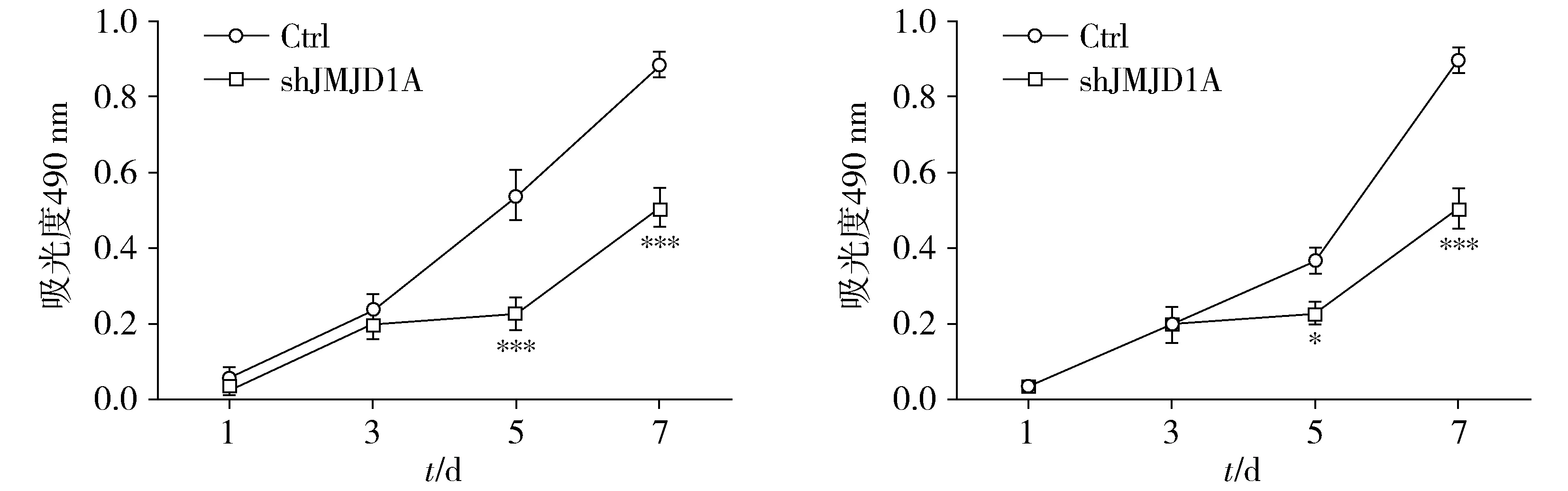
A.HeLa细胞 B.SiHa细胞与相应对照组比较,*P<0.05,***P<0.001图4 MTT法检测JMJD1A对宫颈癌细胞生长的影响Figure 4 Effect of JMJD1A on proliferation of HeLa and SiHa by MTT
2.5 干扰JMJD1A表达对宫颈癌移植瘤生长的抑制作用
裸鼠移植瘤生长曲线图显示,各组种植瘤持续生长33 d,于第33天时拍照记录并处死裸鼠获取肿瘤。与对照组相比,JMJD1A干扰后HeLa细胞肿瘤生长曲线缓慢上升,生长速度明显低于对照组,两组之间差异具有统计学意义(F=8.861,P<0.001,见图5A)。于第33天获取移植瘤,与对照组相比,JMJD1A干扰组移植瘤平均质量显著减小[(1.190±0.569)gvs(0.620±0.384)g,P<0.001,见图6A]。在SiHa细胞中也得到了相似的结果,JMJD1A下调后裸鼠移植瘤生长速度明显低于对照组,两组间差异有统计学意义(F=10.23,P<0.001,见图5B),移植瘤质量差异也有统计学意义(P<0.01,见图6B)。以上结果提示JMJD1A下调后显著抑制宫颈癌细胞体内移植瘤的生长。
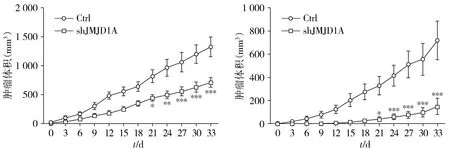
A.HeLa细胞肿瘤生长曲线 B.SiHa细胞肿瘤生长曲线与相应对照组比较,*P<0.05,**P<0.01,***P<0.001图5 JMJD1A下调后显著抑制宫颈癌细胞裸鼠移植瘤的生长Figure 5 JMJD1A downregulation significantly suppressed the growth of xenografts in HeLa and SiHa cervical cancer cells in vivo
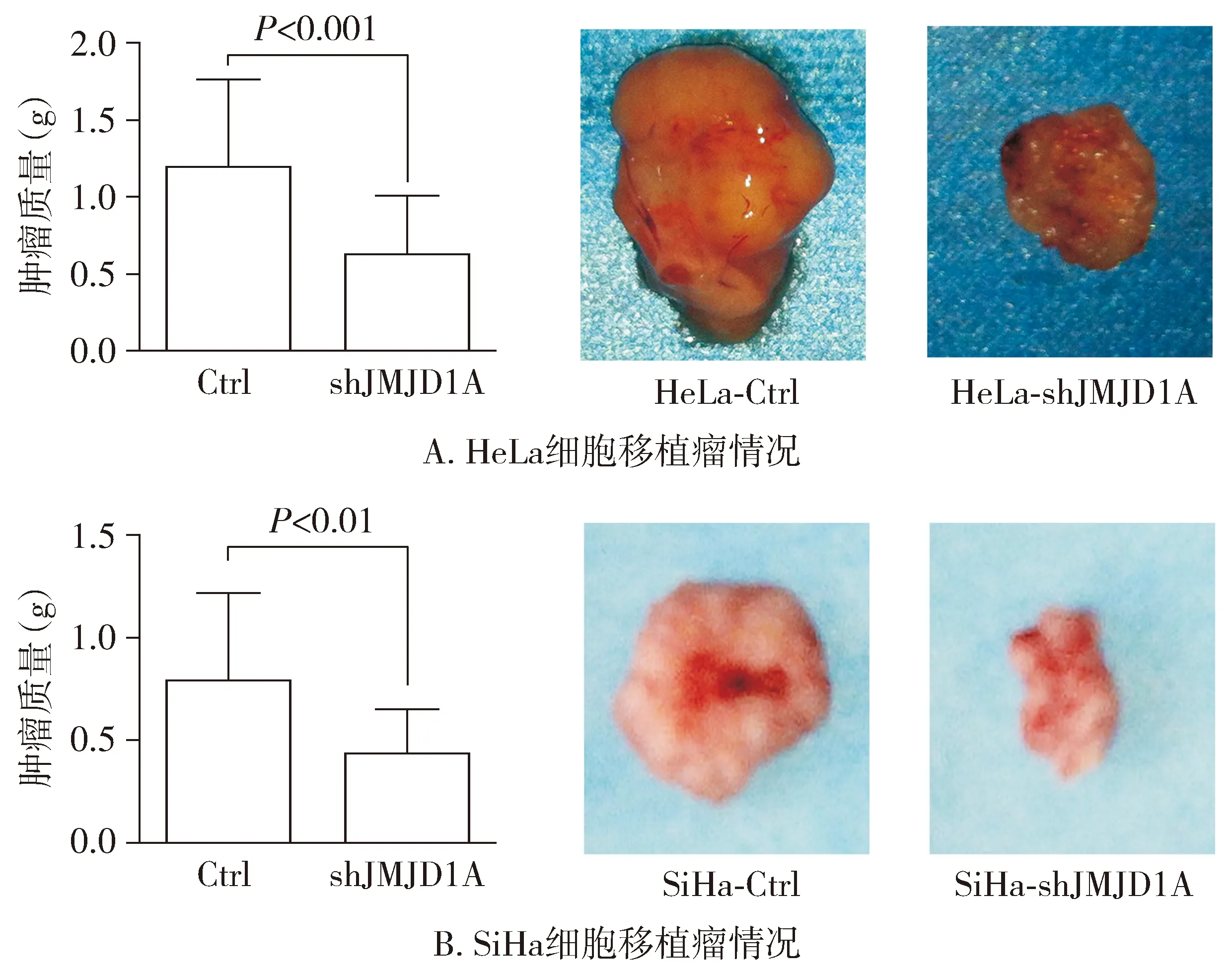
图6 JMJD1A下调对宫颈癌细胞移植瘤质量的影响Figure 6 The effect of JMJD1A downregulation on the xenografts weight in nude mice inoculated with cervical cancer cells
3 讨论
宫颈癌是最常见的妇科恶性肿瘤之一[1]。近年来随着宫颈癌普查、普治工作的开展,其死亡率均明显下降。其治疗手段主要为手术联合放化疗为主,其他治疗(热疗、免疫治疗等)为辅的综合治疗。而宫颈癌的5年生存率仅为55%左右,术后复发、转移及放化疗耐药等仍是目前临床治疗的难题。研究证实,宫颈癌的发生与高危型人乳头瘤病毒(human papilloma virus,HPV)的感染密切相关,但并非所有感染HPV者都会发展成为宫颈癌[9]。有关宫颈癌发病机制至今尚不明确,其发生发展是一个多基因参与、多因素作用、多阶段进展的病理过程,涉及癌基因的激活与抑癌基因的异常调控等[10,11]。
组蛋白是真核生物染色体的基本结构蛋白。组蛋白甲基化修饰是一个可逆的动态的调节过程,甲基化与去甲基化平衡失调与肿瘤发生关系密切,其与组蛋白乙酰化常称为“第二套遗传密码”,是当前遗传学和肿瘤领域的研究热点之一[12]。已知组蛋白去甲基化酶包括赖氨酸特异性去甲基化酶(lysine-specific-demethylase,LSD)家族和含JmjC结构域的JMJD家族[13,14]。JMJD家族成员众多,且催化底物多样,它们广泛参与了发育学多个阶段的生物学作用,其突变或功能异常可造成疾病的发生[15],其中JMJD1A是研究较为深入的一种。JMJD1A通过降低靶基因启动子H3K9me1/2表达水平、调节染色质的空间结构、影响转录,从而达到调控蛋白质表达的目的,参与精子生成、能力代谢等多种生物学功能。已有研究表明,JMJD1A在多种肿瘤中高表达,发挥原癌基因作用。Fan等[16]研究证实JMJD1A通过在转录和翻译水平上控制c-Myc表达调控前列腺癌细胞的增殖和存活。Peng等[17]研究证实JMJD1A在结肠癌中过度表达,且与患者较短的总生存期相关。Yamada等[18]研究提示JMJD1A在肝癌中表达越高,其复发率相对越高。更多的研究结果证实JMJD1A还高表达于肾癌[19]、膀胱癌及乳腺肿瘤[20,21]等肿瘤中,且均能促进肿瘤细胞增殖,下调JMJD1A表达后能显著抑制癌细胞增殖和减少异种移植瘤的发生。与上述结果一致,本研究结果表明,与正常宫颈组织相比,JMJD1A表达水平在宫颈癌组织中明显升高,采用shRNA干扰宫颈癌细胞系中JMJD1A表达后,发现明显抑制体外宫颈癌细胞的生长及增殖。进一步的裸鼠体内成瘤实验提示干扰JMJD1A下调后可显著降低宫颈癌细胞裸鼠体内肿瘤形成能力,其肿瘤体积及质量均小于对照组(P<0.001),证实JMJD1A确实促进宫颈癌细胞的生长及增殖,揭示JMJD1A可能在宫颈癌发生中发挥癌基因作用。
综上所述,本研究证实JMJD1A下调后能够显著抑制宫颈癌细胞的生长增殖及瘤体的形成,提示其可能是治疗宫颈癌的潜在分子靶点,深入了解JMJD1A在宫颈癌发生发病及侵袭转移中的作用,不仅对基因表达、调控、遗传等生理机制有更深入的了解,而且对宫颈癌等肿瘤的诊治及预后判读都具有重要意义。
